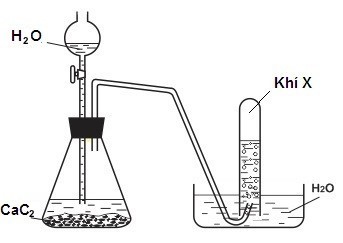
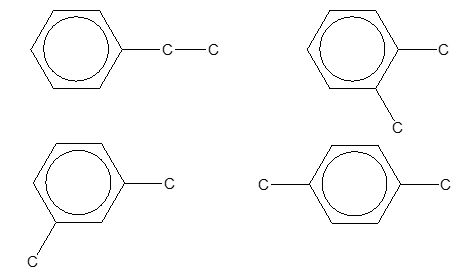
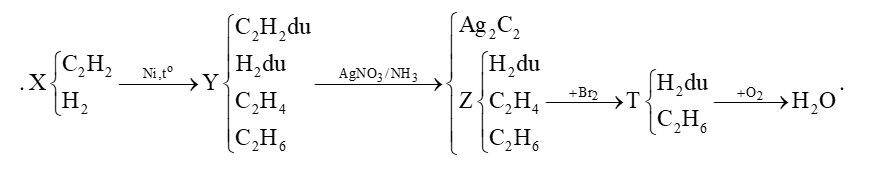
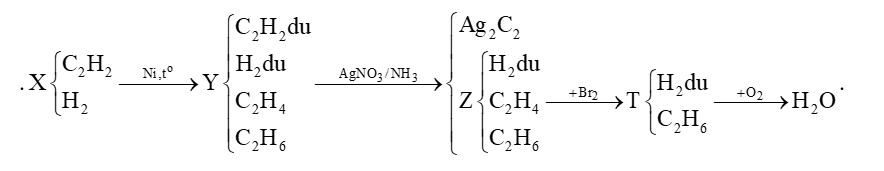
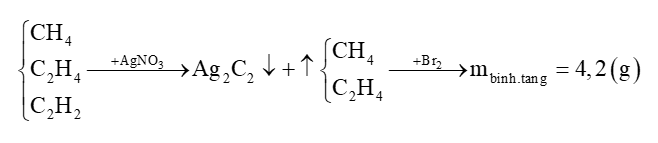Đề số 5 - Đề kiểm tra giữa kì II - Hóa học 11 có lời giảiề số 5 - Đề kiểm tra giữa kì II - Hóa học 11 có đáp án và lời giải chi tiết Đề bài Câu 1 : Phương pháp điều chế etilen trong phòng thí nghiệm là A. cracking ankan. B. tách H2 từ etan. C. cho C2H2 tác dụng với H2, xúc tác Pd/PbCO3. D. đun C2H5OH với H2SO4 đặc ở 170oC.
Câu 3 : Dẫn hỗn hợp 8,96 lít (đktc) gồm metan, etilen và axetilen qua dung dịch AgNO3 dư thu được 24 gam kết tủa, khí thoát ra dẫn qua dung dịch Br2 dư thấy bình tăng thêm 4,2 gam. Phần trăm thể tích khí metan trong hỗn hợp là A. 62,5%. B. 37,5%. C. 25%. D. 57,3%. Câu 4 : Khi đốt cháy hoàn toàn hiđrocacbon X thu được số mol CO2 nhỏ hơn số mol H2O. Hỏi X thuộc dãy đồng đẳng nào sau đây? A. Ankin. B. Anken. C. Ankan. D. Ankađien. Câu 5 : Cho các chất: CH2=CH-CH=CH2, CH3-CH2-CH=C(CH3)2, CH3-CH=CH-CH=CH2, CH3-CH=CH2, CH3-CH=CH-CH3. Số chất có đồng phân hình học là A. 4. B. 1. C. 3. D. 2. Câu 6 : Hỗn hợp khí X gồm một ankan và một anken. Tỉ khối của X so với H2 bằng 11,25. Đốt cháy hoàn toàn 4,48 lít X, thu được 6,72 lít CO2 (các thể tích khí đo ở đktc). Công thức của ankan và anken lần lượt là A. CH4 và C2H4. B. C2H6 và C2H4. C. CH4 và C3H6. D. CH4 và C4H8. Câu 7 : Chất nào dưới đây thuộc dãy đồng đẳng của ankan? A. C2H2. B. C4H10. C. C3H4. D. C6H12. Câu 8 : Hiđrocacbon làm mất màu dung dịch brom ở điều kiện thường là A. benzen. B. o-xilen. C. etilen. D. toluen. Câu 9 : Đốt cháy hoàn toàn một hiđrocacbon (X) thu được số mol H2O gấp đôi số mol CO2. Công thức phân tử của X là A. C3H8. B. C4H10. C. CH4. D. C2H6. Câu 10 : Có hai ống nghiệm, mỗi ống chứa 1 ml dung dịch brom trong nước có màu vàng nhạt. Thêm vào ống thứ nhất 1 ml hexan và ống thứ hai 1 ml hex-1-en. Lắc đều cả hai ống nghiệm, sau đó để yên hai ống nghiệm trong vài phút. Hiện tượng quan sát được là A. có sự tách lớp các chất lỏng ở cả hai ống nghiệm. B. màu vàng nhạt vẫn không đổi ở ống nghiệm thứ nhất. C. ở ống nghiệm thứ hai cả hai lớp chất lỏng đều không màu. D. A, B, C đều đúng. Câu 11 : Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3 thu được 17,64 gam kết tủa. Mặt khác, a mol X phản ứng tối đa với 0,44 mol H2. Giá trị của a là A. 0,32. B. 0,46. C. 0,22. D. 0,34. Câu 12 : Sản phẩm chính của phản ứng cộng hợp HCl và propen là A. CH3CHClCH3. B. CH3CH2CH2Cl. C. CH2ClCH2CH3. D. ClCH2CH2CH3. Câu 13 : Cho 3,36 lít (đktc) hỗn hợp gồm etan và etilen đi chậm qua dung dịch brom dư. Sau phản ứng khối lượng bình brom tăng thêm 2,8 gam. Số mol etan và etilen trong hỗn hợp lần lượt là A. 0,05 và 0,10. B. 0,10 và 0,05. C. 0,12 và 0,03. D. 0,03 và 0,12. Câu 14 : Toluen tác dụng với Br2 chiếu sáng (tỉ lệ mol 1:1), thu được sản phẩm hữu cơ là A. m-bromtoluen. B. phenylbromua. C. o-bromtoluen. D. benzylbromua. Câu 15 : Cho các chất: But-1-en, but-1-in, buta-1,3-đien, vinylaxetilen, isobutilen, anlen (propađien). Có bao nhiêu chất trong số các chất trên khi phản ứng hoàn toàn với khí H2 dư (xúc tác Ni, nung nóng) tạo ra butan? A. 6. B. 5. C. 3. D. 4. Câu 16 : Hiđrocacbon là đồng đẳng của axetilen, A là hợp chất nào dưới đây? A. C6H8. B. C3H6. C. C4H6. D. C5H10. Câu 17 : X là hỗn hợp 2 hiđrocacbon mạch hở, cùng dãy đồng đẳng. Để đốt cháy hết 2,8 gam X cần 6,72 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư được m gam kết tủa. Giá trị của m là A. 25 gam. B. 30 gam. C. 15 gam. D. 20 gam. Câu 18 : Axetilen không phản ứng được với A. H2, Ni, toC. B. dung dịch NaOH. C. dung dịch KMnO4. D. dung dịch Br2. Câu 19 : Để làm sạch khí etilen có lẫn axetilen, người ta dẫn hỗn hợp khí qua một lượng dư dung dịch A. Br2. B. AgNO3/NH3. C. HCl. D. KMnO4. Câu 20 : Để phân biệt 2 bình chứa khí etan và etilen, có thể dùng thuốc thử nào sau đây? A. nước. B. dung dịch Br2. C. khí HCl. D. dung dịch Ca(OH)2. Câu 21 : Công thức phân tử của etilen là A. CH4. B. C2H4. C. C2H2. D. C2H6. Câu 22 : Số đồng phân hiđrocacbon thơm ứng với công thức phân tử C8H10 là A. 5. B. 6. C. 4. D. 3. Câu 23 : Chất nào sau đây là chất lỏng ở nhiệt độ thường? A. Metan. B. Axetilen. C. Etilen. D. Pentan. Câu 24 : Công thức phân tử chung của ankin là A. CnH2n+2 với n ≥ 1. B. CnH2n-2 với n ≥ 3. C. CnH2n-2 với n ≥ 2. D. CnH2n với n ≥ 2. Câu 25 : Khi dẫn axetilen vào dung dịch AgNO3 trong NH3, thấy có hiện tượng A. có khí sinh ra. B. dung dịch AgNO3 mất màu. C. tạo kết tủa trắng. D. tạo kết tủa vàng nhạt. Câu 26 : Thành phần chính của "khí thiên nhiên" là A. metan. B. propan. C. etan. D. butan. Câu 27 : Phản ứng trime hóa axetilen ở 600oC với xúc tác than hoạt tính cho sản phẩm là A. C3H6. B. C6H6. C. C6H10. D. C2H4. Câu 28 : Buta-1,3-đien dùng làm nguyên liệu để sản xuất cao su tổng hợp như: cao su buna, cao su buna-S, … Công thức cấu tạo của buta-1,3-đien là A. CH2=C-CH=CH2. B. CH2=CH2. C. CH2=C(CH3)CH=CH2. D. CH2=CH-C2H5. Câu 29 : Dẫn 4,48 lít (đktc) một anken X qua dung dịch nước brom dư, sau phản ứng hoàn toàn thấy dung dịch brom tăng 8,4 gam. Công thức của anken X là A. C2H4. B. C3H6. C. C4H8. D. C5H10. Câu 30 : Câu nào sau đây là sai? A. Ankin có số đồng phân ít hơn anken tương ứng (số C ≥ 4). B. Ankin tương tự anken đều có đồng phân hình học. C. But-1-in phản ứng với dung dịch AgNO3/NH3 còn but-2-in thì không phản ứng. D. Ankin và anken đều làm mất màu dung dịch nước brom ở nhiệt độ thường. Câu 31 : Anken X có công thức cấu tạo CH3-CH2-C(CH3)=CH-CH3. Tên của X là A. 3-metylpent-2-en. B. isohexan. C. 3-metylpent-3-en. D. 2-etylbut-2-en. Câu 32 : C2H2 và C2H4 phản ứng được với tất cả các chất trong dãy nào sau đây? A. H2; NaOH; dung dịch HCl. B. CO2; H2; dung dịch KMnO4. C. dung dịch Br2; dung dịch HCl; dung dịch AgNO3/NH3. D. dung dịch Br2; dung dịch HCl; dung dịch KMnO4. Câu 33 : Đốt cháy hoàn toàn m gam hỗn hợp X gồm CH4, C3H6, C4H10 thu được 17,6 gam CO2 và 10,8 gam H2O. Giá trị m là A. 6 gam. B. 4 gam. C. 8 gam. D. 2 gam. Câu 34 : Đèn xì axetilen - oxi dùng để làm gì? A. Hàn nhựa. B. Nối thủy tinh. C. Hàn và cắt kim loại. D. Xì sơn lên tường. Câu 35 : Đốt cháy hoàn toàn m gam một hiđrocacbon X mạch hở thì thu được 26,4 gam CO2 và 10,8 gam H2O. X thuộc dãy đồng đẳng nào sau đây? A. Ankin. B. Ankađien. C. Anken. D. Ankan. Câu 36 : Tính chất hóa học đặc trưng của ankan là A. phản ứng cộng. B. phản ứng tách. C. phản ứng thế. D. phản ứng phân hủy. Câu 37 : Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là A. 1,25. B. 0,80. C. 1,50. D. 1,00. Câu 38 : Một bình kín chứa hỗn hợp X gồm 0,06 mol axetilen; 0,09 mol vinylaxetilen; 0,16 mol H2 và một ít bột Ni. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hiđrocacbon (không chứa but-1-in) có tỉ khối hơi đối với H2 là 328/15. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3/NH3 dư, thu được m gam kết tủa vàng nhạt và 1,792 lít (đktc) hỗn hợp khí Z thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp Z cần vừa đúng 50 ml dung dịch Br2 1M. Các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 14,37. B. 15,18. C. 13,56. D. 28,71. Câu 39 : Cho các chất sau: metan, axetilen, isopren, vinylaxetilen, benzen và buta-1,3-đien. Số chất làm mất màu dung dịch brom ở nhiệt độ thường là A. 4. B. 3. C. 6. D. 5. Câu 40 : Đốt cháy hoàn toàn 2,24 lít hiđrocacbon X, thu được 8,96 lít CO2 (thể tích các khí đo ở đktc). X tác dụng với dung dịch AgNO3 trong NH3, tạo ra kết tủa. Công thức cấu tạo của X là A. CH3-C≡CH. B. CH3-CH2-C≡CH. C. CH3-C≡C-CH3. D. CH3-CH=CH-CH3. Lời giải chi tiết Câu 1 Phương pháp: Lý thuyết về anken. Hướng dẫn giải: Trong phòng thí nghiệm, người ta điều chế etilen bằng cách đun C2H5OH với H2SO4 đặc ở 170oC. PTHH: \({{C}_{2}}{{H}_{5}}OH\xrightarrow{{{H}_{2}}S{{O}_{4}}dac,{{170}^{o}}C}{{C}_{2}}{{H}_{4}}+{{H}_{2}}O\) Đáp án D Câu 2 Phương pháp: Từ hình vẽ thí nghiệm xác định được khí X. Xét từng phương án để xác định tính đúng/sai của các nhận xét. Hướng dẫn giải: PTHH: CaC2 + 2H2O → C2H2 ↑ (X) + Ca(OH)2 A đúng, vì 1 phân tử C2H2 cộng được tối đa 2 phân tử H2. B đúng. C đúng, CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg ↓ vàng + 2NH4NO3. D sai, X (C2H2) gồm C, H còn ancol etylic (C2H5OH) gồm C, H, O. Đáp án D Câu 3 Phương pháp: nC2H2 = nAg2C2 mC2H4 = mbình tăng nCH4 = nhh - nC2H2 - nC2H4 Ở cùng điều kiện thì phần trăm về thể tích bằng phần trăm về số mol. Tính phần trăm về thể tích của khí X bất kì trong hỗn hợp: \(\% {V_X} = \frac{{{n_X}}}{{{n_{hon.hop}}}}.100\% \) Hướng dẫn giải: nhỗn hợp khí = 8,96/22,4 = 0,4 mol nC2H2 = nAg2C2 = 24/240 = 0,1 mol mC2H4 = mbình tăng = 4,2 gam → nC2H4 = 4,2/28 = 0,15 mol nCH4 = 0,4 - 0,1 - 0,15 = 0,15 mol Ở cùng điều kiện thì phần trăm về thể tích bằng phần trăm về số mol: %VCH4 = \(\frac{{0,15}}{{0,4}}.100\% \) = 37,5% Đáp án B Câu 4 Hướng dẫn giải: Khi đốt cháy hiđrocacbon thu được nH2O > nCO2 ⟹ Hiđrocacbon đó là ankan. Đáp án C Câu 5 Các chất đó đồng phân hình học là: CH3-CH=CH-CH=CH2, CH3-CH=CH-CH3 (2 chất). Đáp án D Câu 6 Phương pháp: - Tính \(\bar C = \frac{{{n_{C{O_2}}}}}{{{n_X}}}\) → Ankan là CH4 - Đặt \(\left\{ {\begin{array}{*{20}{l}}{C{H_4}:{a^{mol}}}\\{{C_n}{H_{2n}}:{b^{mol}}}\end{array}} \right.\) Lập hệ 3 phương trình 3 ẩn a, b, n dựa vào: + Số mol hỗn hợp X + Số mol CO2 + Khối lượng mol trung bình của X Giải hệ tìm được a, b, n. - Kết luận thành phần của hỗn hợp X. Hướng dẫn giải: nX = 0,2 mol nCO2 = 0,3 mol \(\bar C = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = \frac{{0,3}}{{0,2}} = 1,5\) → Ankan phải là CH4. Đặt \(\left\{ {\begin{array}{*{20}{l}}{C{H_4}:{a^{mol}}}\\{{C_n}{H_{2n}}:{b^{mol}}}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{{n_X} = a + b = 0,2}&{\left( 1 \right)}\\{{n_{C{O_2}}} = a + nb = 0,3}&{\left( 2 \right)}\\{{{\bar M}_X} = \frac{{16{\rm{a}} + 14nb}}{{0,2}} = 11,25.2 = 22,5}&{\left( 3 \right)}\end{array}} \right.\) Từ (2) và (3) → a = 0,15 và nb = 0,15 (Lưu ý: Ta coi 2 ẩn là a và nb). Kết hợp với (1) → a = 0,15; b = 0,05; n = 3. Vậy hỗn hợp chứa CH4 và C3H6. Đáp án C Câu 7 Phương pháp: Ankan có công thức tổng quát là CnH2n+2 (n ≥ 1). Hướng dẫn giải: Ankan có công thức tổng quát là CnH2n+2 (n ≥ 1). → C4H10 thuộc dãy đồng đẳng ankan. Đáp án B Câu 8 Hướng dẫn giải: Etilen (CH2=CH2) có chứa liên kết C=C kém bền nên làm mất màu dung dịch Br2 ở điều kiện thường. Đáp án C Câu 9 Phương pháp: Tính tỉ lệ \(\frac{H}{C} = \frac{{2{n_{{H_2}O}}}}{{{n_{C{O_2}}}}}\) Từ đó suy ra hiđrocacbon trong các phương án A, B, C, D thỏa mãn. Hướng dẫn giải: \(\frac{H}{C} = \frac{{2{n_{{H_2}O}}}}{{{n_{C{O_2}}}}} = 2.2 = 4\) → X là CH4. Đáp án C Câu 10 Phương pháp: Tính chất hóa học của ankan, anken. Hướng dẫn giải: Hexan là ankan, không làm mất màu dd Br2. Hex-1-en là anken, làm mất màu dd Br2. → Hiện tượng: ống 1 màu vàng không đổi, ống 2 màu vàng nhạt hơn lúc đầu hoặc mất màu. Đáp án B Câu 11 Phương pháp: - Khi tác dụng với AgNO3/NH3 thì chỉ có propin phản ứng: C3H4 \(\xrightarrow{AgN{{O}_{3}}/N{{H}_{3}}}\) C3H3Ag ↓ → nC3H4 = nC3H3Ag - Khi tác dụng tối đa với H2 thì: C2H4 + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) C2H6 C3H4 + 2H2 \(\xrightarrow{Ni,{{t}^{o}}}\) C3H8 → nH2 = nC2H4 + 2nC3H4 → nC2H4 Từ đó xác định được giá trị của a. Hướng dẫn giải: - Khi tác dụng với AgNO3/NH3 thì chỉ có propin phản ứng: C3H4 \(\xrightarrow{AgN{{O}_{3}}/N{{H}_{3}}}\) C3H3Ag ↓ → nC3H4 = nC3H3Ag = 17,64/147 = 0,12 mol. - Khi tác dụng tối đa với H2 thì: C2H4 + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) C2H6 C3H4 + 2H2 \(\xrightarrow{Ni,{{t}^{o}}}\) C3H8 → nH2 = nC2H4 + 2nC3H4 → 0,44 = nC2H4 + 2.0,12 → nC2H4 = 0,2 mol. Vậy a = nC2H4 + nC3H4 = 0,2 + 0,12 = 0,32 mol. Đáp án A Câu 12 Phương pháp: Quy tắc cộng Mac-cop-nhi-cop: Trong phản ứng cộng axit hoặc nước (kí hiệu chung là HA) vào liên kết C=C của anken, H (phần tử mang điện tích dương) ưu tiên cộng vào C mang nhiều H hơn (cacbon bậc thấp hơn), còn A (phần tử mang điện tích âm) ưu tiên cộng vào C mang ít H hơn (cacbon bậc cao hơn). Hướng dẫn giải: CH2=CH-CH3 + HCl → CH3-CHCl-CH3. Đáp án A Câu 13 Phương pháp: Dẫn hỗn hợp gồm C2H6 và C2H4 qua Br2 thì chỉ có C2H4 phản ứng và bị hấp thụ vào dung dịch Br2 → mC2H4 = mbình tăng → nC2H4 → nC2H6 = nhh - nC2H4 Hướng dẫn giải: Dẫn hỗn hợp gồm C2H6 và C2H4 qua Br2 thì chỉ có C2H4 phản ứng và bị hấp thụ vào dung dịch Br2 → mC2H4 = mbình tăng = 2,8 gam → nC2H4 = 2,8/28 = 0,1 mol → nC2H6 = nhh - nC2H4 = 0,15 - 0,1 = 0,05 mol Vậy số mol etan và etilen trong hỗn hợp lần lượt là 0,05 và 0,1. Đáp án A Câu 14 Phương pháp: Khi ankylbenzen tác dụng với Br2 khan có ánh sáng thì xảy ra phản ứng thế ở gốc ankyl tương tự như ankan. Hướng dẫn giải: Khi có ánh sáng thì xảy ra phản ứng thế ở ngoài vòng: C6H5CH3 + Br2 \(\xrightarrow[1:1]{a/s}\) C6H5CH2Br (benzylbromua) + HBr Lưu ý: Phân biệt 2 gốc phenyl (C6H5-) và benzyl (C6H5CH2-). Đáp án D Câu 15 Phương pháp: Trong bài này các chất thỏa mãn đủ các dữ kiện sau: + Hiđrocacbon không no có 4C (hoặc xicloankan có 4C, phần này giảm tải); + Mạch C không phân nhánh. Từ đó lựa chọn các chất phù hợp. Hướng dẫn giải: Trong bài này các chất thỏa mãn đủ các dữ kiện sau: + Hiđrocacbon không no có 4C (hoặc xicloankan có 4C, phần này giảm tải); + Mạch C không phân nhánh. Phân tích các chất: + But-1-en: CH2=CH-CH2-CH3 → thỏa mãn + But-1-in: CH≡C-CH2-CH3 → thỏa mãn + Buta-1,3-đien: CH2=CH-CH=CH2 → thỏa mãn + Vinylaxetilen: CH2=CH-C≡CH → thỏa mãn + Isobutilen: CH2=C(CH3)-CH3 → không thỏa mãn do phân nhánh + Anlen (propađien): CH2=C=CH2 → không thỏa mãn do có 3C Vậy có 4 chất thỏa mãn. Đáp án D Câu 16 Phương pháp: CTTQ của ankin: CnH2n-2 (n ≥ 2). Hướng dẫn giải: Axetilen là ankin. CTTQ của ankin: CnH2n-2 (n ≥ 2). ⟹ C4H6 là đồng đẳng của axetilen. Đáp án C Câu 17 Phương pháp: Đặt ẩn là số mol của CO2 và H2O. Lập hệ 2 phương trình 2 ẩn: +) BTKL: mX + mO2 = mCO2 + mH2O (1) +) Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O (2) Giải hệ tìm được số mol CO2 và H2O. Khi cho sản phẩm cháy vào dd Ca(OH)2 dư → nCaCO3 = nCO2 → khối lượng kết tủa. Hướng dẫn giải: Đặt \(\left\{ {\begin{array}{*{20}{l}}{{n_{C{O_2}}} = {a^{mol}}}\\{{n_{{H_2}O}} = {b^{mol}}}\end{array}} \right.\). +) BTKL: mX + mO2 = mCO2 + mH2O → 44a + 18b = 2,8 + 32.0,3 = 12,4 (1) +) Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O → 2a + b = 2.0,3 = 0,6 (2) Giải hệ được a = b = 0,2 mol. Khi cho sản phẩm cháy vào dd Ca(OH)2 dư → nCaCO3 = nCO2 = 0,2 mol → m = mCaCO3 = 0,2.100 = 20 gam. Đáp án D Câu 18 Phương pháp: Tính chất hóa học của ankin. Hướng dẫn giải: Axetilen có chứa liên kết ba kém bền nên phản ứng được với H2 (Ni, to), KMnO4, dd Br2. Axetilen không phản ứng được với dd NaOH. Đáp án B Câu 19 Phương pháp: Để làm sạch một chất bị lẫn tạp chất ta cần chọn hóa chất sao cho hóa chất này phản ứng với các tạp chất và không phản ứng với chất cần làm sạch. Hướng dẫn giải: Để làm sạch C2H4 bị lẫn C2H2 ta dẫn hỗn hợp khí qua một lượng dư dung dịch AgNO3/NH3 do có phản ứng: C2H2 + 2AgNO3 + 2NH3 → Ag2C2 + 2NH4NO3 Đáp án B Câu 20 Phương pháp: Để phân biệt các chất ta cần chọn thuốc thử cho hiện tượng khác nhau giữa các chất. Hướng dẫn giải: Để phân biệt 2 bình chứa khí etan và etilen, có thể dùng thuốc thử là dd Br2: + Chất làm mất màu dd Br2 → Etilen (CH2=CH2). + Chất không làm mất màu dd Br2 → Etan (CH3-CH3). Đáp án B Câu 21 Hướng dẫn giải: Etilen có CTCT là CH2=CH2 → CTPT là C2H4. Đáp án B Câu 22 Hướng dẫn giải: → 4 đồng phân. Đáp án C Câu 23 Phương pháp: Ghi nhớ: Các hiđrocacbon có số C ≤ 4 là chất khí ở nhiệt độ thường. Hướng dẫn giải: Ghi nhớ: Các hiđrocacbon có số C ≤ 4 là chất khí ở nhiệt độ thường. → Pentan (C5H12) là chất lỏng ở nhiệt độ thường. Đáp án D Câu 24 Hướng dẫn giải: Công thức phân tử chung của ankin là CnH2n-2 với n ≥ 2. Đáp án C Câu 25 Phương pháp: Tính chất hóa học của ankin. Hướng dẫn giải: Khi dẫn axetilen vào dung dịch AgNO3 trong NH3, thấy xuất hiện kết tủa màu vàng nhạt: CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg ↓ vàng + 2NH4NO3. Đáp án D Câu 26 Hướng dẫn giải: Thành phần chính của "khí thiên nhiên" là metan (CH4). Đáp án A Câu 27 Hướng dẫn giải: 3C2H2 \(\xrightarrow{xt:C,{{600}^{o}}C}\) C6H6 Đáp án B Câu 28 Phương pháp: Lý thuyết về ankađien. Hướng dẫn giải: Công thức cấu tạo của buta-1,3-đien là CH2=C-CH=CH2. Đáp án A Câu 29 Phương pháp: Khối lượng bình tăng bằng khối lượng của chất bị hấp thụ. Hướng dẫn giải: manken = mdd tăng = 8,4 gam → Manken = manken : nanken = 8,4 : 0,2 = 42. Giả sử anken có công thức CnH2n (n ≥ 2) → 14n = 42 → n = 3. Vậy CTPT anken là C3H6. Đáp án B Câu 30 Phương pháp: Lý thuyết về ankin. Hướng dẫn giải: A đúng. B sai, ankin không có đồng phân hình học. C đúng, do but-1-in có liên kết ba đầu mạch còn but-2-in không có liên kết ba đầu mạch. D đúng, do chúng đều chứa liên kết bội kém bền. Đáp án B Câu 31 Phương pháp: Tên thay thế của anken: + Xuất phát từ tên của ankan có cùng mạch cacbon bằng cách đổi đuôi -an thành -en. Từ C4H8 trở đi cần thêm số chỉ vị trí nguyên tử cacbon bắt đầu liên kết đôi. + Mạch chính là mạch C dài nhất chứa liên kết đôi. + Mạch C được đánh từ phía gần liên kết đôi hơn. Hướng dẫn giải: 5CH3-4CH2-3C(CH3)=2CH-1CH3 → Tên gọi là 3-metylpent-2-en. Đáp án A Câu 32 Phương pháp: Tính chất hóa học của ankin và anken. Hướng dẫn giải: - Loại A vì cả 2 chất đều không phản ứng với dd NaOH. - Loại B vì cả 2 chất đều không phản ứng với CO2. - Loại C vì C2H4 không phản ứng với AgNO3/NH3. - D thỏa mãn. Đáp án D Câu 33 (ID:445261) Phương pháp: \(\xrightarrow{BTNT.C}{{n}_{C}}={{n}_{C{{O}_{2}}}}\) \(\xrightarrow{BTNT.H}{{n}_{H}}=2{{n}_{{{H}_{2}}O}}\) → mX = mC + mH Hướng dẫn giải: \(\xrightarrow{BTNT.C}{{n}_{C}}={{n}_{C{{O}_{2}}}}=\frac{17,6}{44}=0,{{4}^{mol}}\) \(\xrightarrow{BTNT.H}{{n}_{H}}=2{{n}_{{{H}_{2}}O}}=2.\frac{10,8}{18}=1,{{2}^{mol}}\) → mX = mC + mH = 0,4.12 + 1,2.1 = 6 gam. Đáp án A Câu 34 (ID:445262) Hướng dẫn giải: Đèn xì axetilen - oxi có nhiệt độ rất cao (≈ 3000oC) nên được đùng để hàn và cắt kim loại. Đáp án C Câu 35 (ID:445263) Phương pháp: So sánh số mol CO2 và H2O. Kết luận dãy đồng đẳng: + Nếu nH2O > nCO2 → Ankan. + Nếu nH2O = nCO2 → Anken hoặc xicloankan. + Nếu nH2O < nCO2 → Không kết luận được. Hướng dẫn giải: nCO2 = 26,4/44 = 0,6 mol nH2O = 10,8/18 = 0,6 mol Ta thấy nCO2 = nH2O ⟹ Hiđrocacbon X thuộc dãy đồng đẳng anken. Đáp án C Câu 36 Phương pháp: Lý thuyết về ankan. Hướng dẫn giải: Tính chất hóa học đặc trưng của ankan là phản ứng thế. Đáp án C Câu 37 Phương pháp: Y tác dụng với AgNO3/NH3 thu được kết tủa → Y chứa C2H2 dư Sau khi dẫn Z qua dd Br2 dư còn hỗn hợp khí T nên T chứa H2 và C2H6 → Y chứa H2 dư Sơ đồ: Ta có: nC2H2(dư) = nAg2C2 nC2H4 = nBr2 Bảo toàn nguyên tố H cả quá trình: 2nC2H2(bđ) + 2nH2(bđ) = 2nC2H2(dư) + 4nC2H4 + 2nH2O Thay số tính được a = (nC2H2(bđ) + nH2(bđ)). Hướng dẫn giải: Y tác dụng với AgNO3/NH3 thu được kết tủa → Y chứa C2H2 dư Sau khi dẫn Z qua dd Br2 dư còn hỗn hợp khí T nên T chứa H2 và C2H6 → Y chứa H2 dư Sơ đồ: Ta có: nC2H2(dư) = nAg2C2 = 24/240 = 0,1 mol nC2H4 = nBr2 = 40/160 = 0,25 mol Bảo toàn nguyên tố H cả quá trình: 2nC2H2(bđ) + 2nH2(bđ) = 2nC2H2(dư) + 4nC2H4 + 2nH2O ⇔ nC2H2(bđ) + nH2(bđ) = nC2H2(dư) + 2nC2H4 + nH2O ⇔ a = 0,1 + 2.0,25 + 0,65 ⇔ a = 1,25 Đáp án A Câu 38 Phương pháp: - Trong phản ứng cộng H2 của hiđrocacbon thì ta luôn có: ngiảm = nH2 pư - Phương pháp bảo toàn liên kết π Hướng dẫn giải: BTKL → mX = mY → 0,06.26 + 0,09.52 + 0,16.2 = nY.(656/15) → nY = 0,15 → nH2 pư = ngiảm = nX - nY = 0,06 + 0,09 + 0,16 - 0,15 = 0,16 mol (H2 đã phản ứng hết) Sơ đồ: +) Bảo toàn liên kết π → n π (X) = nH2 pư + 2nC2H2 dư + 3nC4H4 dư + nBr2 → 0,06.2 + 0,09.3 = 0,16 + 2a + 3b + 0,05 (1) +) nC2H2 dư + nC4H4 dư = nY - nZ → a + b = 0,15 - 0,08 = 0,07 (2) Giải hệ (1) (2) được a = 0,03 và b = 0,04 → m = mAg2C2 + mC4H3Ag = 0,03.240 + 0,04.159 = 13,56 gam Đáp án C Câu 39 Phương pháp: Hiđrocacbon làm mất màu dd Br2 có chứa liên kết π kém bền (hoặc là xicloankan có vòng 3 cạnh, phần này giảm tải). Hướng dẫn giải: Các chất làm mất màu dd Br2 là axetilen, isopren, vinylaxetilen, buta-1,3-đien (4 chất). Đáp án A Câu 40 Phương pháp: + Số C = \(\frac{{{n_{C{O_2}}}}}{{{n_X}}}\)(1). + X tác dụng với dung dịch AgNO3/NH3 tạo ra kết tủa → X chứa liên kết ba đầu mạch (2). Kết hợp (1) (2) và các phương án A, B, C, D chọn ra chất phù hợp. Hướng dẫn giải: + Số C = \(\frac{{{n_{C{O_2}}}}}{{{n_X}}}\) = \(\frac{{0,4}}{{0,1}}\) = 4 → X là hiđrocacbon có chứa 4C. + X tác dụng với dung dịch AgNO3/NH3 tạo ra kết tủa → X chứa liên kết ba đầu mạch. Vậy trong 4 phương án thì chất thỏa mãn là CH3-CH2-C≡CH. Đáp án B HocTot.Nam.Name.Vn
|