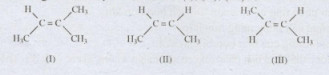
Đề kiểm tra 45 phút (1 tiết) – Đề số 1 – Chương 4 – Hóa học 9Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút (1 tiết) – Đề số 1 – Chương 4 – Hóa học 9 Tổng hợp Đề thi vào 10 có đáp án và lời giải Toán - Văn - Anh Đề bài I.Trắc nghiệm khách qua (4 điểm: mỗi câu 0,5 điểm) Câu 1: Phân tử chất hữu cơ X có 2 nguyên tố C, H. Tỉ khối hơi của X so với hidro là 22. Công thức phân tử của X là? A.C4H8 B.C3H8 C.C3H6 D.C6H6 Câu 2: Cho công thức cấu tạo của các chất (I), (II), (III) Các chất có cùng công thức phân tử là A.(II), (III). B.(I), (III) C.(I),(II) D.(I), (II), (III). Câu 3: Đốt cháy hoàn toàn m gam một hợp chất hữu cơ X (có chứa 2 nguyên tố C, H) thu được 3,36 lít CO2 (đktc) và 4,5 gam H2O. Giá trị của m là (H = 1, C = 12, O = 16) A.4,6 gam B.2,3 gam C.11,1 gam D.không thể xác định Câu 4: Để biết phản ứng: CH4 + Cl2 → CH3Cl + HCl (ánh sáng) đã xảy ra hay chưa người ta A.kiểm tra sản phẩm phản ứng bằng quỳ tím ẩm, quỳ tím hóa đỏ tức phản ứng đã xảy ra. B.chỉ cần cho thể tích CH4 bằng thể tích Cl2. C.kiểm tra thể tích hỗn hợp khí, nếu có phản ứng xảy ra thì thể tích hỗn hợp tăng. D.có thể kiểm tra clo, nếu clo còn tức phản nwgs chưa xảy ra. Câu 5: Phản ứng: A.trùng hợp B.cộng C.hóa hợp D.trùng ngưng Câu 6: Đốt cháy 2,6 gam một chất hữu cơ X, người ta thu được 8,8 gam CO2 và 1,8 gam H2O. Tỉ khối hơi chất X đối với H2 là 13. Công thức phân tử chất X là (H = 1, C = 12, O = 16) A.C2H4 B.C2H2 C.CH4 D.C6H6. Câu 7: Thể tích không khí (O2 chiếm 20% theo thể tích, đktc) cần để đốt cháy 2,6 gam C2H2 là (cho H = 1, C = 12) A.3,36 lít B.4,48 lít C.13,44 lít D.28 lít. Câu 8: Trong những hidrocacbon sau, những chất nào có phản ứng thể với brom? CH3−CH3,CH3−CH=CH2,CH3−C≡CH,C6H6.A.CH3−CH3,CH3−CH=CH2B.CH3−C≡CH,C6H6.C.CH3−CH3,C6H6.D.CH3−CH=CH2,CH3−C≡CH. II.Tự luận (6 điểm) Câu 9 (2 điểm): Etilen và axetilen có tính chất hóa học giống nhau và khác nhau ở những điểm nào? Câu 10 ( 2 điểm): Tính thể tích khí C2H2 (đktc) tạo ra khi cho 10 gam CaC2 (có 36% tập chất) tác dụng hết với H2O (cho C = 12, Ca = 40). Câu 11 (2 điểm): Một hỗn hợp gồm C2H2 và C2H4 có thể tích 5,6 lít khí (đktc) cho qua dung dịch Br2 (dư), dung dịch này nặng thêm 6,8 gam. Tính thể tích mỗi khí trong hỗn hợp ban đầu (cho H = 1, C = 12). Lời giải chi tiết 1.Đáp án
2.Lời giải I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm) Câu 1: (B) dX/H2=22⇒M=2.22=44. Gọi công thức phân tử chất hữu cơ X là: CxHy ⇒12x+y=44. x, y nguyên, dương. Nghiệm thích hợp là x = 3, y = 8. Câu 2: (A) (II), (III) đều có công thức phân tử C4H8. Câu 3: (B) m=mC+mH=3,36.1222,4+4,5.218=2,3gam. Câu 4: (A) Khi tác dụng với nước (ẩm), khí HCl tạo ra dung dịch axit nên làm quỳ tím hóa đỏ. Khí clo khi ẩm có tính tẩy màu, nên bằng cách nào đó người ta loại khí clo còn, chỉ kiểm tra sản phẩm phản ứng (khí HCl). Câu 5: (A) Câu 6: (B) dX/H2=13⇒M=2.13=26mC=8,8.1244=2,4gam,mH=1,8.218=0,2gam⇒mO=2,6−(2,4+0,2)=0nC:nH=2,412:0,21=1:1. Công thức đơn giản nhất CH. Công thức phân tử (CH)n ⇒M=(12+1)n=26⇒n=2. X là C2H2. Câu 7: (D) 2C2H2+5O2→4CO2+2H2OnC2H2=2,6:26=0,1mol⇒nO2=0,25molVkk=0,25.22,4.10020=28lit(đktc). Câu 8: (C) CH3 – CH3 tương tự CH4 có phản ứng thế với brom khi có ánh sáng và brom ở thể tích tương tự khí clo. Benzen (C6H6) khi có Fe làm xúc tác brom sẽ thế nguyên tử H của benzen tương tự như clo. II.Tự luận (6 điểm) Câu 9: (2,5 điểm) Etilen và axetilen có tính chất hóa học gần giống nhau: -Cùng có phản ứng cộng với dung dịch brom. Viết 2 phương trình hóa học. - Cùng có phản ứng cháy khi đốt cho sản phẩm là CO2 và H2O Viết 2 phương trình hóa học: Etilen và axetilen có tính chất hóa học khác nhau: -Etilen có phản ứng trùng hợp tạo polietilen. Câu 10: CaC2+2H2O→Ca(OH)2+C2H2nCaC2=10.(100−36)100=6,4gam⇒nCaC2=6,4:64=0,1mol⇒nC2H2=0,1molVC2H2=0,1.22,4=2,24lit. Câu 11: C2H2+2Br2→C2H2Br4C2H4+Br2→C2H4Br2 Gọi x, y lần lượt là số mol của C2H2 và C2H4 trong 5,6 lít hỗn hợp. Ta có: x+y=5,622,4=0,25 Dung dịch Br2 nặng thêm = khối lượng C2H2 + khối lượng C2H4 =26x+28y=6,8 Giả ra ta có: x=0,1 mol, y=0,15 mol Vậy thể tích C2H2 (đktc) =0,1.22,4=2,24 lít Thể tích C2H4 (đktc) =0,15.22,4=3,36 lít. HocTot.Nam.Name.Vn
>> Học trực tuyến Lớp 9 & Lộ trình UP10 trên Tuyensinh247.com >> Chi tiết khoá học xem: TẠI ĐÂY Đầy đủ khoá học các bộ sách (Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều), theo lộ trình 3: Nền Tảng, Luyện Thi, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả.
|













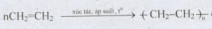 được gọi là phản ứng
được gọi là phản ứng





