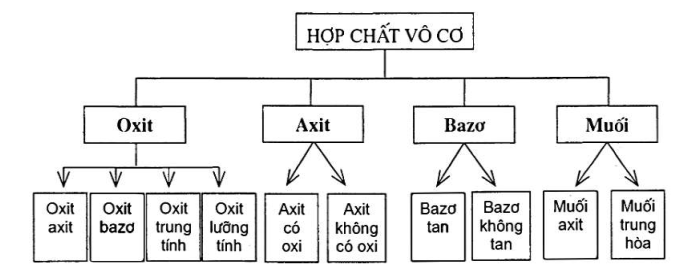
Đề cương ôn tập học kì I Hóa học 9Tổng hợp kiến thức cần nắm vững cần thiết trong đề thi HK1 Hóa học 9 sắp tới Chương 1: CÁC LOẠI HỢP CHẤT VÔ CƠ I. PHÂN LOẠI HỢP CHẤT VÔ CƠ II. OXIT Oxit là hợp chất của nguyên tố oxi với một nguyên tố hóa học khác CTTQ: MxOy VD: Na2O; Fe2O3 Cách gọi tên: + Tên oxit axit = tên nguyên tố phi kim (kèm tiền tố chỉ số nguyên tử kim loại hoặc phi kim) + oxit (kèm tiền tố chỉ số nguyên tử oxi) Một số tiền tố chỉ số nguyên tử: mono : 1; đi : 2; Tri : 3..... VD: CO2 : Cacbon dioxit P2O5: Đi photpho penta oxit + Tên oxit bazo = Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố kim loại có nhiều hóa trị) + oxit VD: Fe2O3 : Sắt (III) oxit Tính chất hóa học
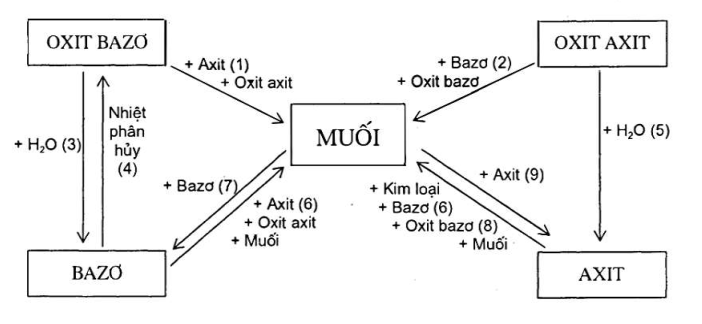
III. AXIT Axit là hợp chất mà phân tử có một hay nhiều nguyên tử hidro liên kết với gốc axit. CTTQ: HnA VD: HCl, H2SO4, HNO3, H3PO4... Cách gọi tên: a. Axit không có oxi: Tên axit = Axit + tên phi kim + hidric VD: HCl: axit clohidric HF: axit flohidric b. Axit có oxi: Tên axit = Axit + tên phi kim + ic VD: H2SO4 : Axit sunfuric HNO3: Axit nitric Axit có ít nguyên tử oxi : Tên axit = Axit + tên phi kim + ơ VD: H2SO3 : Axit sunfurơ Tính chất hóa học a. Đổi màu chất chỉ thị Axit làm đổi màu quỳ tím sang màu đỏ b. Tác dụng với oxit bazo => Muối + H2O VD: H2SO4 + BaO → BaSO4 + H2O c. Tác dụng với bazo => Muối + H2O VD: 2HCl + Cu(OH)2 → CuCl2 + 2H2O d. Tác dụng với kim loại => Muối + H2 (dung dịch HCl, H2SO4 tác dụng KL (trừ một số KL: Ag, Cu, ...) H2SO4 + Fe → FeSO4 + H2 e. Tác dụng với muối => Muối mới + axit mới (Sản phẩm sinh ra là chất dễ bay hơi. hoặc muối mới không tan) * Lưu ý: Al, Fe, Cr thụ động trong HNO3 đặc nguội, H2SO4 đặc nguội H2SO4 đặc nóng, HNO3 tác dụng với hầu hết các kim loại (trừ Au, Pt) và không sinh ra khí H2 Cu + H2SO4 đặc → CuSO4 + SO2 + 2H2O IV. BAZO Bazo là hợp chất gồm một nguyên tử kim loại liên kết cới một hay nhiều nhóm hidroxit (OH) CTTQ: M(OH)n VD: NaOH; Fe(OH)3 Cách gọi tên bazo: Tên bazo = Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố hóa trị có nhiều hóa trị) + hidroxit VD: Fe(OH)2 : Sắt (II) hidroxit NaOH: Natri hiroxit Tính chất hóa học - Tác dụng với axit => Muối + H2O Ca(OH)2 + H2SO4 → CaSO4 + 2H2O - Bazo tan làm đổi màu chất chỉ thị + Qùy tím chuyển thành màu xanh, phenol phtalein chuyển thành màu hồng - Bazo tan tác dụng với oxit axit => Muối + H2O Ba(OH)2 + CO2 → BaCO3 + H2O - Bazo tan tác dụng với dung dịch muối => Muối mới + Bazo mới (ĐK: Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4 - Bazo không tan bị nhiệt phân hủy => Oxit bazo + H2O Cu(OH)2 .\(\xrightarrow{{{t}^{0}}}\).CuO + H2O V. MUỐI Muối là hợp chất mà phân tử gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit CTTQ: AxBy A là kim loại, B là gốc axit VD: K2SO4; CaCO3, ... Tên gọi: Muối trung hòa: Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố kim loại có nhiều hóa trị) + Tên gốc axit VD: Na2SO4 : Natri sunfat Muối axit : Tên nguyên tố kim loại + hidro + tên gốc axit VD: NaHCO3 : Natri hidrocacbonat Tính chất hóa học -Dung dịch muối + kim loại → Muối mới + KL mới VD: CuSO4 + Fe → FeSO4 + Cu - Muối + axit → Muối mới + axit mới (Sản phẩm sinh ra phải có chất kết tủa, hoặc khí bay ra) VD: CaCO3 + HCl → CaCl2 + CO2 + H2O - Dung dịch muối + dung dịch bazo => Muối mới + bazo mới (Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa) VD: CuSO4 + NaOH → Cu(OH)2 + Na2SO4 - Dung dịch muối + dung dịch muối => 2 muối mới (Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa) VD: Na2SO4 + BaCl2 → BaSO4 + NaCl VI. Mối quan hệ giữa các hợp chất vô cơ CHƯƠNG 2: KIM LOẠI I. Tính chất vật lý - Tính chất chung: Tính dẻo, dẫn điện, dẫn nhiệt và ánh kim - Tính chất riêng: Khối lượng riêng (D) ; nhiệt độ nóng chảy, độ cứng II. Tính chất hóa học - Tác dụng với phi kim Tác dụng với oxi => Oxit kim loại (Trừ một số kl như Ag, Au, Pt) Fe + O2 → Fe2O3 Tác dụng với phi kim khác => Muối Ca + Cl2 → CaCl2 - Tác dụng với axit + KL + Axit (HCl ; H2SO4 loãng) => Muối + H2 Mg + H2SO4 → MgSO4 + H2 + KL + Axit (HNO3, H2SO4 đ) => Muối + Sản phẩm khử + H2O Cu + H2SO4 đ → CuSO4 + SO2 + H2O Cu + 2AgNO3 → Cu(NO3)2 + 2Ag III. Dãy hoạt động hóa học của kim loại K Na Ba Ca Mg Ak Zn Fe (H) Cu Hg Ag Pt Au Ý nghĩa dãy hoạt động hóa học của kim loại: + Đi từ trái sang phải, mức độ hóa học của kim loại giảm dần + Kim loại đứng trước Mg, phản ứng với nước ở điều kiện thường tạo thành dung dịch kiềm giải phóng khí hidro + Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4, ...) giải phóng khí hidro + Kim loại đứng trước (trừ Na, K, Ca, Ba, ...) đẩy được kim loại đứng sau ra khỏi dung dịch muối IV. SO SÁNH TÍNH CHẤT CỦA NHÔM VÀ SẮT
V. Hợp kim 1. Hợp kim Là chất rắn thu được khi làm nguội hỗn hợp nóng chảy của nhiều kim loại khác nhau hoặc của kim loại và phi kim.
VI. SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒN 1. Sự ăn mòn kim loại Sự phá hủy kim loại và hợp kim trong môi trường tự nhiên do tác dụng hóa học gọi là sự ăn mòn kim loại 2. Những yếu tố ảnh hưởng đến sự ăn mòn kim loại - Nhiệt độ: Nhiệt độ cao, ăn mòn nhanh - Các chất trong môi trường: ẩm, nhiều chất OXH thì ăn mòn nhanh 3. Các phương pháp bảo vệ kim loại không bị ăn mòn - Ngăn không cho kim loại tiếp xúc với môi trường xung quanh - Chế tạo các hợp kim có khả năng chống, chịu ăn mòn CHƯƠNG 3: PHI KIM I. TÍNH CHẤT VẬT LÝ CỦA PHI KIM - Ở điều kiện thường, các phi kim tồn tại ở cả 3 trạng thái: rắn, lỏng, khí. - Phần lớn các phi kim không dẫn điện, dẫn nhiệt kém, không có ánh kim - Một số phi kim độc như: Cl2, Br2, I2, ... II. TÍNH CHẤT HÓA HỌC 1. Tác dụng với kim loại => Muối (hoặc oxit) VD: Hg + S → HgS 2. Tác dụng với hidro => Hợp chất khí VD: H2 + Cl2 → 2HCl 3. Mức độ hoạt động của phi kim Mức độ hoạt động hóa học mạnh hay yếu của các phi kim xét dựa vào khả năng tác dụng của phi kim với kim loại và hidro Thứ tự hoạt động giảm dần theo dãy: F > O > Cl > Br > S > P > C > Si III. Clo Tính chất vật lý: Là chất khí màu vàng lục, mùi hắc, tan một phần trong nước. Clo là khí độc Tính chất hóa học: Clo có những tính chất hóa học chung cua phi kim + Clo + kim loại → Muối Cl2 + Fe → FeCl3 + Clo + Hidro => Khí hidro clorua Cl2 + H2 → 2HCl Tính chất khác: Tác dụng với nước: Cl2 + H2O → HCl + HClO Cl2 + NaOH → NaCl + NaClO + H2O Điều chế Trong phòng thí nghiệm: Dùng chất oxi hóa mạnh (MnO2, KMnO4, ...) + HCl đặc VD: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O Trong công nghiệp: Điện phân dung dịch NaCl bão hòa có màng ngăn xốp 2NaCl + 2H2O → 2NaOH + Cl2 + H2 IV. CACBON VÀ HỢP CHẤT CACBON 1. Dạng thù hình của cacbon Có 3 loại thù hình chính: Kim cương, than chì, cacbon vô định hình 2. Tính chất của cacbon + Tính hấp phụ: cacbon vô định hình có khả năng hấp phụ chất khí, chất màu trên bề mặt chúng + Tính chất hóa học: Mang đầy đủ tính chất hóa học của phi kim a, Tác dụng với oxi: C + O2 \(\xrightarrow{{{t}^{0}}}\) CO2 b, Tác dụng với oxi KL => KL + CO2 C + ZnO \(\xrightarrow{{{t}^{0}}}\) Zn + CO2 3. Hợp chất của cacbon Các oxit của cacbon
HocTot.Nam.Name.Vn
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||