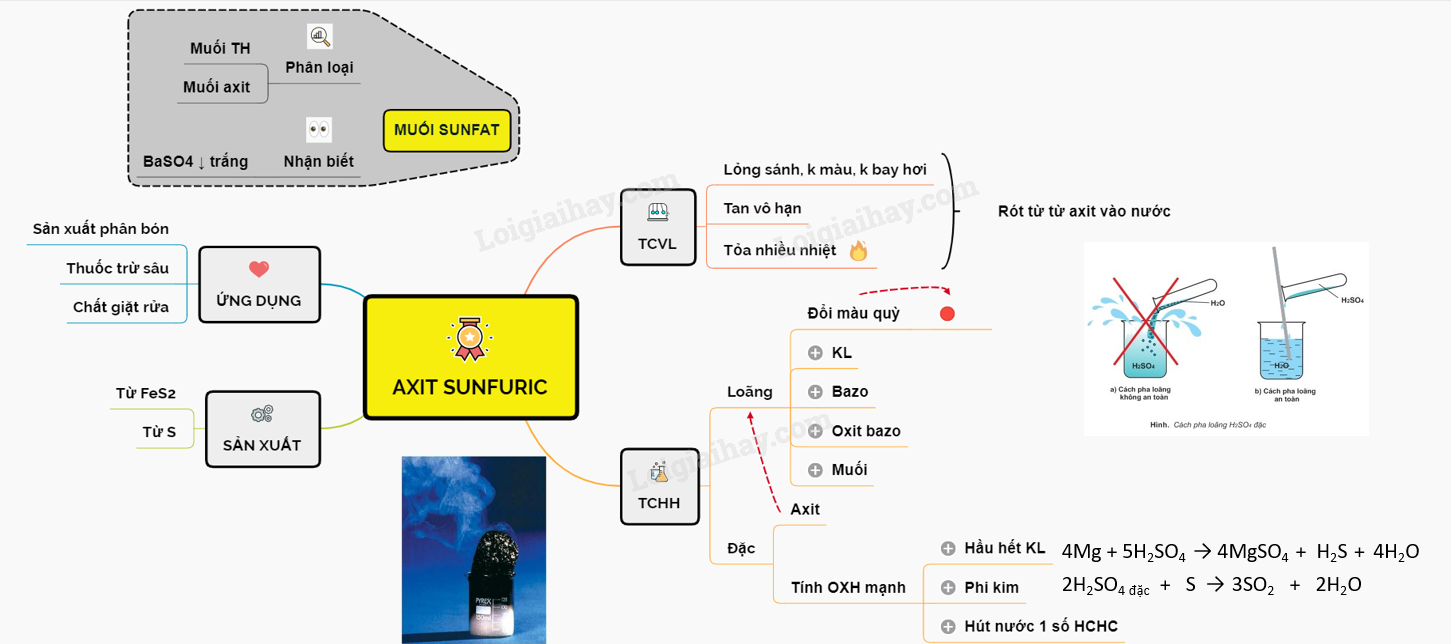
Bài 33: Axit sunfuric - Muối sunfatAxit sunfuric là .... I. AXIT SUNFURIC 1. TÍNH CHẤT VẬT LÍ - Axit sunfuric là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gấp 2 lần nước. - Tan vô hạn trong nước và tỏa rất nhiều nhiệt. * Lưu ý: để pha loãng dung dịch H2SO4 đặc, ta cần rót từ từ axit vào nước, khuấy nhẹ và không làm ngược lại. 2. TÍNH CHẤT HÓA HỌC a. Tính chất của dung dịch H2SO4 loãng - H2SO4 loãng mang những tính chất chung của một axit - Làm đỏ quì tím, tác dụng kim loại (trước H) giải phóng H2, tácdụng bazơ, oxit bazơ và nhiều muối. H2SO4 + Fe → FeSO4 + H2 H2SO4 + 2NaOH → Na2SO4 + 2H2O H2SO4 + CuO → CuSO4 + H2O H2SO4 + BaCl2 → BaSO4¯ + 2HCl H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2 b. Tính chất của dung dịch H2SO4 đặc H2SO4 đặc ngoài mang tính chất của một axit, chúng còn có tính oxi hóa mạnh ● Tác dụng với kim loại : Axit H2SO4 đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại có tính khử mạnh). 2Fe + 6H2SO4 \(\xrightarrow{{{t}^{o}}}\) Fe2(SO4)3 + 3SO2 + 6H2O 3Zn + 4H2SO4 \(\xrightarrow{{{t}^{o}}}\) 3ZnSO4 + S + 4H2O 4Mg + 5H2SO4 \(\xrightarrow{{{t}^{o}}}\) 4MgSO4 + H2S + 4H2O Lưu ý: Al, Fe, Cr không tác dụng với dung dịch H2SO4 đặc nguội. ● Tác dụng với phi kim : Tác dụng với các phi kim dạng rắn (to) tạo hợp chất của phi kim ứng với số oxi hóa cao nhất. 2H2SO4 đặc + S \(\xrightarrow{{{t}^{o}}}\) 3SO2 + 2H2O 5H2SO4 đặc + 2P \(\xrightarrow{{{t}^{o}}}\) 2H3PO4 + 5SO2 + 2H2O ● Hút nước một số hợp chất hữu cơ C12H22O11 + H2SO4 đặc → 12C + 11 H2O Sau đó: 2H2SO4 đặc + C → CO2 + 2SO2 + 2H2O III. ỨNG DỤNG - Axit sunfuric là chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4. - Sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, .... IV. SẢN XUẤT AXIT SUNFURIC ● Từ FeS2 4FeS2 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3 + 8SO2 2SO2 + O2 \(\underrightarrow {{V_2}{O_5},{t^o}}\) 2SO3 nSO3 + H2SO4 → H2SO4.nSO3 H2SO4.nSO3 + H2O → (n +1)H2SO4 ● Từ S S + O2 \(\xrightarrow{{{t}^{o}}}\) SO2 2SO2 + O2 \(\underrightarrow {{V_2}{O_5},{t^o}}\) 2SO3 SO3 + nH2SO4 → H2SO4.nSO3 H2SO4.nSO3 + H2O → (n +1)H2SO4 Video mô phỏng - Sản xuất H2SO4 II. MUỐI SUNFAT, NHẬN BIẾT ION SUNFAT 1. MUỐI SUNFAT Có 2 loại muối sunfat: - Muối trung hòa: Chứa ion SO42-. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan - Muối axit: Chứa ion HSO4- 2. NHẬN BIẾT ION SUNFAT Ta dùng dung dịch muối bari hoặc Ba(OH)2. Sản phẩm tạo thành BaSO4 có kết tủa trắng, không tan trong axit. H2SO4 + BaCl2 → BaSO4 + 2HCl Sơ đồ tư duy: Axit sunfuric - Muối sunfat
HocTot.Nam.Name.Vn
|