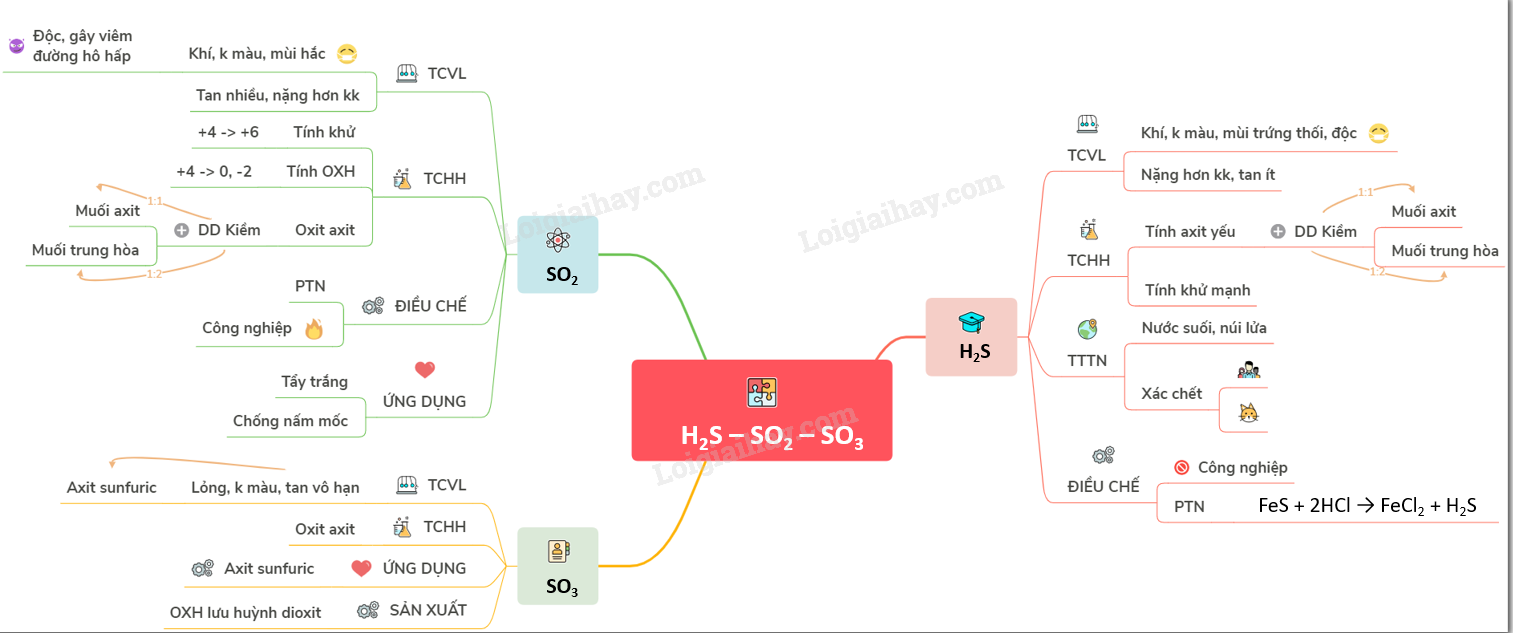
Bài 32: Hidro sunfua - Lưu huỳnh dioxit - Lưu huỳnh trioxitHidro sunfua là .... A. HIĐRO SUNFUA I. TÍNH CHẤT VẬT LÍ - Hidro sunfua là chất khí, không màu, mùi trứng thối và rất độc. - Hơi nặng hơn không khí, tan ít trong nước. II. TÍNH CHẤT HÓA HỌC - Hidro sunfua tan trong nước tạo thành dung dịch axit rất yếu tên là axit sunfuhidric 1. Tính axit yếu - Khi tác dụng dung dịch kiềm có thể tạo muối axit hoặc muối trung hoà H2S + NaOH \(\xrightarrow{1\,\,:\,\,1}\)NaHS +H2O nếu \(\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,\le \,\,1\) H2S + 2NaOH \(\xrightarrow{1\,\,:\,\,2}\) Na2S+2H2O nếu \(\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,\ge \,\,2\) - Nếu \(1\,\,<\,\,\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,<\,\,2\) thì phản ứng tạo ra đồng thời cả hai muối NaHS và Na2S 2. Tính khử mạnh - H2S là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (–2). 2H2S + 3O2(dư) \(\xrightarrow{t{}^{o}}\) 2H2O + 2SO2 2H2S + O2 (thiếu)\(\xrightarrow{t{}^{o}}\)2H2O + 2S H2S + 4Cl2 + 4H2O → 8HCl + H2SO4 III. TRẠNG THÁI TỰ NHIÊN VÀ ĐIỀU CHẾ - Trong tự nhiên, hidro sunfua có trong một số nước suối, khí núi lửa, xác chết người, động vật - Trong công nghiệp, người ta không sản xuất khí hidro sunfua. Trong phòng thí nghiệm, cho muối sunfua tác dụng với dung dịch HCl FeS + 2HCl → FeCl2 + H2S B. LƯU HUỲNH ĐIOXIT I. TÍNH CHẤT VẬT LÍ - Lưu huỳnh dioxit là chất khí không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước. - Khí SO2 là khí độc, có thể gây viêm đường hô hấp. II. TÍNH CHẤT HÓA HỌC Trong phân tử SO2 lưu huỳnh có số oxi hóa trung gian +4, do đó khí SO2 vừa là chất khử, vừa là chất oxi hoá. 1. Tính khử Khi gặp chất oxi hoá mạnh (O2, Cl2, Br2...), khí SO2 thể hiện tính khử : 2SO2 + O2 \(\overset{{{\text{V}}_{2}}{{\text{O}}_{5}}\text{,}\,\,\text{45}{{\text{0}}^{o}}C-{{500}^{o}}C}{leftrightarrows}\) 2SO3 SO2 + Cl2 + 2H2O \(\to \) 2HCl + H2SO4 2. Tính oxi hóa Khi gặp các chất khử mạnh (H2S, Mg, Al...), khí SO2 thể hiện tính oxi hóa : SO2 + 2H2S \(\to \) 2H2O + 3S SO2 + 2Mg \(\xrightarrow{{{t}^{o}}}\) 2MgO + S 3. SO2 là một oxit axit SO2 + NaOH \(\xrightarrow{1\,\,:\,\,1}\) NaHSO3 \((\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\le \,\,1)\) SO2 + 2 NaOH \(\xrightarrow{1\,\,:\,\,2}\) Na2SO3+H2O \((\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\ge \,\,2)\) - Nếu \((1\,\,\le \,\,\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\le \,\,2)\) thì tạo ra cả hai muối trung hòa và muối axit III. ỨNG DỤNG VÀ ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT 1. Ứng dụng - Sản xuất H2SO4 trong công nghiệp, làm chất tẩy trắng giấy, bột giấy, chất chống nấm mốc lương thực, thực phẩm. 2. Điều chế lưu huỳnh đioxit - Trong phòng thí nghiệm: Đun nóng H2SO4 với Na2SO3 H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O - Trong công nghiệp: Đốt S hoặc quặng pirit sắt: FeS2 + O2 \(\xrightarrow{{{t}^{o}}}\) Fe2O3 + SO2 C. LƯU HUỲNH TRIOXIT I. TÍNH CHẤT - Lưu huỳnh trioxit là chất lỏng không màu, tan vô hạn trong nước và axit sunfuric. - SO3 là một oxit axit + Tác dụng với nước: SO3 + H2O → H2SO4 + Tác dụng với dung dịch kiềm: SO3 + 2NaOH → Na2SO4 + H2O + Tác dụng với oxit bazo: SO3 + CaO → CaSO4 - SO3 tan vô hạn trong H2SO4 tạo thành oleum: H2SO4.nSO3. II. ỨNG DỤNG VÀ SẢN XUẤT - Ít có ứng dụng thực tế, nhưng lại là sản phẩm trung gian để sản xuất axit sunfuric - Người ta sản xuất lưu huỳnh tri oxit bằng cách oxi hóa lưu huỳnh dioxit. Sơ đồ tư duy: Hidro sunfua - Lưu huỳnh dioxit - Lưu huỳnh trioxit
HocTot.Nam.Name.Vn
|