Lý thuyết về nhômI. TÍNH CHẤT VẬT LÍ I. TÍNH CHẤT VẬT LÝ - Nhôm là kim loại nhẹ (D = 2,7 g/cm3), màu trắng bạc, có ánh kim, nóng chảy ở 6600C - Nhôm có tính dẫn điện, dẫn nhiệt tốt - Nhôm có tính dẻo nên có thể cán mỏng được II. TÍNH CHẤT HÓA HỌC 1. Nhôm phản ứng với phi kim a) Phản ứng của nhôm với oxi 4Al + 3O2 2Al2O3 Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước. b) Phản ứng với phi kim khác 2Al + 3Cl2 2AlCl3 2Al + 3S Al2S3 2. Tác dụng với nước - Vật bằng nhôm không tác dụng với nước kể cả khi đun nóng vì có lớp màng Al2O3 không cho nước thấm qua - Nếu phá bỏ lớp Al2O3 thì Al tác dụng với nước 2Al + 6H2O → Al(OH)3 + 3H2 3. Nhôm phản ứng với dung dịch axit - Nhôm phản ứng với dung dịch axit HCl và H2SO4 loãng tạo thành muối nhôm và giải phóng hiđro 2Al + 6HCl → 2AlCl3 + 3H2 - Nhôm phản ứng với dung dịch axit H2SO4 đặc, nóng và HNO3 đặc, nóng 8Al + 30HNO3đặc 8Al(NO3)3 + 3N2O + 15H2O 8Al + 15H2SO4 đặc 4Al2(SO4)3 + 3H2S + 12H2O *Chú ý: Nhôm không tác dụng với H2SO4 đặc, nguội và HNO3 đặc, nguội 4. Nhôm phản ứng với dung dịch muối Nhôm phản ứng với dung dịch muối của kim loại kém hoạt động hơn tạo thành muối nhôm và giải phóng kim loại trong muối 2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu 5. Nhôm phản ứng với dung dịch kiềm Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ 6. Tác dụng với một số oxit kim loại ở nhiệt độ cao (phản ứng nhiệt nhôm) Nhôm khử được các oxit kim loại đứng sau Al trong dãy hoạt động hóa học 2Al + Fe2O3 2Fe + Al2O3 2Al + 3CuO 3Cu + Al2O3 III. ỨNG DỤNG Nhôm và hợp kim của nhôm được sử dụng rộng rãi trong đời sống: đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng.... IV. SẢN XUẤT NHÔM - Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3 Phương pháp: Điện phân hỗn hợp nóng chảy của nhôm oxit và criolit, thu được hỗn hợp nhôm và oxi 2Al2O3 4Al + 3O2 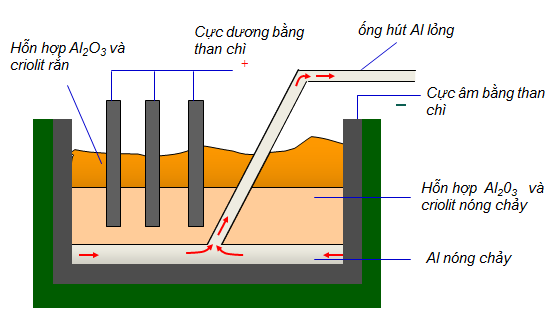 Sơ đồ tư duy: Nhôm
>> Học trực tuyến Lớp 9 & Lộ trình UP10 trên Tuyensinh247.com >> Chi tiết khoá học xem: TẠI ĐÂY Đầy đủ khoá học các bộ sách (Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều), theo lộ trình 3: Nền Tảng, Luyện Thi, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả.
|




















