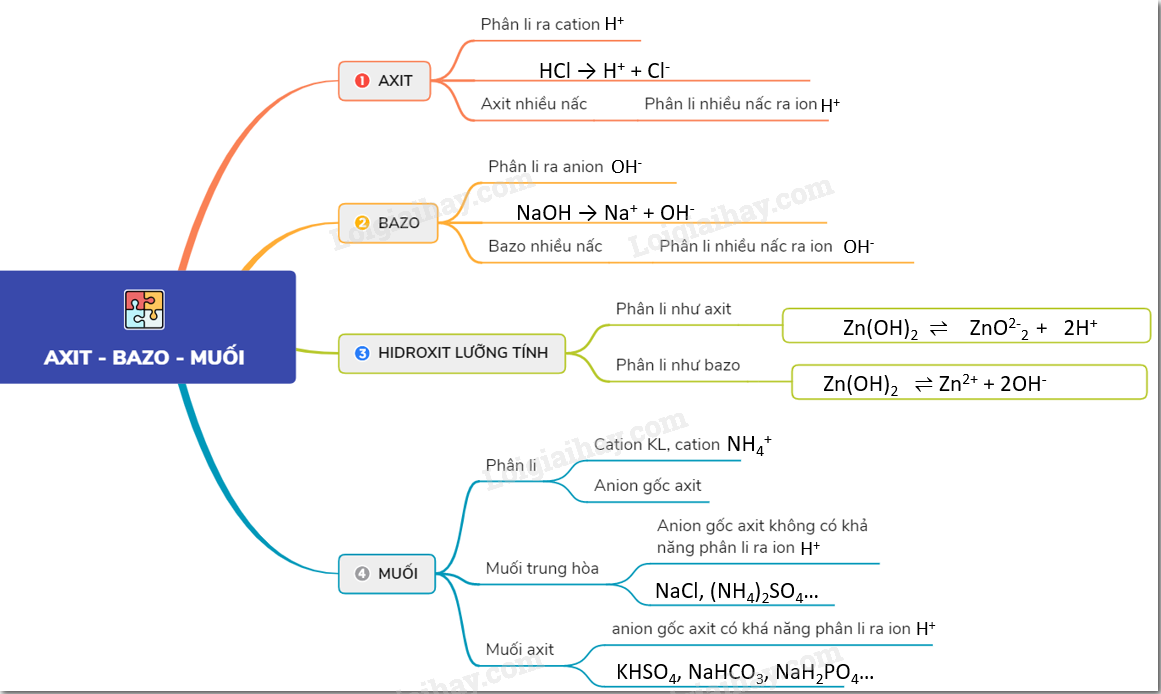
Lý thuyết về axit, bazơ và muối.Axit là chất khi tan trong nước phân li ra cation H+ Lý thuyết về axit, bazơ và muối. 1. Theo thuyết A-rê-ni-ut - Axit là chất khi tan trong nước phân li ra cation H+ Ví dụ: HCl → H+ + Cl- - Bazơ là chất khi tan trong nước phân li ra anion OH- Ví dụ : NaOH → Na+ + OH- - Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. Ví dụ : Zn(OH)2 \(\rightleftharpoons\) Zn2+ +2OH- ; Zn(OH)2 \(\rightleftharpoons\) ZnO2-2 + 2H+ 2. Axit nhiều nấc, Bazo nhiều nấc - Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc. Ví dụ : H2SO4, H3PO4.... H3PO4 \(\rightleftharpoons\) H+ + H2PO4– H2PO4– \(\rightleftharpoons\) H+ + HPO42– HPO42– \(\rightleftharpoons\) H+ + PO43– - Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH- gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,.... Ví dụ: Mg(OH)2 → Mg(OH)+ + OH- Mg(OH)+ → Mg2+ + OH- 3. Muối - Là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ: Na2CO3 → 2Na+ + CO32- - Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Ví dụ: NaCl, (NH4)2SO4… - Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+. Ví dụ: KHSO4, NaHCO3, NaH2PO4… NaHSO4 → Na+ + HSO4- HSO4- → H+ + SO42- - Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axit. Sơ đồ tư duy: Axit, bazơ và muối.
HocTot.Nam.Name.Vn
|