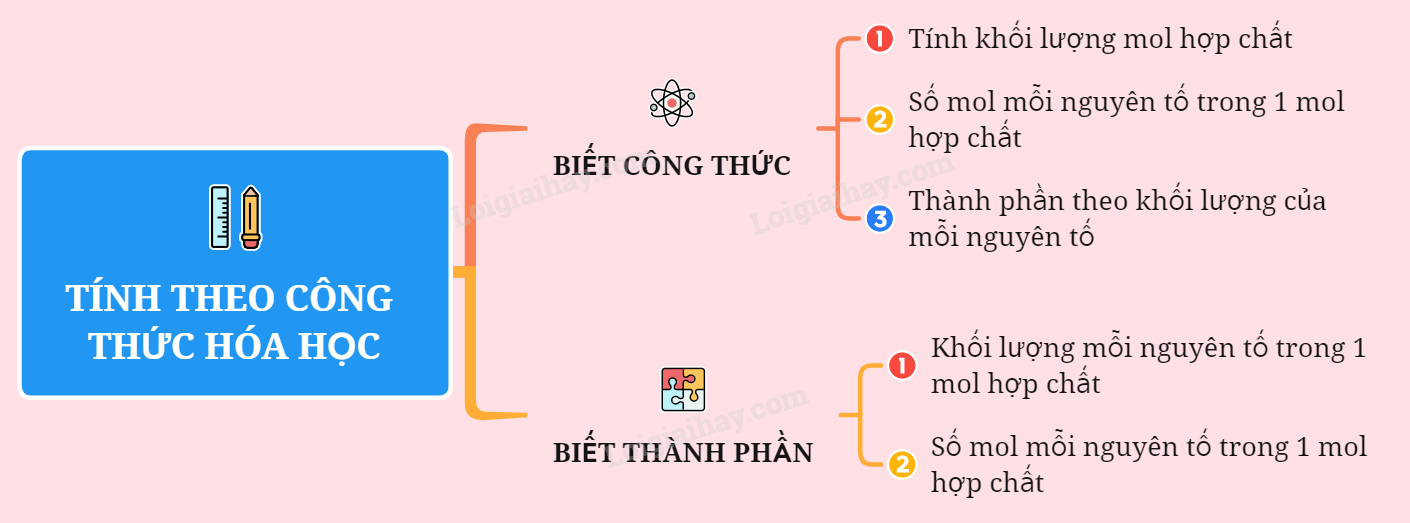
Lý thuyết tính theo công thức hóa họcCác bước tiến hành: I. Xác định thành phần phần trăm các nguyên tố trong hợp chất Bước 1: Tính khối lượng mol của hợp chất. Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất rồi quy về khối lượng. Bước 3: Tìm thành phần phần trăm các nguyên tố trong hợp chất. Ví dụ: Xác định thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất KNO3 Lời giải + ${{M}_{KN{{O}_{3}}}}~$= 39 + 14 + 16.3 = 101 gam/mol + Trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O $+)\text{ }\%K=\frac{39.100\%}{101}=38,6\%$ $+)\text{ }\%N=\frac{14.100\%}{101}=13,8\%$ $+)\text{ }\%O=\frac{16.3.100\%}{101}=47,6\%$ hoặc %O=100% - (38,6% + 13,8%) = 47,6% II. Xác định công thức hoá học của hợp chất khi biết thành phần các nguyên tố Bước 1: Tìm khối lượng mỗi nguyên tố có trong 1 mol hợp chất. Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất. Bước 3: Lập công thức hóa học của hợp chất. Ví dụ: Một hơp chất có thành phần các nguyên tố là 40%Cu; 20% S và 40%O. Hãy xác định công thức hoá học của hợp chất (biết khối lượng mol là 160) Lời giải - Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là: mCu = $\frac{40.160}{100}\text{=}64\text{ }gam$ mS = $\frac{20.160}{100}=32\text{ }gam$ mO = $\frac{40.160}{100}=64\text{ }gam$ - Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là: nCu = $\frac{64}{64}$ = 1 mol nS = $\frac{32}{32}$ = 1 mol nO = $\frac{64}{16}$ = 4 mol Vậy công thức hoá học của hợp chất là: CuSO4 Sơ đồ tư duy: Tính theo công thức hóa học
|