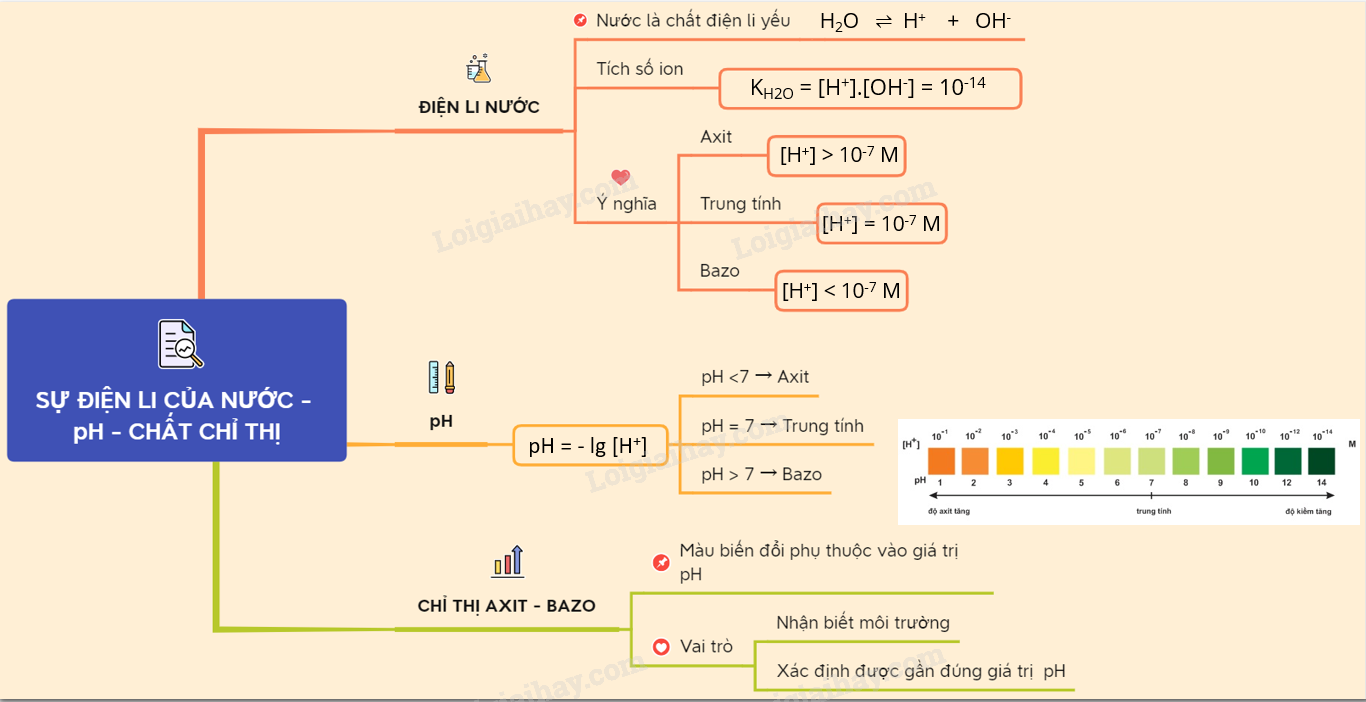
Lý thuyết Sự điện li của nước. pH. Chất chỉ thị Axit - bazơpH càng nhỏ thì dung dịch có độ axit càng lón. pH càng lớn thì dung dịch có độ bazơ càng lớn. I. NƯỚC LÀ CHẤT ĐIỆN LI YẾU 1. Sự điện li của nước Thực nghiệm cho ta nhận thấy, nước là chất điện ly cực yếu: H2O \(\rightleftharpoons \) H+ + OH- (1) Tích số ion của nước : K H2O= [H+][OH-] =10-14 M (đo ở 25oC) 2. Ý nghĩa tích số ion của nước - Môi trường trung tính có : [H+] = [OH–] và pH = 7 ; - Môi trường axit có : [H+] > [OH–] và pH < 7 ; - Môi trường bazơ có : [H+] < [OH–] và pH > 7. - pH càng nhỏ thì dung dịch có độ axit càng lớn. pH càng lớn thì dung dịch có độ bazơ càng lớn. II. KHÁI NIỆM VỀ pH. CHẤT CHỈ THỊ AXIT - BAZO 1. Khái niệm về pH
2. Chất chỉ thị axit – bazơ - Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch. - Dựa vào sự chuyển màu của giấy quỳ và dung dịch phenolphtalein xác định được môi trường của dung dịch, dựa vào màu của giấy chỉ thị vạn năng có thể xác định được gần đúng giá tri pH của dung dịch. Ta có: Nếu [H+] = 1,0.10–a M thì pH = a. => pH = -lg [H+] Ví dụ : [H+] = 10-3M pH = 3 : Môi trường axit. pH + pOH = 14 Sơ đồ tư duy: Sự điện li của nước. pH. Chất chỉ thị Axit - bazơ
HocTot.Nam.Name.Vn
|