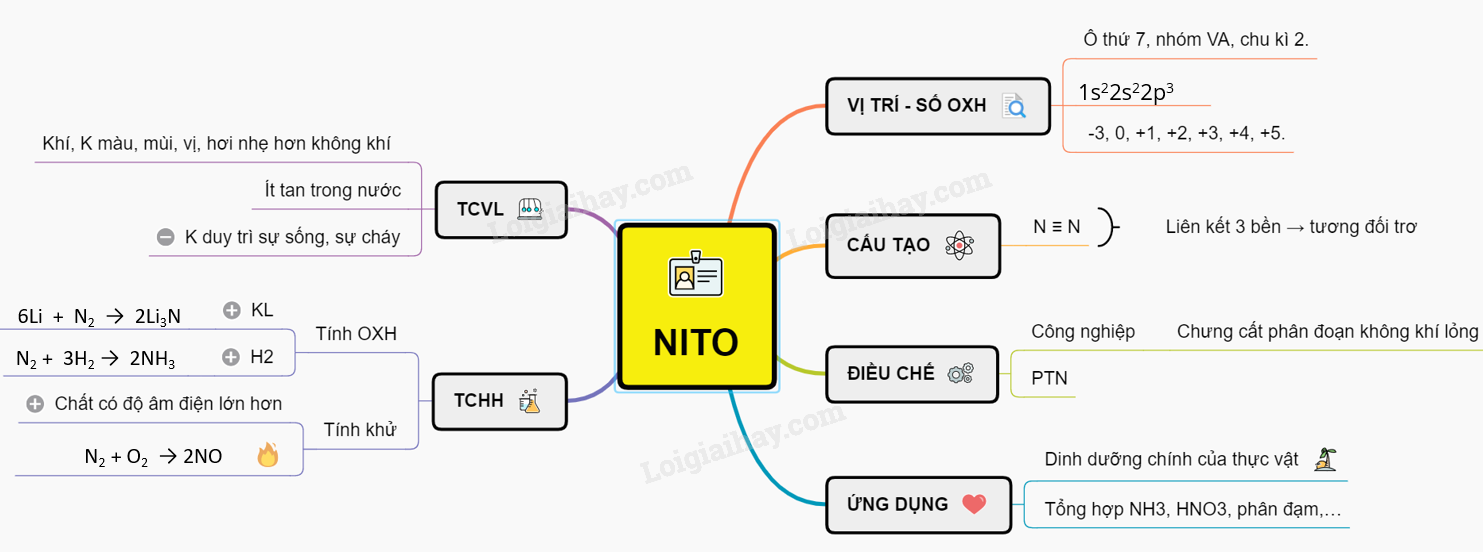
Lý thuyết NitơTrong bảng tuần hoàn nitơ nằm ở ô thứ 7, nhóm VA, chu kì 2. I. VỊ TRÍ VÀ SỐ OXH - Trong bảng tuần hoàn nitơ nằm ở ô thứ 7, nhóm VA, chu kì 2. - Cấu hình electron lớp ngoài cùng là 2s22p3. - N có các số oxi hóa thường gặp: -3, 0, +1, +2, +3, +4, +5. - N có số oxi hóa cao nhất là +5, nhưng hóa trị cao nhất chỉ là 4. II. CẤU TẠO PHÂN TỬ - Nitơ: N ≡ N. - Liên kết ba giữa hai nguyên tử nitơ bền nên ở điều kiện thường nitơ tương đối trơ và khó tham gia phản ứng hóa học. III. TÍNH CHẤT VẬT LÍ Ở điều kiện thường nitơ là khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -1960C; rất ít tan trong nước; không duy trì sự sống, sự cháy IV. TÍNH CHẤT HÓA HỌC - Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5. - N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử 1. Tính oxi hóa a) Tác dụng với kim loại: 6Li + N2 → 2Li3N (Nito tác dụng với Liti ở nhiệt độ thường) - Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại. 3Mg + N2 → Mg3N2 magie nitrua b) Tác dụng với hidro: \({{N}_{2}}\,(k) + 3{{H}_{2}}\,(k) \,\,\underset{{}}{\overset{{{t}^{o}},xt}{\longleftrightarrow}} 2N{{H}_{3}}\,(k)\) 2. Tính khử Nito thể hiện tính khử khi tác dụng với chất có độ âm điện lớn hơn: - Ở nhiệt độ cao (3000oC) Nitơ phản ứng với oxi tạo nitơ monoxit. N2 + O2 ↔ 2NO (không màu) - Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ. 2NO + O2 → 2NO2 V. ĐIỀU CHẾ - Trong công nghiệp: Chưng cất phân đoạn không khí lỏng. - Trong phòng thí nghiệm: NH4NO2 \(\overset{t^{0}}{\rightarrow}\) N2 + 2H2O Hoặc: NH4Cl + NaNO2 \(\overset{t^{0}}{\rightarrow}\) N2 + 2H2O + NaCl VI. ỨNG DỤNG - Nguyên tố nitơ là thành phần dinh dưỡng chính của thực vật. - Trong công nghiệp: dùng để tổng hợp NH3, HNO3, phân đạm,… Chu trình Nitơ trong tự nhiên Sơ đồ tư duy: Nitơ
HocTot.Nam.Name.Vn
|