Lý thuyết điều chế khí oxi - phản ứng phân hủy1. Điều chế oxi Lý thuyết điều chế oxi – Phản ứng phân hủy. 1. Điều chế oxi a. Trong phòng thí nghiệm Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3 2KMnO4 to→to→ K2MnO4 + MnO2 + O2 2KClO3 to→to→ 2KCl + 3O2 2KNO3 to→to→ 2KNO2 + O2 * Cách thu khí oxi: - Vì khí oxi ít tan trong nước => thu khí oxi bằng cách đẩy nước - Khí oxi có dO2/kk≈1,1dO2/kk≈1,1 => oxi nặng hơn không khí => thu khí oxi bằng cách đẩy không khí 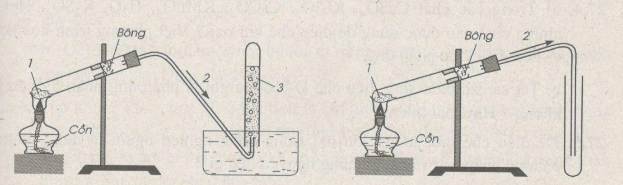 b. Trong công nghiệp - Bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi. Video mô phỏng - Điều chế Oxi bằng phương pháp chưng cất phân đoạn - Sản xuất từ nước: điện phân nước 2H2O điệnphân→ 2H2 ↑ + O2 ↑ 2. Phản ứng phân hủy * Định nghĩa: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới. Ví dụ: 2KMnO4 to→ K2MnO4 + MnO2 + O2 2KClO3 to→ 2KCl + 3O2 2H2O điệnphân→ 2H2 + O2 CaCO3 to→ CaO + CO2 Sơ đồ tư duy: Điều chế khí oxi - phản ứng phân hủy 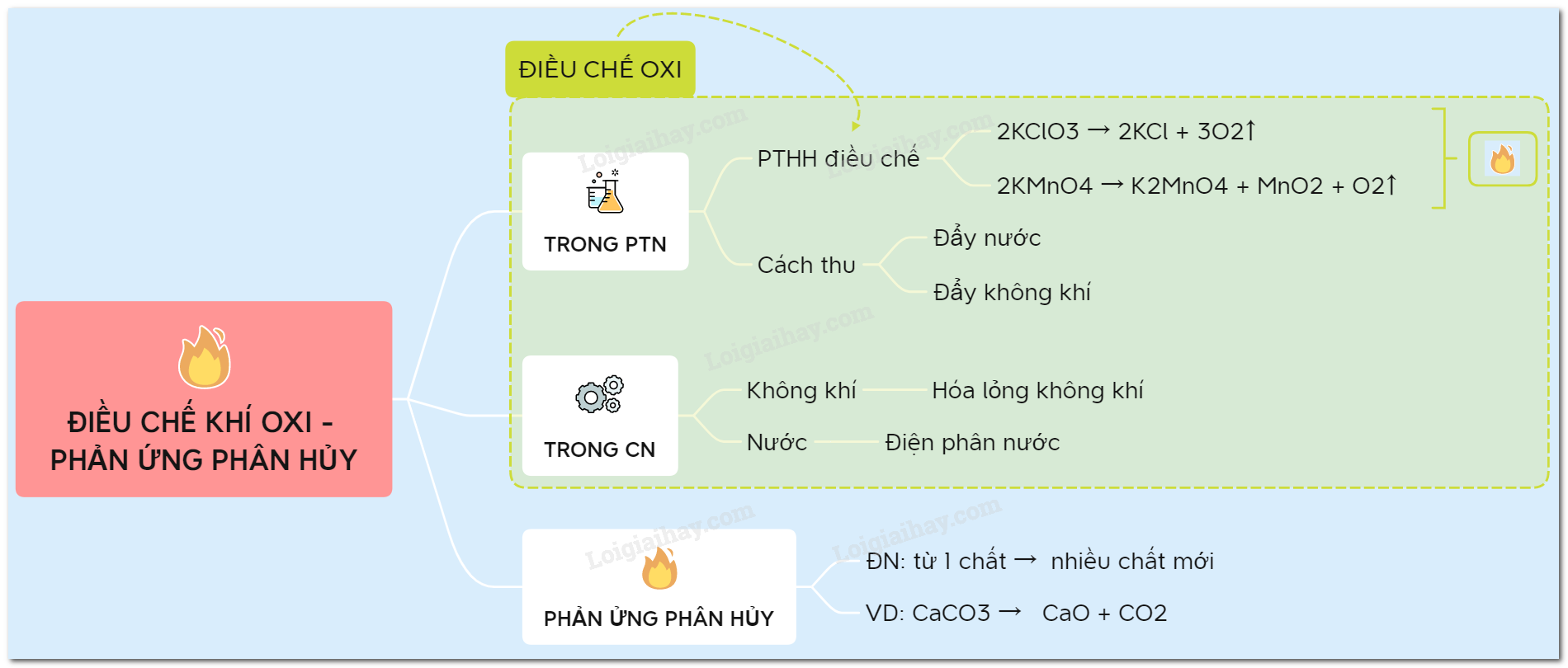
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
|



















