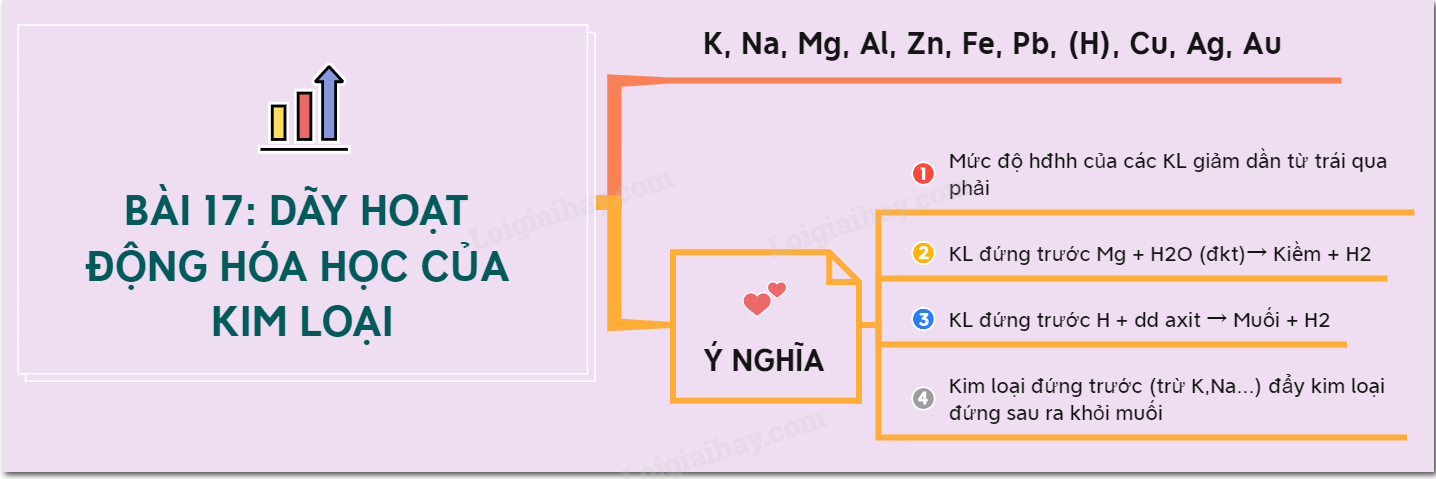
Lý thuyết dãy hoạt động hoá học của kim loạiDÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI Tổng hợp Đề thi vào 10 có đáp án và lời giải Toán - Văn - Anh I. Dãy hoạt động hóa học của kim loại - Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của chúng. - Dãy hoạt động của một số kim loại:  * Mẹo nhớ: Khi (K) bà (Ba) con (Ca) nào (Na) may (Mg) áo (Al) giáp (Zn) sắt (Fe) nhớ (Ni) sang (Sn) phố (Pb) hỏi (H) cửa (Cu) hàng (Hg) á (Ag) phi (Pt) âu (Au) II. Ý nghĩa của dãy hoạt động hóa học của kim loại a) Mức độ hóa học của các kim loại giảm dần từ trái sang phải => K là kim loại hoạt động mạnh nhất và Au là kim loại hoạt động kém nhất. b) Kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường. 2Na + 2H2O → 2NaOH + H2↑ Ba + 2H2O → Ba(OH)2 + H2↑ c) Kim loại đứng trước H tác dụng với dung dịch axit (HCl; H2SO4loãng,….) tạo ra H2 Fe + 2HCl → FeCl2 + H2 ↑ Cu + 2HCl → không phản ứng (vì Cu đứng sau H) d) Kim loại không tan trong nước (từ Mg trở về sau) đẩy được kim loại đứng sau nó ra khỏi dung dịch muối Fe + CuSO4 → FeSO4 + Cu Cu + 2AgNO3 → Cu(NO3)2 + 2Ag Chú ý: Khi cho Na vào dung dịch CuCl2 thì: + Na phản ứng với nước trước: 2Na + 2H2O → 2NaOH + H2↑ + Sau đó xảy ra phản ứng: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl Sơ đồ tư duy: Dãy hoạt động hoá học của kim loại
|