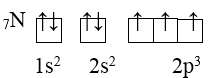
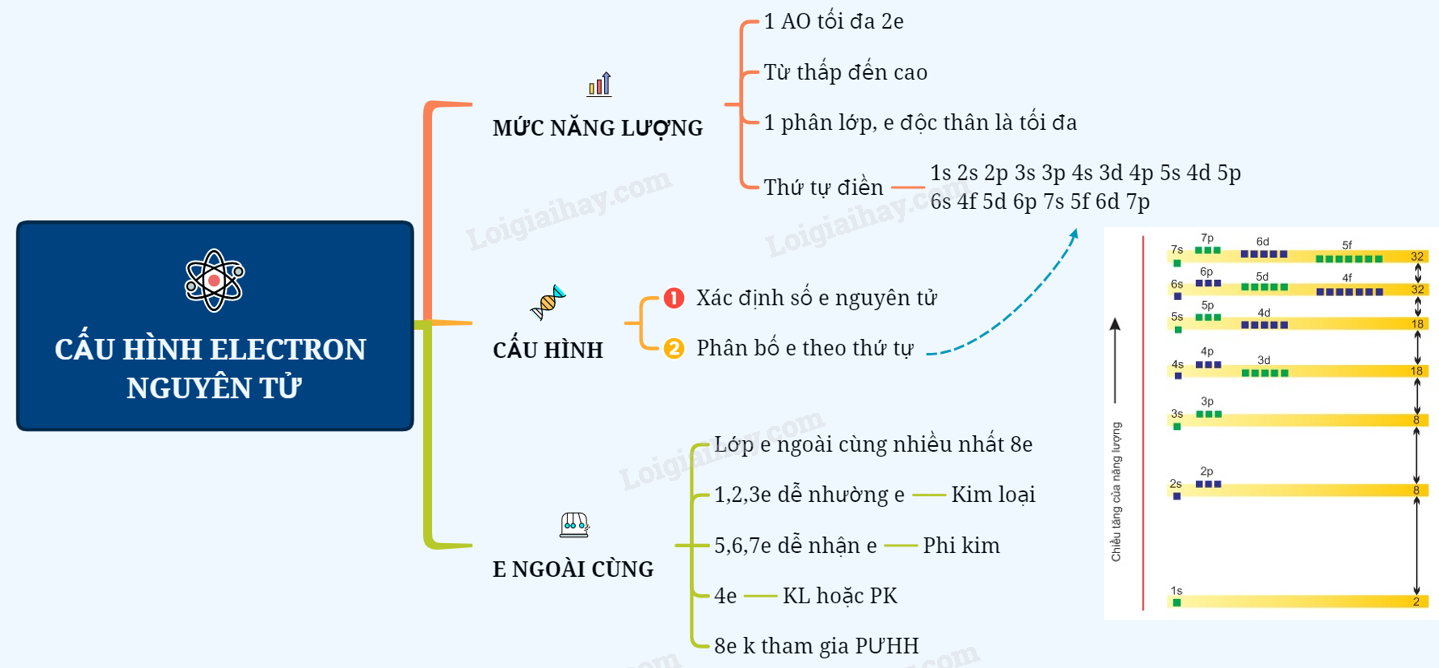
Lý Thuyết cấu hình electron nguyên tửI - CẤU HÌNH ELECTRON NGUYÊN TỬ I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ 1. Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau: 1 obitan có 2e: 2e 1 obitan có 1e: 1e 2. Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao. 3. Quy tắc Hund: Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau. Ví dụ: 4. Trật tự các mức năng lượng nguyên tử: Trong nguyên tử, các electron trên các obitan khác nhau, nhưng cùng 1 phân lớp có mức năng lượng như nhau. Các mức năng lượng nguyên tử tăng dần theo trình tự: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p II. CẤU HÌNH ELECTRON NGUYÊN TỬ - Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau. - Người ta quy ước cách viết cấu hình electron nguyên tử như sau : + Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3...). + Phân lớp được ghi bằng các chữ cái thường (s, p, d, f). + Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6,...) VD: Xác định cấu hình e của N có Z = 7 Cấu hình e của N là: 1s22s22p3. Như vậy, nguyên tử N có tất cả 2 lớp e, (2+3) = 5 e lớp ngoài cùng và có 3 phân lớp. - Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. - Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p. - Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d. - Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f. VD: Nguyên tử N thuộc nhóm nguyên tố p III. ĐẶC ĐIỂM CỦA ELECTRON NGOÀI CÙNG. - Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron. - Các nguyên tử có 8 electron ở lớp electron ngoài cùng (ns2np6) và nguyên tử heli (1 s2) không tham gia vào các phản ứng hoá học (trừ trong một số điều kiện đặc biệt) vì cấu hình electron của các nguyên tử này rất bền. Đó là các nguyên tử của nguyên tố khí hiếm. Trong tự nhiên, phân tử khí hiếm chỉ có một nguyên tử. - Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của các nguyên tố kim loại (trừ H, He và B). - Các nguyên từ có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận electron thường là nguyên tử của nguyên tố phi kim. - Các nguyên từ có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim Sơ đồ tư duy: Cấu hình electron nguyên tử
HocTot.Nam.Name.Vn
|













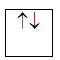 ghép đôi
ghép đôi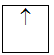 độc thân
độc thân