Lý thuyết các oxit của cacbonI. CACBON OXIT CO I. CACBON OXIT - Công thức phân tử: CO - Phân tử khối: 28 1. Tính chất vật lí CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí, rất độc. 2. Tính chất hóa học a) CO là oxit trung tính - Ở nhiệt độ thường, CO không phản ứng với nước, kiềm và axit. b) CO là chất khử - Ở nhiệt độ cao, CO khử được nhiều oxit kim loại + CO khử CuO theo phương trình: CuO(đen) + CO to→ CO2 + Cu(đỏ) + CO khử oxit sắt trong lò cao: 4CO + Fe3O4 to→ 4CO2 + 3Fe + CO cháy trong oxi hoặc trong không khí với ngọn lửa xanh, tỏa nhiều nhiệt: 2CO + O2 to→ 2CO2 3. Ứng dụng - Làm nhiên liệu, chất khử, nguyên liệu trong công nghiệp hóa học. II. CACBON ĐIOXIT - Công thức phân tử: CO2 - Phân tử khối: 44 1. Tính chất vật lí - CO2 là chất khí không màu, không mùi, nặng hơn không khí, không duy trì sự cháy. CO2 bị nén và làm lạnh thì hóa rắn, tạo thành “nước đá khô” 2. Tính chất hóa học: CO2 có tính chất của một oxit axit. a) Tác dụng với nước CO2 + H2O ⇆ H2CO3 Khí CO2 phản ứng với nước tạo thành dung dịch axit yếu là H2CO3 làm quỳ chuyển đỏ, H2CO3 không bền nên khi đun nóng dung dịch sẽ làm quỳ chuyển lại màu tím. b) Tác dụng với dung dịch bazơ CO2 + 2NaOH → Na2CO3 + H2O CO2 + NaOH → NaHCO3 Tùy thuộc vào tỉ lệ giữa số mol CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay cả 2 muối. c) Tác dụng với oxit bazơ CO2 + CaO → CaCO3 3. Ứng dụng Người ta sử dụng CO2 để chữa cháy, bảo quản thực phẩm. CO2 còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,... Sơ đồ tư duy: Các oxit của cacbon 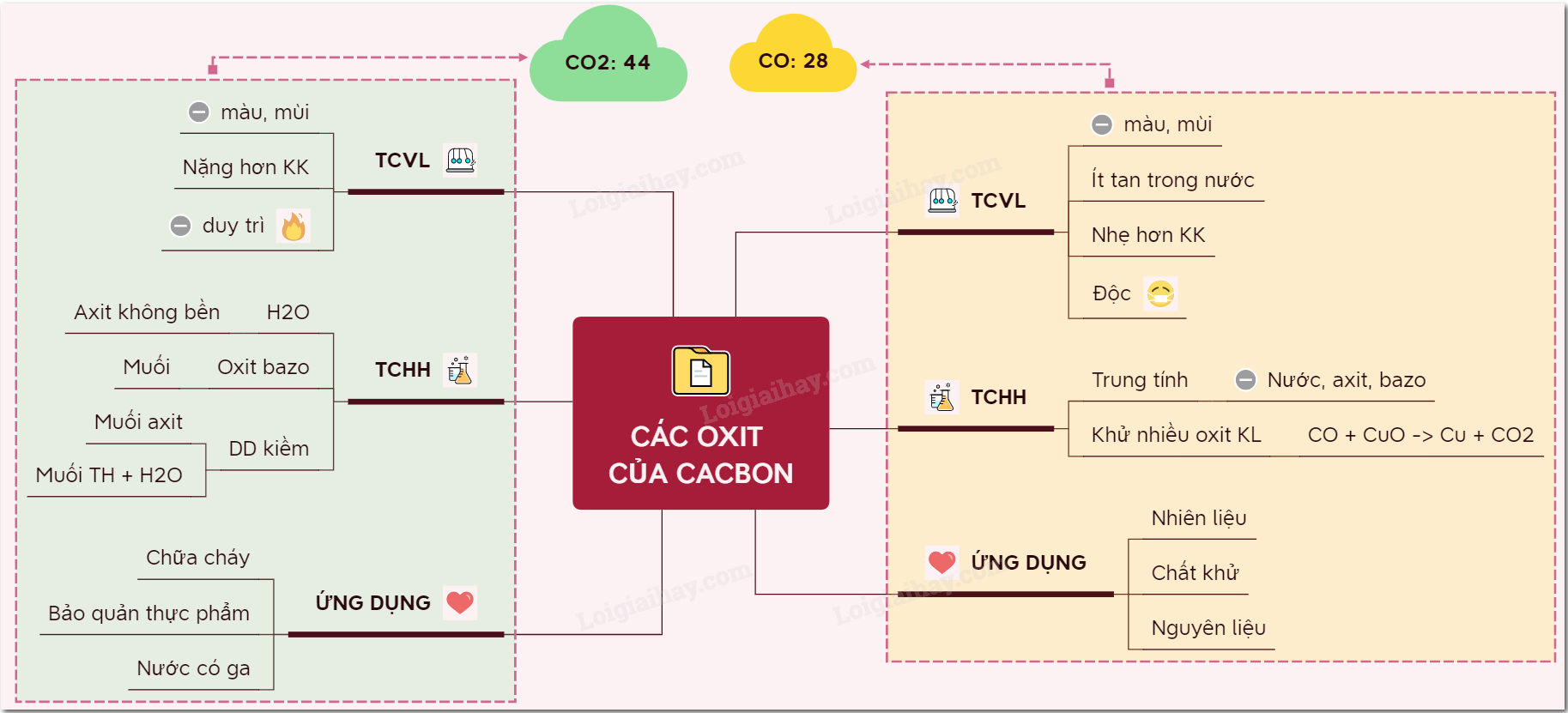
>> Học trực tuyến Lớp 9 & Lộ trình UP10 trên Tuyensinh247.com >> Chi tiết khoá học xem: TẠI ĐÂY Đầy đủ khoá học các bộ sách (Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều), theo lộ trình 3: Nền Tảng, Luyện Thi, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả.
|



















