Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm trang 43, 44, 45, 46, 47, 48 Hóa 10 Chân trời sáng tạoTải vềKim loại kiềm là các kim loại nhóm IA, bao gồm: lithium (Li), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Quan sát Hình 6.1, cho biết bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A biến đổi như thế nào. Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 43 MĐ
Phương pháp giải:
Lời giải chi tiết: - Các kim loại nhóm IA: Khả năng phản ứng với nước của các kim loại không giống nhau, khả năng phản ứng với nước giảm dần - Dựa vào bảng tuần hoàn các nguyên tố hóa học, ta có thể giải thích được xu hướng biến đổi tính chất hóa học cơ bản của nguyên tử các nguyên tố CH tr 43 CH
Phương pháp giải: - Quan sát Hình 6.1 và rút ra nhận xét + Chu kì: hàng ngang + Nhóm: cột dọc Lời giải chi tiết: - Trong mỗi chu kì, đi từ trái sang phải, bán kính nguyên tử của các nguyên tố giảm dần - Trong mỗi nhóm, đi từ trên xuống dưới, bán kính nguyên tử của các nguyên tố tăng dần CH tr 43 CH
Phương pháp giải: Dựa vào điện tích hạt nhân và số electron của nguyên tử để giải thích Lời giải chi tiết: - Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân: + Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần + Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng CH tr 44 LT
Phương pháp giải: - Li, N, O cùng thuộc chu kì 2 - Li, Na, K cùng thuộc nhóm IA Lời giải chi tiết: - Li, N, O cùng thuộc chu kì 2 - Li, Na, K cùng thuộc nhóm IA - Trong 1 chu kì, tính từ trái sang phải, bán kính nguyên tử giảm => Bán kính: Li > N > O (1) - Trong 1 nhóm, đi từ trên xuống dưới, bánh kính nguyên tử tăng => Bán kính: K > Na > Li (2) - Từ (1) và (2) => Sắp xếp các nguyên tố theo chiều tăng dần bán kính nguyên tử: O < N < Li < Na < K CH tr 44 CH
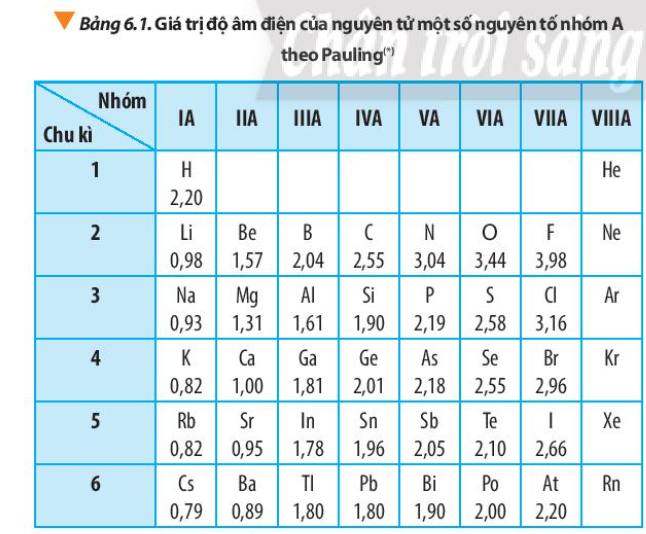
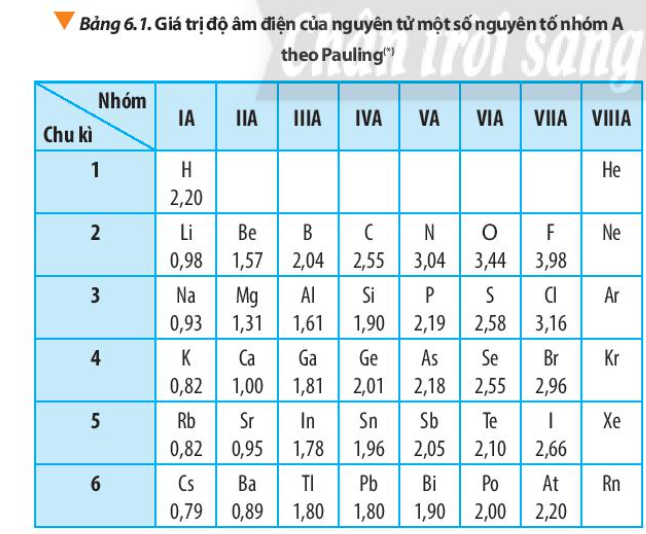
Phương pháp giải: - Quan sát Bảng 6.1 và rút ra nhận xét độ âm điện trong 1 chu kì, trong 1 nhóm - Giải thích: phụ thuộc vào điện tích hạt nhân, bán kính nguyên tử => Lực hút giữa hạt nhân với các electron lớp ngoài cùng Lời giải chi tiết: - Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân: + Trong một chu kì: theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần + Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần CH tr 44 CH
Phương pháp giải: - Độ âm điện đặc trưng cho khả năng hút electron của nguyên tử khi tạo thành liên kết hóa học - Các nguyên tố nhóm VIIIA bền, không tham gia liên kết hóa học Lời giải chi tiết: - Các nguyên tố nhóm VIIIA là các nguyên tố khí hiếm, bền ở điều kiện thường và không tham gia liên kết hóa học => Không hút electron vì cấu hình electron đã đạt cấu hình bền vững => Không có giá trị độ âm điện CH tr 45 LT
Phương pháp giải: - Na, Mg Al cùng thuộc chu kì 2 - Na, K đều cùng nhóm IA Lời giải chi tiết: - Na, Mg Al cùng thuộc chu kì 2 - Na, K đều cùng nhóm IA - Trong 1 chu kì, tính từ trái sang phải, giá trị độ âm điện tăng => Giá trị độ âm điện: Na < Mg < Al (1) - Trong 1 nhóm, đi từ trên xuống dưới, giá trị độ âm điện giảm => Giá trị độ âm điện: K < Na (2) - Từ (1) và (2) => Sắp xếp các nguyên tố theo chiều tăng dần giá trị độ âm điện: K < Na < Mg < Al CH tr 45 CH
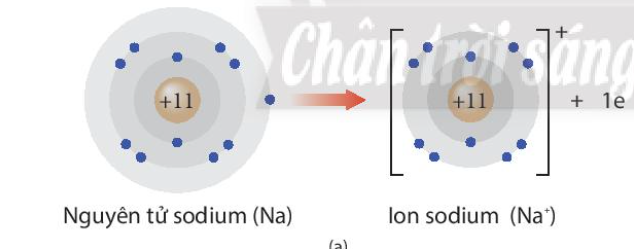
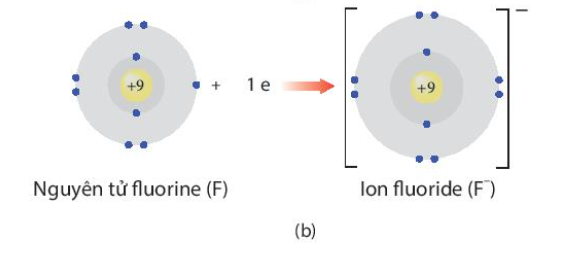
Phương pháp giải: - Na là kim loại, nguyên tử dễ nhường electron - F là phi kim, nguyên tử dễ nhận electron Lời giải chi tiết: - Na là kim loại nhóm IA => Có 1 electron ở lớp ngoài cùng => Khi tham gia liên kết dễ dàng nhường đi 1 electron để đạt cấu hình electron bền vững khí hiếm, tạo thành Na+ - F là phi kim nhóm VIIA => Có 7 electron ở lớp ngoài cùng => Khi tham gia liên kết dễ dàng nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm, tạo thành F- CH tr 45 CH
Phương pháp giải: - Trong một chu kì, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng - Trong một nhóm, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm Lời giải chi tiết: - Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, khả năng nhận electron của các nguyên tử tăng và khả năng nhường electron của các nguyên tử giảm - Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, khả năng nhận electron của các nguyên tử giảm và khả năng nhường electron của các nguyên tử tăng CH tr 46 LT
Phương pháp giải: - Na, Mg thuộc cùng chu kì 2 - Na, K thuộc cùng nhóm IA Lời giải chi tiết: - Na, Mg thuộc cùng chu kì 2 - Na, K thuộc cùng nhóm IA - Trong cùng 1 chu kì, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần => Tính kim loại Na > Mg (1) - Trong cùng 1 nhóm, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần => Tính kim loại K > Na (2) - Từ (1) và (2) => Sắp xếp các nguyên tố theo chiều giảm dần tính kim loại: K > Na > Mg CH tr 46 CH
Phương pháp giải: - Dựa vào khả năng tác dụng với acid, base của oxide và hydroxide Lời giải chi tiết: - Tính acid, base của oxide + Na2O phản ứng với acid + Al2O3 phản ứng với cả acid và base + SO3 phản ứng với acid => Tính base: Na2O > Al3O3 > SO3. Tính acid: Na2O < Al3O3 < SO3 - Tính acid, base của hydroxide + NaOH phản ứng với acid + Al(OH)3 phản ứng với acid và base + H2SO4 phản ứng với base => Tính base: NaOH > Al(OH)3 > H2SO4. Tính acid: NaOH < Al(OH)3 < H2SO4. CH tr 47 CH
Phương pháp giải: Quan sát Bảng 6.2 và rút ra nhận xét Lời giải chi tiết: - Trong 1 chu kì: + Tính kim loại giảm dần, tính phi kim tăng dần. + Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần CH tr 47 LT
Phương pháp giải: - Si, Cl, S, P thuộc cùng chu kì 2 - Trong 1 chu kì, tính phi kim tăng dần, tính acid tăng dần Lời giải chi tiết: - Trong cùng 1 chu kì, tính từ trái trang phải, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần => Sắp xếp theo chiều giảm dần tính acid: HClO4 > H2SO4 > H3PO4 > H2SiO4 CH tr 47 VD
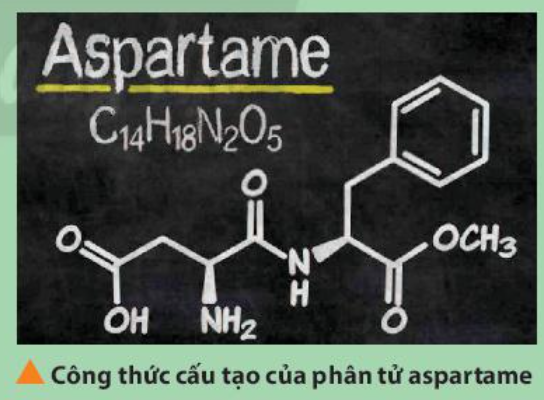
Phương pháp giải: - Các nguyên tố tạo nên aspartame: C, H, N, O - Trong cùng 1 chu kì, tính từ trái sang phải, tính phi kim tăng dần - Trong cùng 1 nhóm, đi từ trên xuống dưới, tính phi kim giảm dần Lời giải chi tiết: - H: ô số 1, nhóm IA, chu kì 1 - C: ô số 6, nhóm IVA, chu kì 2 - N: ô số 7, nhóm VA, chu kì 2 - O: ô số 8, nhóm VIA, chu kì 2 - Trong cùng 1 chu kì, theo chiều tăng dần điện tích hạt nhân, tính phi kim tăng dần => Tính phi kim: C < N < O - H có tính phi kim yếu => Nguyên tố O có tính phi kim mạnh nhất CH tr 47 BT1
Phương pháp giải: - Dựa vào số hiệu nguyên tử, xác định vị trí của các nguyên tố trong bảng tuần hoàn - Trong cùng 1 chu kì, đi từ trái sang phải, bán kính giảm dần - Trong cùng 1 nhóm, đi từ trên xuống dưới, bán kính tăng dần Lời giải chi tiết: - Si: nhóm IVA, chu kì 3 - P: nhóm VA, chu kì 3 - Ge: nhóm IVA, chu kì 4 - As: nhóm VA, chu kì 4 => Bán kính: Si > P (vì cùng chu kì, Si đứng trước P) Bán kính: Si < Ge (vì cùng 1 nhóm, Si đứng trên Ge) Bán kính: Ge > As (vì cùng 1 chu kì, Ge đứng trước As) Bán kính P < As (vì cùng 1 nhóm, P đứng trên As) => P < As, Si < Ge => P có bán kính nhỏ nhất Đáp án B CH tr 48 BT2
Phương pháp giải: - Dựa vào số hiệu nguyên tử, xác định vị trí của các nguyên tố trong bảng tuần hoàn - Trong cùng 1 chu kì, đi từ trái sang phải, tính phi kim tăng dần - Trong cùng 1 nhóm, đi từ trên xuống dưới, tính phi kim giảm dần Lời giải chi tiết: D: số hiệu nguyên tử = 9 => nhóm VIIA, chu kì 2 E: số hiệu nguyên tử = 17 => nhóm VIIA, chu kì 3 M: số hiệu nguyên tử = 35 => nhóm VIIA, chu kì 4 Q: số hiệu nguyên tử = 53 => nhóm VIIA, chu kì 5 - Cả 4 nguyên tố đều thuộc nhóm VIIA. - Trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân, tính phi kim giảm dần => Sắp xếp theo chiều tính phi kim tăng dần: Q < M < E < D Đáp án B CH tr 48 BT3
Phương pháp giải: - Xác định vị trí của nguyên tố X, Y, Z trong bảng tuần hoàn - Trong cùng 1 chu kì, đi từ trái sang phải, tính base của hydrogen giảm dần - Trong cùng 1 nhóm, đi từ trên xuống dưới, tính base của hydrogen tăng dần Lời giải chi tiết: - X: 1s22s22p63s1: nhóm IA, chu kì 3 - Q: 1s22s22p63s2: nhóm IIA, chu kì 3 - Z: 1s22s22p63s23p1: nhóm IIIA, chu kì 3 - Trong cùng 1 chu kì, đi từ trái sang phải, tính base của hydroxide giảm dần => Z(OH)3 < Q(OH)2 < XOH Đáp án C CH tr 48 BT4
Phương pháp giải: Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron => Nguyên tố có độ âm điện lớn nhất Lời giải chi tiết: - Tính chất đặc trưng của phi kim là khả năng hút electron của nguyên tố => Nguyên tố nào có độ âm điện càng lớn thì khả năng hút electron càng mạnh - Nguyên tố F có độ âm điện lớn nhất trong bảng tuần hoàn => F có có tính phi kim mạnh nhất CH tr 48 BT5
Phương pháp giải: Vẽ đồ thị và nhận xét
Lời giải chi tiết:
Quan sát biểu đồ: + Bán kính nguyên tử tăng dần + Độ âm điện giảm dần
|