Bài 5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học trang 35, 36, 37, 38, 39, 40, 41, 42 Hóa 10 Chân trời sáng tạoTải vềCách đây hàng nghìn năm, người ta chỉ biết đến một số nguyên tố như đồng (copper) Quan sát Hình 5.1, hãy mô tả bảng tuần hoàn các nguyên tố hóa học của Mendeleev. Nhận xét về cách sắp xếp các nguyên tố hóa học theo chiều từ trên xuống dưới trong cùng một cột Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 35 MĐ
Lời giải chi tiết: - Nguyên tắc sắp xếp nguyên tố trong bảng tuần hoàn: theo chiều tăng dần số hiệu nguyên tử - Mối liên hệ giữa cấu hình electron và sự sắp xếp nguyên tố trong bảng tuần hoàn: + Sắp xếp theo chiều tăng dần số electron + Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng (chu kì) + Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên trong nhóm CH tr 36 CH
Phương pháp giải: Quan sát Hình 5.1 và rút ra nhận xét Lời giải chi tiết: Trong cùng 1 cột, theo chiều từ trên xuống dưới, các nguyên tố được xếp theo chiều tăng dần của khối lượng nguyên tử CH tr 36 CH
Phương pháp giải: Quan sát Hình 5.1 và rút ra nhận xét Lời giải chi tiết: Nguyên tố Te có nguyên tử khối = 128 nhưng lại đứng trước nguyên tố I có nguyên tử khối = 127 CH tr 36 CH
Phương pháp giải: So sánh nguyên tử khối của các nguyên tố sau đó rút ra nhận xét Lời giải chi tiết: Dấu chấm hỏi trong bảng tuần hoàn có hàm ý: vị trí của chúng trong bảng tuần hoàn không thuận lợi cho việc tiên đoán nên ông chỉ mới ước lượng được khối lượng nguyên tử của chúng CH tr 36 CH
Phương pháp giải: Dựa vào nguyên tử khối của Sc, Ga, Ge trong bảng tuần hoàn (Hình 5.2) để dự đoán vị trí của Sc, Ga, Ge trong Hình 5.1 Lời giải chi tiết: Vì theo Hình 5.1, các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử. Mà nguyên tử khối của Sc < Ga < Ge nên - Sc ở vị trí có nguyên tử khối = 45 - Ga ở vị trí có nguyên tử khối = 68 - Ge ở vị trí có nguyên tử khối = 70 CH tr 38 CH
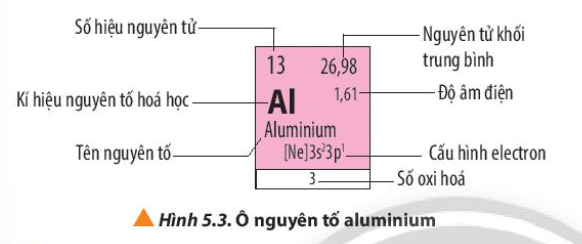
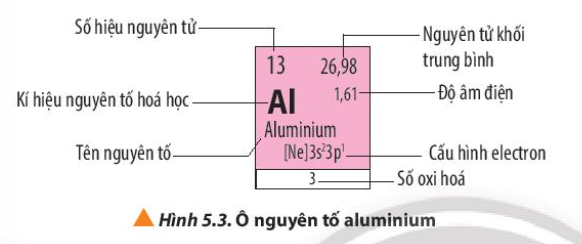
Phương pháp giải: Quan sát Hình 5.3 và rút ra nhận xét Lời giải chi tiết: - Quan sát Hình 5.3, các thông tin có trong ô nguyên tố aluminium là: + Số hiệu nguyên tử: 13 => Số proton = số electron = số đơn vị điện tích hạt nhân = 13 + Nguyên tử khối trung bình = 27 + Độ âm điện = 1,61 + Kí hiệu hóa học: Al + Tên nguyên tố: Aluminium + Cấu hình electron => Al thuộc chu kì 3, nhóm IIIA + Số oxi hóa của Al trong hợp chất CH tr 38 LT
Phương pháp giải: Dựa vào độ âm điện của nguyên tố và số hiệu nguyên tử của nguyên tố aluminium Lời giải chi tiết: - Cấu hình electron của Al: [Ne]3s23p1 => Số electron lớp ngoài cùng = 3 - Số hiệu nguyên tử = 13 => Số proton là 13 CH tr 38 CH
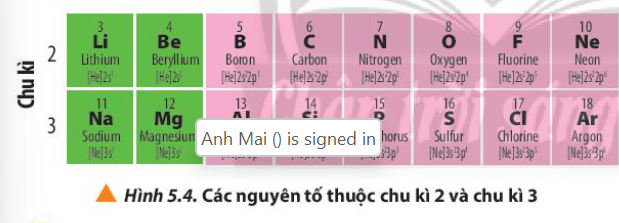
Phương pháp giải: So sánh số lớp eletron của các nguyên tố trong 1 chu kì Lời giải chi tiết: - Các nguyên tố thuộc chu kì 2 đều có 2 lớp electron - Các nguyên tố thuộc chu kì 3 đều có 3 lớp electron CH tr 38 LT
Phương pháp giải: - Viết cấu hình electron của nguyên tố có số hiệu nguyên tử = 20 => Số lớp electron của nguyên tố = số thứ tự chu kì trong bảng tuần hoàn Lời giải chi tiết: - Cấu hình electron của nguyên tố có số hiệu nguyên tử = 20 là: 1s22s22p63s23p64s2 => Số lớp electron của nguyên tố là 4 => Nguyên tố thuộc chu kì 4 trong bảng tuần hoàn CH tr 38 CH
Phương pháp giải: So sánh số electron ở lớp ngoài cùng của các nguyên tố trong cùng 1 nhóm Lời giải chi tiết: Các nguyên tố trong cùng 1 nhóm A sẽ có cùng số electron ở lớp ngoài cùng Ví dụ: - Nhóm IA, các nguyên tố có 1 electron ở lớp ngoài cùng - Nhóm IIA, các nguyên tố có 2 electron ở lớp ngoài cùng - Nhóm VIIA, các nguyên tố có 7 electron ở lớp ngoài cùng CH tr 38 CH
Phương pháp giải: Đếm số cột nhóm VIIIB trong bảng tuần hoàn Lời giải chi tiết: Trong bảng tuần hoàn, mỗi nhóm chỉ có 1 cột riêng nhóm VIIIB có đến 3 cột CH tr 39 CH
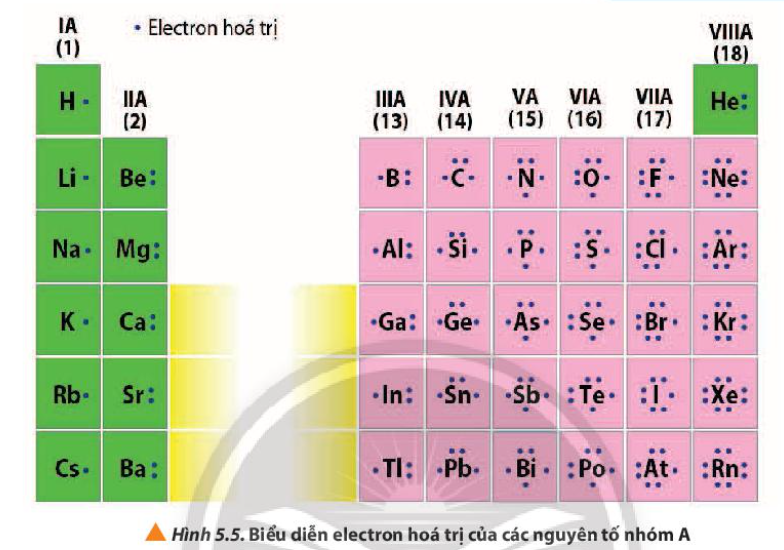
Phương pháp giải: Quan sát Hình 5.5, so sánh số electron hóa trị với số thứ tự nhóm của nguyên tố nhóm A Lời giải chi tiết: - Số electron hóa trị của nguyên tử = số thứ tự nhóm của nguyên tố nhóm A Ví dụ: + Nhóm IA, các nguyên tố đều có 1 electron hóa trị + Nhóm IIIA, các nguyên tố đều có 3 electron hóa trị + Nhóm VIIIA (trừ He) các nguyên tố đều có 8 electron hóa trị CH tr 39 CH
Phương pháp giải: Electron hóa trị thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa
CH tr 39 CH
Phương pháp giải: - Khối nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA: [Khí hiếm]ns1-2 - Khối nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He): [Khí hiếm]ns2np1-6 - Khối nguyên tố d gồm các nguyên tố thuộc nhóm B: [Khí hiếm](n-1)d1-10ns1-2 - Khối nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn: [Khí hiếm](n-2)f0-14(n-1)d0-2ns2 Lời giải chi tiết: - Nguyên tố có Z = 6: 1s22s22p2 => Khối nguyên tố p, có 4 electron ở lớp ngoài cùng => Phi kim - Nguyên tố có Z = 8: 1s22s22p4 => Khối nguyên tố p, có 6 electron ở lớp ngoài cùng => Phi kim - Nguyên tố có Z = 18: 1s22s22p63s23p6 => Khối nguyên tố p, có 8 electron ở lớp ngoài cùng => Khí hiếm - Nguyên tố có Z = 20: 1s22s22p63s23p64s2 => Khối nguyên tố s, có 2 electron ở lớp ngoài cùng => Kim loại CH tr 40 LT
Phương pháp giải: a) Bước 1: Xác định số electron: 7 Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng b) - Khối nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA: [Khí hiếm]ns1-2 - Khối nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He): [Khí hiếm]ns2np1-6 - Khối nguyên tố d gồm các nguyên tố thuộc nhóm B: [Khí hiếm](n-1)d1-10ns1-2 - Khối nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn: [Khí hiếm](n-2)f0-14(n-1)d0-2ns2 c) - Đối với nhóm A: + Có 1, 2, 3 electron ở lớp ngoài cùng => kim loại + Có 5, 6, 7 electron ở lớp ngoài cùng => phi kim + Có 8 electron ở lớp ngoài cùng => khí hiếm - Tất cả nguyên tố nhóm B là kim loại Lời giải chi tiết: a) Nitrogen có số hiệu nguyên tử: Z = 7 => Cấu hình electron của nitrogen: 1s22s22p3 b) Nitrogen có cấu hình: [He] 2s22p3 => Khối nguyên tố p c) Nitrogen có 5 electron ở lớp ngoài cùng => Phi kim CH tr 40 CH
CH tr 40 VD
Phương pháp giải: Bước 1: Viết cấu hình của nguyên tố silicon Bước 2: + Từ số hiệu nguyên tử => số thứ tự ô + Từ cấu hình electron => số thứ tự chu kì và số thứ tự nhóm Lời giải chi tiết: - Nguyên tố silicon có Z = 14: 1s22s22p63s23p2 => Nguyên tố silicon nằm ở ô số 14, có 3 lớp electron nên thuộc chu kì 3 và 4 electron ở lớp ngoài cùng nên thuộc nhóm IVA Bài tập 1
Phương pháp giải: - Viết cấu hình electron => Vị trí dựa vào số hiệu nguyên tử, số electron lớp ngoài cùng và số lớp electron - Xác định khối nguyên tố: + Khối nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA: [Khí hiếm]ns1-2 + Khối nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He): [Khí hiếm]ns2np1-6 + Khối nguyên tố d gồm các nguyên tố thuộc nhóm B: [Khí hiếm](n-1)d1-10ns1-2 + Khối nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn: [Khí hiếm](n-2)f0-14(n-1)d0-2ns2 - Xác định kim loại, phi kim hay khí hiếm: - Đối với nhóm A: + Có 1, 2, 3 electron ở lớp ngoài cùng => kim loại + Có 5, 6, 7 electron ở lớp ngoài cùng => phi kim + Có 8 electron ở lớp ngoài cùng => khí hiếm - Tất cả nguyên tố nhóm B là kim loại Lời giải chi tiết: a) - Ne có số hiệu nguyên tử: Z = 10 => Cấu hình electron: 1s22s22p6 => Ne nằm ở ô số 10, có 2 lớp electron nên thuộc chu kì 2, có 8 electron lớp ngoài cùng nên thuộc nhóm VIIIA - Ne có cấu hình: [He] 2s22p6 => Khối nguyên tố p - Ne có 8 electron ở lớp ngoài cùng => Khí hiếm b) - Mg có số hiệu nguyên tử: Z = 12 => Cấu hình electron: 1s22s22p63s2 => Mg nằm ở ô số 12, có 3 lớp electron nên thuộc chu kì 3, có 2 electron lớp ngoài cùng nên thuộc nhóm IIA - Mg có cấu hình: [Ne] 3s2 => Khối nguyên tử s - Mg có 2 electron ỏ lớp ngoài cùng => Kim loại Bài tập 2
Phương pháp giải: - Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp theo cột Bước 1: Viết cấu hình electron của các nguyên tố Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tố => Nguyên tố thuộc nhóm nào Lời giải chi tiết: a) - Oxygen (Z = 8): 1s22s22p4 => Có 6 electron lớp ngoài cùng, thuộc nhóm VIA - Nitrogen (Z = 7): 1s22s22p3 => Có 5 electron lớp ngoài cùng, thuộc nhóm VA - Carbon (Z = 6): 1s22s22p2 => Có 5 electron lớp ngoài cùng, thuộc nhóm IVA => 3 nguyên tố không thuộc cùng 1 nhóm => Không có tính chất hóa học tương tự nhau b) - Lithium (Z = 3): 1s22s1 => Có 1 electron lớp ngoài cùng, thuộc nhóm IA - Sodium (Z = 11): 1s22s22p63s1 => Có 1 electron lớp ngoài cùng, thuộc nhóm IA - Potassium (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron lớp ngoài cùng, thuộc nhóm IA => 3 nguyên tố cùng thuộc nhóm IA => 3 nguyên tố có tính chất tương tự nhau c) - Helium (Z = 2): 1s2 là nguyên tố đặc biệt, có 2 electron ở lớp ngoài cùng nhưng nằm ở nhóm VIIIA - Neon (Z = 10): 1s22s22p6 => Có 8 electron ở lớp ngoài cùng, thuộc nhóm VIIIA Bài tập 3
Phương pháp giải: Điền các electron vào các phân lớp lần lượt như sau: 1s 2s 2p 3s 3p 4s 3d 4p a) - Nguyên tố chu kì 4 => Có 4 lớp electron - Nguyên tố nhóm IIA => Có 2 electron ở lớp ngoài cùng b) - Nguyên tố chu kì 3 => Có 3 lớp electron - Nguyên tố khí hiếm => Nhóm VIIIA => Có 8 electron ở lớp ngoài cùng Lời giải chi tiết: a) - Nguyên tố chu kì 4 => Có 4 lớp electron - Nguyên tố nhóm IIA => Có 2 elecrton ở lớp ngoài cùng => 1s22s22p63s23p64s2 b) - Nguyên tố chu kì 3 => Có 3 lớp electron - Nguyên tố khí hiếm => Nhóm VIIIA => Có 8 electron ở lớp ngoài cùng => 1s22s22p63s23p6
|