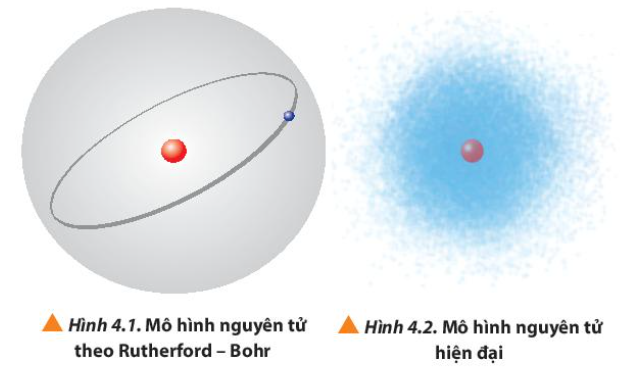
Bài 4. Cấu trúc lớp vỏ electron của nguyên tử trang 26, 27, 28, 29, 30, 31, 32, 33, 34 Hóa 10 Chân trời sáng tạoTải vềTrong nguyên tử, các electron chuyển động như thế nào và chiếm những mức năng lượng nào? Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 26 MĐ
Lời giải chi tiết: - Theo mô hình hiện đại, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron - Các electron được sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao - Trình tự sắp xếp các mức năng lượng: + Các electron trên cùng một phân lớp có năng lượng bằng nhau + Các electron trên cùng một lớp có năng lượng gần bằng nhau CH tr 26 CH
Phương pháp giải: Quan sát Hình 4.1 và 4.2 => So sánh Lời giải chi tiết:
CH tr 27 VD
Phương pháp giải: - Theo Rutherford – Bohr: các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân - Theo mô hình hiện đại: chuyển động rất nhanh xung quanh hạt nhân, không theo một quỹ đạo xác định Lời giải chi tiết: - Các thiên thể quay quanh Mặt Trời theo quỹ đạo xác định - Theo Rutherford – Bohr: các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân => Mô hình nguyên tử của Rutherford – Bohr được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời CH tr 27 CH
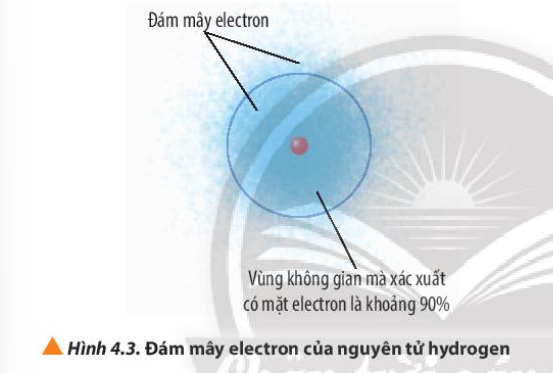
Phương pháp giải: - Đám mây electron: khu vực không gian xung quanh hạt nhân mà có electron - Orbital nguyên tử: khu vực không gian xung quanh hạt nhân mà xác suất có mặt electron khoảng 90% Lời giải chi tiết: - Đám mây electron là khu vực có sự có mặt của electron xung quanh hạt nhân - Orbital nguyên tử là khu vực mà xác suất có mặt electron là 90% xung quanh hạt nhân CH tr 27 CH
Phương pháp giải: Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90% Lời giải chi tiết: Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90% => Xuất phát từ mô hình nguyên tử hiện đại vì electron chuyển động không theo quỹ đạo, mật độ electron không giống nhau CH tr 27 CH
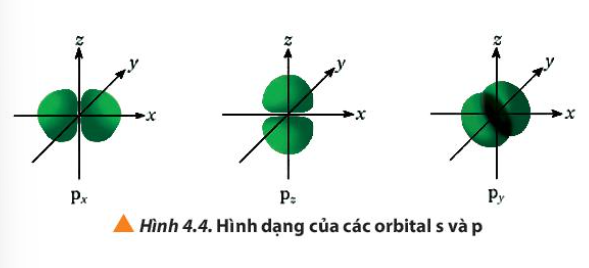
Phương pháp giải: Quan sát Hình 4.4 và so sánh Lời giải chi tiết:
CH tr 28 CH
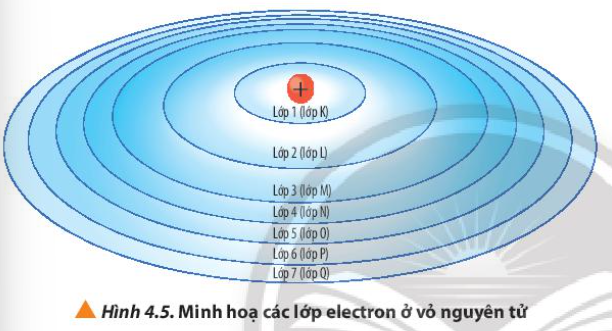
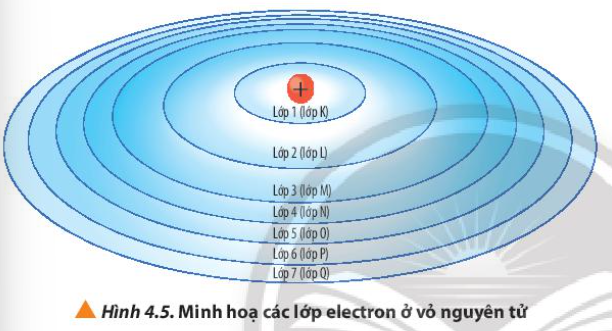
Phương pháp giải: Quan sát Hình 4.5 và gọi tên Lời giải chi tiết: - Lớp 1 – Lớp K - Lớp 2 – Lớp L - Lớp 3 – Lớp M - Lớp 4 – Lớp N - Lớp 5 – Lớp O - Lớp 6 – Lớp P - Lớp 7 – Lớp Q => Cách gọi tên theo bảng chữ cái từ K đến Q lần lượt ứng với các lớp từ 1 đến 7 CH tr 28 CH
Phương pháp giải: Các lớp càng gần hạt nhân thì lực hút càng lớn Lời giải chi tiết: - Lớp K gần hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp K là lớn nhất - Lớp Q nằm xa hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp Q là nhỏ nhất CH tr 28 CH
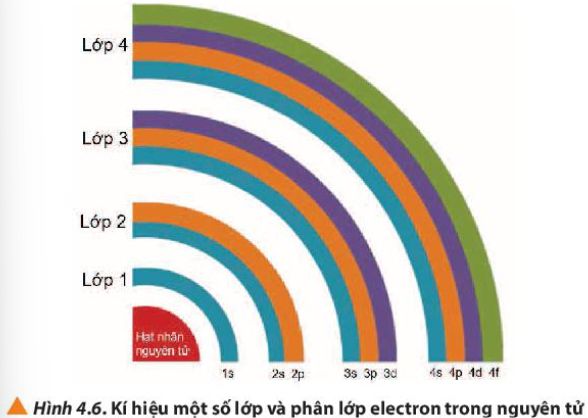
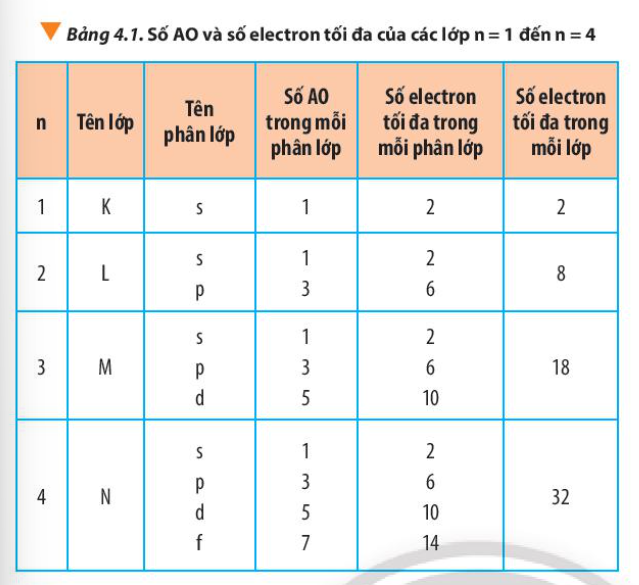
Phương pháp giải: Đếm số phân lớp => So sánh với số lớp Lời giải chi tiết: - Lớp 1 có 1 phân lớp - Lớp 2 có 2 phân lớp - Lớp 3 có 3 phân lớp - Lớp 4 có 4 phân lớp => Từ lớp 1 đến lớp 4, số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó CH tr 29 CH
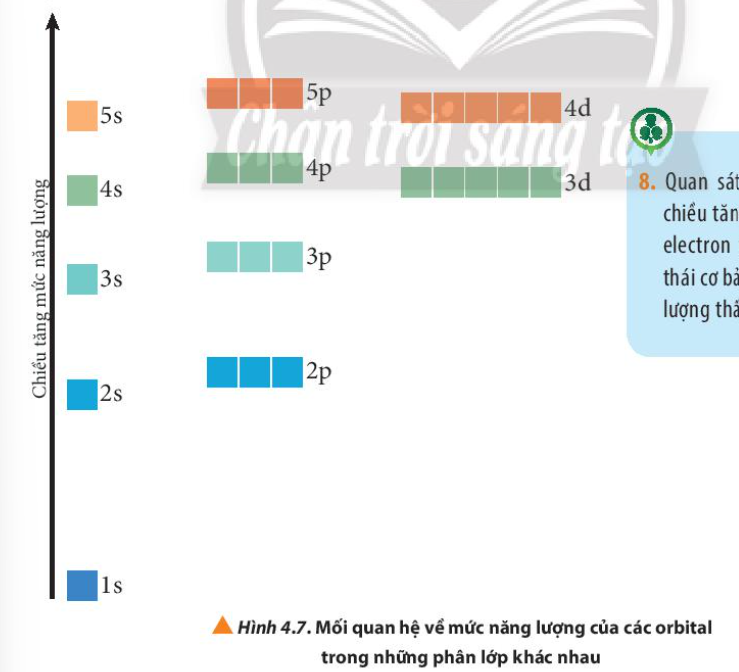
Phương pháp giải: Quan sát Hình 4.7 và rút ra nhận xét Lời giải chi tiết: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p… CH tr 30 CH
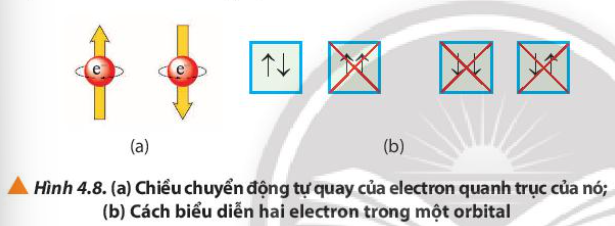
Phương pháp giải: Quan sát Hình 4.8 và rút ra nhận xét Lời giải chi tiết: Trong 1 orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau CH tr 30 CH
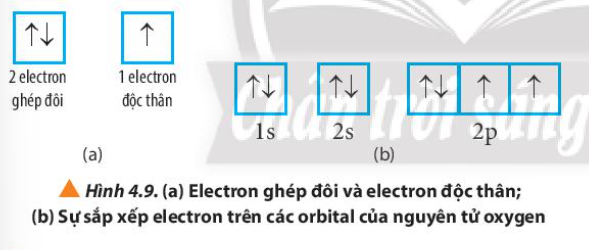
Phương pháp giải: Quan sát Hình 4.9 và rút ra nhận xét Lời giải chi tiết: - Nguyên tử oxygen có: + 6 electron ghép đôi nằm ở orbital 1s, 2s và 1 orbital 2p + 2 electron độc thân nằm ở 2 orbital 2p CH tr 31 CH
Phương pháp giải: Quan sát Bảng 4.1 và rút ra nhận xét Lời giải chi tiết: - Lớp 1 có tối đa 2 electron = 2.12 - Lớp 2 có tối đa 8 electron = 2.22 - Lớp 3 có tối đa 18 electron = 2.32 - Lớp 4 có tối đa 32 electron = 2.42 => Số electron tối đa trong lớp n là 2n2 CH tr 31 LT
Phương pháp giải: Nitrogen có 2 lớp - Lớp 1 có phân lớp 1s - Lớp 2 có phân lớp 2s 2p - Phân lớp s có tối đa 2 electron - Phân lớp p có tối đa 6 electron Lời giải chi tiết: Nitrogen có 2 lớp - Lớp 1 có phân lớp 1s - Lớp 2 có phân lớp 2s 2p - Phân lớp s có tối đa số electron => 1s có 2 electron, 2s có 2 electron - Phân lớp p chỉ chứa 1 nửa số electron tối đa => 2p có 3 electron => Nguyên tử nitrogen có số electron = 2 + 2 + 3 = 7 electron CH tr 31 CH
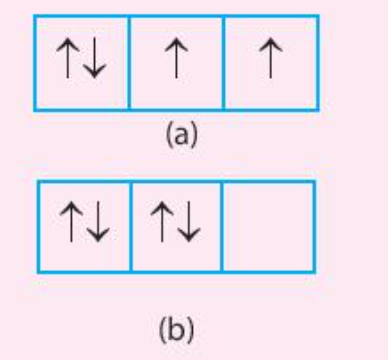
Phương pháp giải: Quan sát Hình 4.10 và rút ra nhận xét Lời giải chi tiết: (a) Phân lớp bão hòa => Không có electron độc thân (b) Phân lớp nửa bão hòa => Số electron độc thân = số orbital của phân lớp đó (c) Phân lớp chưa bão hòa => số electron độc thân nhỏ hơn số orbital trong phân lớp đó CH tr 31 CH
CH tr 31 LT
Phương pháp giải: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa Lời giải chi tiết: Cả 2 trường hợp (a) và (b) đều chưa đạt được phân lớp bão hòa - Trường hợp (a) có 2 electron độc thân => Số electron độc thân đã tối đa - Trường hợp (b) không có electron độc thân => Số electron độc thân chưa tối đa => Trường hợp (a) tuân theo quy tắc Hund, trường hợp (b) không tuân theo quy tắc Hund CH tr 32 CH
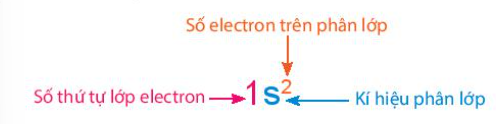
Phương pháp giải: Lời giải chi tiết: Cấu hình electron cho biết: số electron trên phân lớp, số electron lớp ngoài cùng, số lớp electron của nguyên tử CH tr 32 LT
Phương pháp giải: Bước 1: Xác định số electron: 13 Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng Lời giải chi tiết: - Nguyên tử có Z = 13 => Có 13 electron - Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron) - Điền các electron: 1s22s22p63s23p1
=> Nguyên tử aluminium có 1 electron độc thân CH tr 33 CH
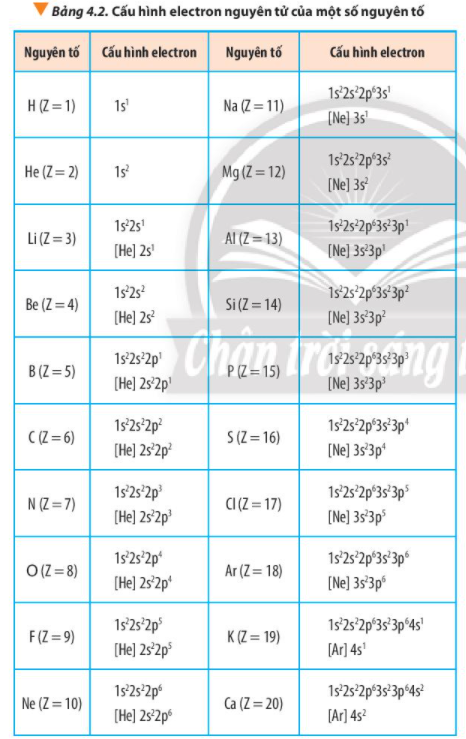
Phương pháp giải: - Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại - Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim Lời giải chi tiết: Theo Bảng 4.2 phosphorus có 5 electron ở lớp ngoài cùng => Phosphorus là nguyên tố phi kim CH tr 33 VD
Phương pháp giải: - Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại - Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim - Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim - Nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm Lời giải chi tiết: Theo Bảng 4.2 lithium có 1 electron ở lớp ngoài cùng => Lithium là nguyên tố kim loại Bài tập 1
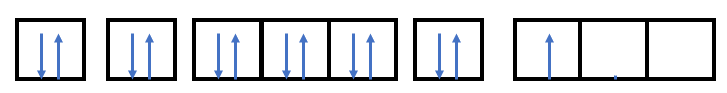
Phương pháp giải: - Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa - AO chứa electron độc thân: ↑ - AO chứa electron ghép đôi: ↑↓ Lời giải chi tiết: (1): đúng vì chứa tối đa electron và biểu diễn electron độc thân bằng mũi tên đi lên (2): sai vì số electron độc thân chưa tối đa (3): sai vì biểu diễn 1 electron độc thân bằng mũi tên đi xuống (4): sai vì biểu diễn electron độc thân bằng mũi tên đi xuống (5): sai vì số electron độc thân chưa tối đa, biểu diễn electron độc thân bằng mũi tên đi xuống (6): sai vì biểu diễn 2 electron độc thân bằng mũi tên đi xuống Bài tập 2
Phương pháp giải: - Lớp thứ nhất: có 1 phân lớp là 1s - Lớp thứ 2: có 2 phân lớp là 2s và 2p Lời giải chi tiết: - Lớp thứ nhất: có 1 phân lớp là 1s - Lớp thứ 2: có 2 phân lớp là 2s và 2p - Phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron => Cấu hình electron của nguyên tố X: 1s22s22p4 => Nguyên tố X có 8 electron => Số hiệu nguyên tử của X: Z = 8 Bài tập 3
Phương pháp giải: Bước 1: Xác định số electron Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng Bước 4: Xác định số electron độc thân Lời giải chi tiết: a) Boron (Z = 5): 1s22s22p1 => Có 1 electron độc thân b) Oxygen (Z = 8): 1s22s22p4 => Có 2 electron độc thân c) Phosphorus (Z = 15): 1s22s22p63s23p3 => Có 3 electron độc thân d) Chlorine (Z = 17): 1s22s22p63s23p5 => Có 1 electron độc thân Bài tập 4
Phương pháp giải: Bước 1: Xác định số electron Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng Bước 4: Xác định số electron ở lớp ngoài cùng + Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại + Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim + Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim + Nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm Lời giải chi tiết: - Nguyên tố Carbon (Z = 6): 1s22s22p2 => Có 4 electron ở lớp ngoài cùng, là nguyên tố phi kim - Nguyên tố Sodium (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng, là nguyên tố kim loại - Nguyên tố Oxygen (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng, là nguyên tố phi kim
|
||||||||||||||||||||||||||||||||||||||||||||||