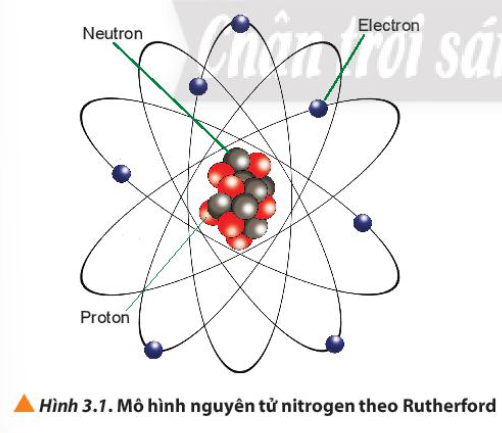
Bài 3. Nguyên tố hóa học trang 20, 21, 22, 23, 24, 25 Hóa 10 Chân trời sáng tạoTải vềKim cương và than chì có vẻ ngoài khác nhau. Quan sát Hình 3.1, cho biết nguyên tử nitrogen có bao nhiêu proton, neutron và electron Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu? Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 20 MĐ
Lời giải chi tiết: - Nguyên tố hóa học là tập hợp tất cả các nguyên tử có cùng điện tích hạt nhân - Một nguyên tử của nguyên tố hóa học có những đặc trưng: số khối A và điện tích hạt nhân CH tr 20 CH
Phương pháp giải: - Quả cầu màu xanh: electron - Quả cầu màu đỏ: proton - Quả cầu màu xám: neutron Lời giải chi tiết: - Có 7 quả cầu màu xanh => 7 electron - Có 7 quả cầu màu đỏ => 7 proton - Có 7 quả cầu màu xám => 7 neutron CH tr 20 CH
Phương pháp giải: - Số đơn vị điện tích hạt nhân (Z) = số proton = số electron - Điện tích hạt nhân = +Z Lời giải chi tiết: - Nguyên tử nitrogen có 7 electron => Số đơn vị điện tích hạt nhân: Z = 7 => Điện tích hạt nhân = +Z = +7 CH tr 20 LT
Phương pháp giải: - Số đơn vị điện tích hạt nhân (Z) = số proton = số electron - Điện tích hạt nhân = +Z Lời giải chi tiết: - Nguyên tử sodium có 11 proton => Số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11 Vậy số đơn vị điện tích hạt nhân và số electron của nguyên tử sodium đều bằng 11 CH tr 21 CH
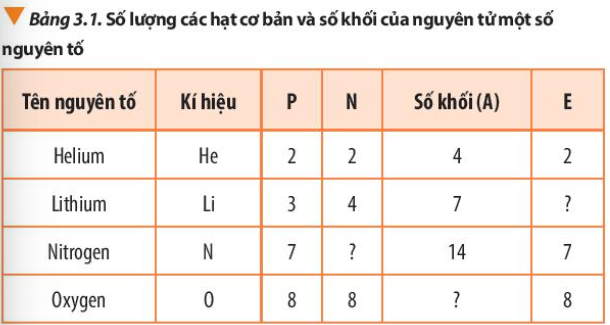
Phương pháp giải: Số khối A = số proton (P) + số neutron (N) Số electron (E) = Số proton (P) Lời giải chi tiết: Số khối A = số proton (P) + số neutron (N) Số electron (E) = Số proton (P)
CH tr 21 CH
Phương pháp giải: Số hiệu nguyên tử được quy ước bằng số đơn vị điện tích hạt nhân Lời giải chi tiết: Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó => Điện tích hạt nhân của nguyên tử carbon = 6 CH tr 22 CH
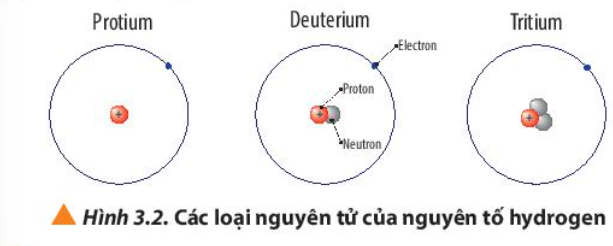
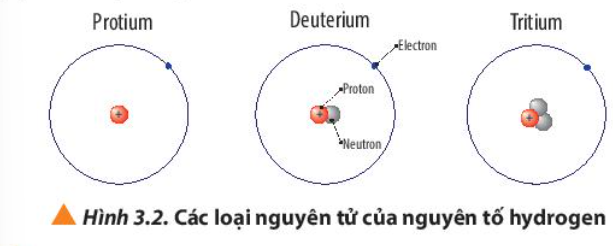
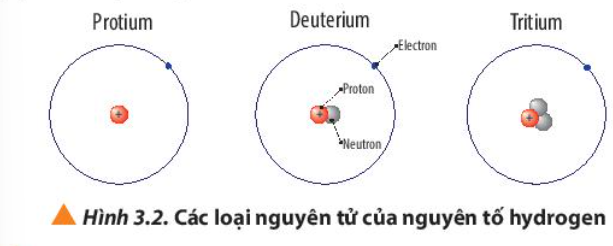
Phương pháp giải: - Số electron (E) = Số proton (P) = Số đơn vị điện tích hạt nhân (Z) - Điện tích hạt nhân = +Z Lời giải chi tiết: - Nguyên tử Protium + 1 electron, 1 proton + Điện tích hạt nhân = +1 - Nguyên tử Deuterium + 1 electron, 1 proton, 1 neutron + Điện tích hạt nhân = +1 - Nguyên tử Tritium + 1 electron, 1 proton, 2 neutron + Điện tích hạt nhân = +1 CH tr 22 CH
Phương pháp giải:  Lời giải chi tiết: - Kí hiệu hóa học cho biết: + Kí hiệu nguyên tố hóa học + Số hiệu nguyên tử => Số proton, số electron, điện tích hạt nhân, số đơn vị điện tích hạt nhân + Số khối => Số neutron = số khối – số proton CH tr 22 LT
Phương pháp giải:  A = Z + N (neutron), Z = P Lời giải chi tiết: a) - Nguyên tử protium: 1 proton, 0 neutron => Z = 1, A = 1 => - Nguyên tử deuterium: 1 proton, 1 neutron => Z = 1, A = 2 => - Nguyên tử tritium: 1 proton, 2 neutron => Z = 1, A = 3 => b) - Nguyên tử oxygen có 8 electron => Số E = Số P = Z = 8 - Nguyên tử oxygen có 8 neutron => Số khối A = P + N = 8 + 8 = 16 => Kí hiệu nguyên tử: CH tr 22 CH
Phương pháp giải: So sánh số proton, neutron và electron Lời giải chi tiết:
CH tr 23 LT
Phương pháp giải:  - Carbon có 6 proton => Số hiệu nguyên tử Z = 6 Lời giải chi tiết: - Carbon có số khối = 12:\(_6^{12}C\) - Carbon có số khối = 13:\(_6^{13}C\) CH tr 23 CH
Phương pháp giải: Nguyên tử khối của một nguyên tử có giá trị bằng số khối Lời giải chi tiết: - Nguyên tử Mg có 12 proton, 12 neutron => Số khối: A = P + N = 12 + 12 - Mà nguyên tử khối của 1 nguyên tử = số khối => Nguyên tử khối của Mg = 24 CH tr 23 CH
Phương pháp giải: 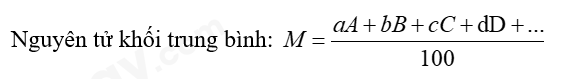 Trong đó: A, B, C, D… là số khối của các đồng vị a, b, c, d… là phần trăm của các đồng vị tương ứng Lời giải chi tiết: Ta có: 63Cu chiếm 69,15%; 65Cu chiếm 30,85% 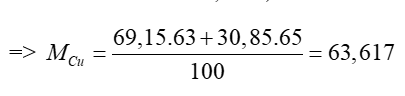 Vậy nguyên tử khối trung bình của Cu là 63,617 CH tr 24 VD
Phương pháp giải: Ta có hệ phương trình: x + y = 100 \(12,0098 = \frac{{x.12 + y.13}}{{100}}\) Lời giải chi tiết: - Nguyên tố carbon có 2 đồng vị là \({}_6^{12}C\) và \({}_6^{13}C\) - Đồng vị \({}_6^{12}C\)chiếm x% - Đồng vị \({}_6^{13}C\)chiếm y% => x + y = 100 (1) - Nguyên tử khối trung bình của carbon trong mẫu phân tích = 12,009 => \(12,0098 = \frac{{x.12 + y.13}}{{100}}\)(2) Từ (1) và (2) => x = 99,02 và y = 0,98 Nhận thấy 0,98 < 1,11 => Vận động viên này sử dụng doping Bài tập 1
Phương pháp giải: - Số P = Số Z - Số khối A = N + P Lời giải chi tiết: - Nguyên tử X có 16 proton => Nguyên tử S - Số proton = số hiệu nguyên tử = 16 => Z = 16 - Số khối = số proton + số neutron = 16 + 16 = 32 => Kí hiệu nguyên tử X: \({}_{16}^{32}S\) Đáp án C Bài tập 2
Phương pháp giải:  Lời giải chi tiết: - Số khối = 28: \({}_{14}^{28}Si\) - Số khối = 29: \({}_{14}^{29}Si\) - Số khối = 30: \({}_{14}^{30}Si\) Bài tập 3
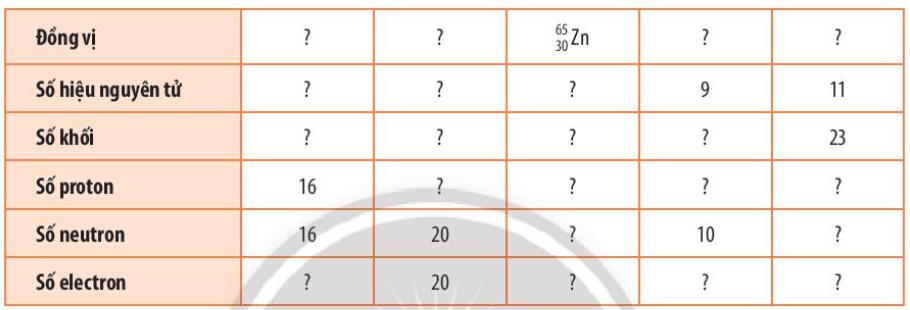
Phương pháp giải:  - Số hiệu nguyên tử = số proton = số electron - Số khối: A = số proton (P) + số neutron (N) Lời giải chi tiết:
Bài tập 4
Phương pháp giải: Bước 1: Gọi phần trăm đồng vị 24Mg là x% => Phần trăm đồng vị 25Mg là: 100 – 11 – x Bước 2: Áp dụng công thức: Nguyên tử khối trung bình: \(M = \frac{{aA + bB + cC + {\text{dD}} + ...}}{{100}}\) Trong đó: A, B, C, D… là số khối của các đồng vị a, b, c, d… là phần trăm của các đồng vị tương ứng Lời giải chi tiết: Gọi phần trăm đồng vị 24Mg là x% => Phần trăm đồng vị 25Mg là: 100 – 11 – x = (89 – x) % Nguyên tử khối trung bình của Mg = 24,32 Áp dụng công thức: \(M = \frac{{aA + bB + cC + {\text{dD}} + ...}}{{100}}\) => \(24,32 = \frac{{x.24 + (89 - x).25 + 11.26}}{{100}}\) => x = 79% => Phần trăm đồng vị 24Mg là 79% => Phần trăm đồng vị 25Mg là: 10%
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||