Đề thi thử THPT QG trường THPT chuyên KHTN lần 1Đề bài
Câu 1 :
Ở điều kiện thường, kim loại nào sau đây phản ứng với bột lưu huỳnh?
Câu 2 :
Dung dịch chứa Ala – Gly- Ala không phản ứng được với dung dịch nào sau đây?
Câu 3 :
Kim loại nào sau đây là kim loại kiềm thổ?
Câu 4 :
Poli(vinyl cloria) (PVC) là chất cách điện tốt, được dùng làm vật liệu cách điện, ống dẫn nước…Monome được dùng để điều chế PVC là
Câu 5 :
Trong công nghiệp đường, chất khí X được dùng để tẩy màu cho dung dịch nước đường trong dây truyền sản xuất saccarozơ. X là
Câu 6 :
Etyl isovalerat là este có mùi thơm của táo. Công thức cấu tạo thu gọn của etyl isovalerat là
Câu 7 :
Nhỏ dung dịch NaOH loãng vào bình đựng dung dịch chất X, thu được kết tủa màu xanh nhạt, khi thêm tiếp dung dịch NaOH vào bình, thấy kết tủa tan dần tạo thành dung dịch màu lục nhạt. X là
Câu 8 :
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
Câu 9 :
Kim loại nhôm không tan được trong dung dịch nào sau đây?
Câu 10 :
Chất nào sau đây thuộc loại đisaccarit?
Câu 11 :
Oxit nào sau đây phản ứng được với nước ở điều kiện thường?
Câu 12 :
Cho các chất sau: đimetylamin, axit glutamic, phenyl amoni clorua, natri axetat. Số chất phản ứng được với dung dịch HCl là
Câu 13 :
Kim loại nào sau đây có thể điều chế được bằng phương pháp nhiệt luyện ?
Câu 14 :
Trong các chất sau, chất nào là chất rắn, không màu, dễ tan trong nước, kết tinh ở điều kiện thường?
Câu 15 :
X và Y là hai kim loại phản ứng được với dung dịch HCl nhưng không tác dụng được với dung dịch Fe(NO3)2. X,Y là
Câu 16 :
Trong các chất sau đây, chất nào có trạng thái khác với các chất còn lại ở điều kiện thường?
Câu 17 :
Thạch cao nung được dùng để bó bột, đúc tượng do có hiện tượng giãn nở thể tích khi động cứng. Thành phần chính của thạch cao nung chứa.
Câu 18 :
Chất hữu cơ X mạch hở, có công thức phân tử C4H6O2. Khi đun X với dung dịch NaOH thu được muối Y, biết MX < MY. Số công thức cấu tạo của X là
Câu 19 :
Cho 16,8 gam Fe vào 200 ml dung dịch CuSO4 0,75M. Sau một thời gian, lấy thanh sắt ra cân nặng 17,6 gam. Khối lượng đồng bám trên thanh sắt là
Câu 20 :
Lên men m gam glucozơ (hiệu suất 75%), thành ancol etylic và khí CO2. Dẫn toàn bộ lượng CO2 này vào bình đựng nước vôi trong thấy tách ra 40 gam kết tủa và dung dịch X. Thêm từ từ dung dịch NaOH vào dung dịch X đến khi lượng kết tủa tối đa thì dừng lại và sử dụng hết 0,04 mol dung dịch NaOH. Giá trị của m là
Câu 21 :
X là dung dịch HCl nồng độ x (M). Y là dung dịch Na2CO3 nồng độ y(M). Nhỏ từ từ 100 ml dung dịch X vào 100 ml dung dịch Y, thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml dung dịch Y vào 100 ml dung dịch X, thu được V2 lít CO2(đktc), biết tỉ lệ V1: V2 = 3 : 5. Tỉ lệ x : y là
Câu 22 :
Hai chất P, Q có công thức phân tử lần lượt là C3H12N2O3 và C2H7NO3. Khi cho P,Q phản ứng với dung dịch HCl cùng tạo ra khí Z; còn với dung dich NaOH cùng cho khí Y. Nhận xét nào sau đây đúng
Câu 23 :
Cho một lượng hộp kim Ba – Na vào 200 ml dung dịch X gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
Câu 24 :
Đốt cháy hoàn toàn V lít hỗn hợp X gồm H2, CH4, C2H6, C3H8, C4H10 thu được 7,84 lít khí CO2 và 9,9 gam nước, các khí đều đo ở đktc. Giá trị của V là
Câu 25 :
Thực hiện các thí nghiệm sau ở nhiệt độ thường (1) Cho bột Al vào dung dịch NaOH. (2) Cho bột Fe vào dung dịch AgNO3. (3) Cho CaO vào dung dịch CH3COOH. (4) Cho dung dịch Na2CO3 vào dung dịch AlCl3. Số thí nghiệm có phản ứng xảy ra là:
Câu 26 :
Cho 10 ml dung dịch cồn 460 vào bình đựng Na dư, sau khi phản ứng xong thu được V lít khí H2 (đktc), biết khối lượng riêng của ancol etylic và nước lần lượt là 0,8 g/ml và 1,0 g/ml. Giá trị của V là
Câu 27 :
Cho các chất rắn sau: Cr2O3, Fe(NO3)2, Al(OH)3, Mg. Số chất tan được trong dung dịch HCl loãng nguội (dư) là
Câu 28 :
X là axit đơn chức, mạch hở; Y là ancol đơn chức, mạch hở. Đung hỗn hợp X, Y với H2SO4 đặc thu được este Z. Biết trong Z có chứa 54,54% khối lượng cacbon. Số cặp chất phù hợp với X, Y là
Câu 29 :
Cho V lít đktc hỗn hợp khí gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
Câu 30 :
Hợp chất hữu cơ A có công thức phân tử C9H8O4 thỏa mãn các phương trình hóa học sau: (1) A + 3NaOH \(\xrightarrow{{{t^0}}}\) 2X + Y + H2O (2) 2X + H2SO4 \(\xrightarrow{{{t^0}}}\) Na2SO4 + 2Z (3) Z + 2AgNO3 + 4NH3 + H2O \(\xrightarrow{{}}\)T + 2Ag + 2NH4NO3 Nhận xét nào sau đây đúng
Câu 31 :
Đốt cháy hoàn toàn m gam một triglixerit X cần dùng 1,61 mol O2, thu được 1,14 mol CO2 và 1,06 mol H2O. Cho 26,58 gam X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là
Câu 32 :
Mô hình thí nghiệm dùng để điều chế chất khí Z:
Phương trình hóa học nào sau đây phù hợp với mô hình trên?
Câu 33 :
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
Dung dịch X, Y, Z, T lần lượt là
Câu 34 :
Cho m gam hỗn hợp Al và BaO vào nước thu được dung dịch X và V lít khí H2 (đktc). Khi nhỏ từ từ dung dịch HCl vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau: 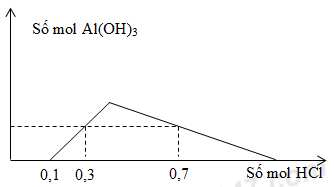 Giá trị của m là
Câu 35 :
Đốt cháy m gam anđehit đơn chức mạch hở X (phân tử chứa không quá 4 nguyên tử cacbon), thu được 6,72 lít CO2 (đktc) và 1,8 gam nước. Mặt khác, khi cho 1,7 gam X phản ứng tối đa với a mol AgNO3 trong NH3. Giá trị của a là
Câu 36 :
Có các nhận xét sau: (1) Nhúng thanh Fe vào dung dịch FeCl3 xảy ra ăn mòn điện hóa. (2) Sục khí H2S vào dung dịch CuSO4 thấy xuất hiện kết tủa màu xanh nhạt. (3) Nhỏ dung dịch Na2CO3 vào dung dịch FeCl3 thấy có kết tủa màu đỏ nâu và thoát khí. (4) Nhúng thanh nhôm vào dung dịch NaOH loãng nguội, thấy thanh nhôm tan dần. (5) Đốt cháy dây sắt trong khí clo thấy hình thành muối sắt (II) clorua bám trên thanh sắt. Số nhận xét đúng là
Câu 37 :
Hỗn hợp X gồm metyl acrylat, vinyl axetat, buta-1,3-đien và vinyl axetilen. Để đốt cháy hoàn toàn 0,5 mol hỗn hợp X cần dùng 54,88 lít O2 (đktc) thu được khí CO2 và 23,4 gam H2O. Phần trăm khối lượng của vinyl axetilen có trong X là
Câu 38 :
Điện phân 200 ml dung dịch hỗn hợp MgCl2 1M và NaCl 1M, với I = 2,68A, trong thời gian 3 giờ với điện cực trơ, màng ngăn xốp. Sau khi kết thúc điện phân thấy khối lượng dung dịch giảm m gam so với dung dịch ban đầu. Giá trị của m là
Câu 39 :
Hỗn hợp X gồm alanin và đipeptit (Gly-Val). Cho m gam X vào 100 ml dung dịch hỗn hợp H2SO4 0,25M và HCl 0,25M, thu được dung dịch Y. Cho toàn bộ Y phản ứng vừa đủ với 240 ml gồm NaOH 0,3M và KOH 0,2M đun nóng, thu được dung dịch chứa 10,9155 gam muối trung hòa. Phần trăm khối lượng của alanin trong X là
Câu 40 :
Hòa tan hết 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu dược 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quá trình trên, sản phẩm khử duy nhất của NO3- là NO. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Ở điều kiện thường, kim loại nào sau đây phản ứng với bột lưu huỳnh?
Đáp án : B Lời giải chi tiết :
Hg là kim loại duy nhất phản ứng với S ở nhiệt độ thường Hg + S → HgS
Câu 2 :
Dung dịch chứa Ala – Gly- Ala không phản ứng được với dung dịch nào sau đây?
Đáp án : B Phương pháp giải :
Xem lại tính chất hóa học của peptit Lời giải chi tiết :
Tripeptit có phản ứng thủy phân trong môi trường axit và bazơ => không có phản ứng với Mg(NO3)2
Câu 3 :
Kim loại nào sau đây là kim loại kiềm thổ?
Đáp án : B Phương pháp giải :
Học thuộc vị trí và tên các kim loại kiềm thổ trong sgk hóa 12 – trang 112 Lời giải chi tiết :
Kim loại kiềm thổ là kim loại thuộc nhóm IIA trong bảng HTTH gồm các nguyên tố: Be, Mg, Ca, Sr,Ba, Ra.
Câu 4 :
Poli(vinyl cloria) (PVC) là chất cách điện tốt, được dùng làm vật liệu cách điện, ống dẫn nước…Monome được dùng để điều chế PVC là
Đáp án : C Phương pháp giải :
Học thuộc tên một số polime phổ biến sgk hóa 12 – trang 62 - 63 Lời giải chi tiết :
Mono để trùng hợp nên PVC là: CH2=CHCl
Câu 5 :
Trong công nghiệp đường, chất khí X được dùng để tẩy màu cho dung dịch nước đường trong dây truyền sản xuất saccarozơ. X là
Đáp án : C Phương pháp giải :
Dựa vào sơ đồ điều chế đường sgk hóa 12 – trang 37 Lời giải chi tiết :
Dùng SO2 để tẩy trắng màu cho đường
Câu 6 :
Etyl isovalerat là este có mùi thơm của táo. Công thức cấu tạo thu gọn của etyl isovalerat là
Đáp án : C Phương pháp giải :
Từ tên este dịch ra công thức cấu tạo Tên: RCOOR’ = tên gốc R’ + tên gốc RCOO- + at Lời giải chi tiết :
Công thức hóa học của etyl isovalerat là: CH3CH(CH3)CH2COOC2H5
Câu 7 :
Nhỏ dung dịch NaOH loãng vào bình đựng dung dịch chất X, thu được kết tủa màu xanh nhạt, khi thêm tiếp dung dịch NaOH vào bình, thấy kết tủa tan dần tạo thành dung dịch màu lục nhạt. X là
Đáp án : A Phương pháp giải :
Dựa vào dấu hiệu nhận biết màu sắc của các hidroxit Lời giải chi tiết :
Dung dịch X là CrCl3 3NaOH + CrCl3 → Cr(OH)3↓ xanh nhạt + 3NaCl Khi thêm tiếp NaOH vào bình thì Cr(OH)3↓ tan theo phản ứng: NaOH + Cr(OH)3↓ → NaCrO2 (dd màu xanh lục)+ 2H2O
Câu 8 :
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
Đáp án : A Phương pháp giải :
Gọi công thức của amin no, đơn chức, mạch hở là: CnH2n+3N BTNT “N” : nCnH2n+3N = nN = 2nN2 = ? (mol) => n = nCO2/namin =? => công thức của amin Lời giải chi tiết :
Gọi công thức của amin no, đơn chức, mạch hở là: CnH2n+3N nCO2 = 8,96 : 22,4 = 0,4 (mol) ; nN2 = 0,1 (mol) BTNT “N” : nCnH2n+3N = nN = 2nN2 = 0,2 (mol) => n = nCO2/namin = 0,4/0,2 = 2 Vậy công thức của amin là: C2H7N
Câu 9 :
Kim loại nhôm không tan được trong dung dịch nào sau đây?
Đáp án : B Lời giải chi tiết :
Kim loại Al thụ động trong H2SO4 đặc, nguội
Câu 10 :
Chất nào sau đây thuộc loại đisaccarit?
Đáp án : A Phương pháp giải :
Dựa vào sự phân loại cacbohiđrat Lời giải chi tiết :
Saccarozơ thuộc đisaccarit Tinh bột và xenlulozơ thuộc poli saccarit Glucozơ thuộc monosaccarit
Câu 11 :
Oxit nào sau đây phản ứng được với nước ở điều kiện thường?
Đáp án : B Lời giải chi tiết :
CrO3 + H2O → H2CrO4
Câu 12 :
Cho các chất sau: đimetylamin, axit glutamic, phenyl amoni clorua, natri axetat. Số chất phản ứng được với dung dịch HCl là
Đáp án : A Phương pháp giải :
Các chất phản ứng được với dd HCl: amin, aminoaxit, muối amoni Lời giải chi tiết :
Các chất phản ứng được với dung dịch HCl là: đimetylamin ( (CH3)2NH ), axit glutamic (HOOCCH2CH2CH(NH2)COOH ), natri axetat (CH3COONa) => có 3 chất
Câu 13 :
Kim loại nào sau đây có thể điều chế được bằng phương pháp nhiệt luyện ?
Đáp án : D Phương pháp giải :
Các kim loại đứng sau Al trong dãy điện hóa có thể được điều chế bằng phương pháp nhiệt luyên Lời giải chi tiết :
Fe có thể được điều chế bằng phương pháp nhiệt luyên là dùng các chất khử như H2,C, CO, Al để khử các oxi của sắt về Fe
Câu 14 :
Trong các chất sau, chất nào là chất rắn, không màu, dễ tan trong nước, kết tinh ở điều kiện thường?
Đáp án : B Phương pháp giải :
Ghi nhớ tính chất vật lí của amin, amino axit, cacbohidrat. Lời giải chi tiết :
H2NCH2COOH: glyxin là chất rắn, không màu, dễ tan trong nước, kết tinh ở điều kiện thường
Câu 15 :
X và Y là hai kim loại phản ứng được với dung dịch HCl nhưng không tác dụng được với dung dịch Fe(NO3)2. X,Y là
Đáp án : D Phương pháp giải :
Suy luận Lời giải chi tiết :
X, Y đều tác dụng được với dd HCl => X, Y là 2 kim loại đứng trước H trong dãy điện hóa X,Y không có phản ứng với dd Fe(NO3)2 => X,Y là kim loại đứng từ Fe trở về sau trong dãy điện hóa => X, Y là 2 kim loại Fe, Ni thoãn mãn
Câu 16 :
Trong các chất sau đây, chất nào có trạng thái khác với các chất còn lại ở điều kiện thường?
Đáp án : A Lời giải chi tiết :
Metyl aminoaxetat (H2NCH2COOCH3) là este ở thể lỏng ở đk thường Alanin, Axit glutamic, Valin là các aminoaxit ở thể rắn ở đk thường
Câu 17 :
Thạch cao nung được dùng để bó bột, đúc tượng do có hiện tượng giãn nở thể tích khi động cứng. Thành phần chính của thạch cao nung chứa.
Đáp án : C Lời giải chi tiết :
CaSO4 là thạch cao khan CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung CaSO4.2H2O là thạch cao sống
Câu 18 :
Chất hữu cơ X mạch hở, có công thức phân tử C4H6O2. Khi đun X với dung dịch NaOH thu được muối Y, biết MX < MY. Số công thức cấu tạo của X là
Đáp án : A Phương pháp giải :
X: C4H6O2 có độ bất bão hòa k = 2 X + NaOH → muối Y mà MX < MY => X là axit hoặc este (tạo bởi gốc ancol có phân tử khối nhỏ hơn Na) => các công thức cấu tạo thỏa mãn Lời giải chi tiết :
X: C4H6O2 có độ bất bão hòa k = 2 X + NaOH → muối Y mà MX < MY => X là axit hoặc este (tạo bởi gốc ancol có phân tử khối nhỏ hơn Na) Các công thức cấu tạo thỏa mãn: CH2=CH-CH2-COOH CH3-CH=CH-COOH (đồng phân cis-trans) CH2=C(CH3)-COOH CH2=CH-COOCH3 => Có 5 CTCT thoãn mãn
Câu 19 :
Cho 16,8 gam Fe vào 200 ml dung dịch CuSO4 0,75M. Sau một thời gian, lấy thanh sắt ra cân nặng 17,6 gam. Khối lượng đồng bám trên thanh sắt là
Đáp án : B Phương pháp giải :
PTHH: Fe + CuSO4 → FeSO4 + Cu↓ x → x (mol) => khối lượng tăng là 64x-56x = 8x (g) Theo bài ta có: ∆m tăng = mKl sau – mFe = 17,6 – 16,8 = 0,8 (g) => x = ? => mCu bám = ? Lời giải chi tiết :
nFe = 16,8 : 56 = 0,3 (mol) ; nCuSO4 = 0,2.0,75 = 0,15 (mol) PTHH: Fe + CuSO4 → FeSO4 + Cu↓ x → x (mol) => khối lượng tăng là 64x-56x = 8x (g) Theo bài ta có: ∆m tắng = mKl sau – mFe = 17,6 – 16,8 = 0,8 (g) => 8x = 0,8 => x = 0,1 (mol) => Khối lượng Cu bám trên thanh sắt là: mCu = 0,1.64 = 6,4 (g)
Câu 20 :
Lên men m gam glucozơ (hiệu suất 75%), thành ancol etylic và khí CO2. Dẫn toàn bộ lượng CO2 này vào bình đựng nước vôi trong thấy tách ra 40 gam kết tủa và dung dịch X. Thêm từ từ dung dịch NaOH vào dung dịch X đến khi lượng kết tủa tối đa thì dừng lại và sử dụng hết 0,04 mol dung dịch NaOH. Giá trị của m là
Đáp án : C Phương pháp giải :
Tính toán theo PTHH C6H12O6 → 2C2H5OH + 2CO2 (1) CO2 + Ca(OH)2 → CaCO3↓ + H2O (2) 2CO2 + Ca(OH)2 → Ca(HCO3)2 (3) Dung dịch X chứa Ca(HCO3)2. Cho từ từ NaOH vào để thu được kết tủa max thì dừng lại => xảy ra pư Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O (4) Lời giải chi tiết :
nCaCO3(2) = 40:100 = 0,4 (mol) C6H12O6 → 2C2H5OH + 2CO2 (1) CO2 + Ca(OH)2 → CaCO3↓ + H2O (2) 2CO2 + Ca(OH)2 → Ca(HCO3)2 (3) Dung dịch X chứa Ca(HCO3)2. Cho từ từ NaOH vào để thu được kết tủa max thì dừng lại => xảy ra pư Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O (4) 0,04 ← 0,04 (mol) Từ (3): nCO2(3) = 2nCa(HCO3) = 2.0,04 = 0,08 (mol) Từ (2): nCO2(2) = nCaCO3 = 0,4 (mol) => nCO2(1) = nCO2(2) + nCO2(3) = 0,4 + 0,08 = 0,48 (mol) Từ (1): nC6H12O6 = 1/2nCO2(1) = 0,24 (mol) => mC6H12O6 lí thuyết = 0,24. 180 = 43,2 (g) Vì %H = 75% => mGlu thực tế = mGlu lí thuyết .100% : %H = 43,2.100% : 75% = 57,6 (g)
Câu 21 :
X là dung dịch HCl nồng độ x (M). Y là dung dịch Na2CO3 nồng độ y(M). Nhỏ từ từ 100 ml dung dịch X vào 100 ml dung dịch Y, thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml dung dịch Y vào 100 ml dung dịch X, thu được V2 lít CO2(đktc), biết tỉ lệ V1: V2 = 3 : 5. Tỉ lệ x : y là
Đáp án : B Phương pháp giải :
nHCl = 0,1x (mol) ; nNa2CO3 = 0,1y (mol) TN1: Nhỏ từ từ HCl vào dd Na2CO3 xảy ra theo phương trình: HCl + Na2CO3 → NaCl + NaHCO3 HCl + NaHCO3 → NaCl + CO2↑ + H2O TN2: Nhỏ từ từ dd Na2CO3 vào dd HCl xảy ra phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O \(\frac{{{n_{C{O_2}}}_{(T{N_1})}}}{{{n_{C{O_2}}}_{(T{N_2})}}} = \frac{{0,1x - 0,1y}}{{0,05x}} = \frac{3}{5} \Rightarrow \frac{x}{y} = ?\) Lời giải chi tiết :
nHCl = 0,1x (mol) ; nNa2CO3 = 0,1y (mol) TN1: Nhỏ từ từ HCl vào dd Na2CO3 xảy ra theo phương trình: HCl + Na2CO3 → NaCl + NaHCO3 HCl + NaHCO3 → NaCl + CO2↑ + H2O => nCO2(TN1)= nHCl – nNa2CO3 => nCO2(TN1) = 0,1x – 0,1y TN2: Nhỏ từ từ dd Na2CO3 vào dd HCl xảy ra phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 0,1x → 0,05x (mol) nCO2(TN2) = 1/2nHCl = 0,05x (mol) Ta có: \(\begin{gathered}\frac{{{n_{C{O_2}}}_{(T{N_1})}}}{{{n_{C{O_2}}}_{(T{N_2})}}} = \frac{{0,1x - 0,1y}}{{0,05x}} = \frac{3}{5} \hfill \\\Rightarrow 0,5x + 0,5y = 0,15x \hfill \\\Rightarrow 0,35x = 0,5y \hfill \\\Rightarrow \frac{x}{y} = \frac{{0,5}}{{0,35}} = \frac{{10}}{7} \hfill \\ \end{gathered} \)
Câu 22 :
Hai chất P, Q có công thức phân tử lần lượt là C3H12N2O3 và C2H7NO3. Khi cho P,Q phản ứng với dung dịch HCl cùng tạo ra khí Z; còn với dung dich NaOH cùng cho khí Y. Nhận xét nào sau đây đúng
Đáp án : A Phương pháp giải :
Với công thức phân tử có dạng: CnH2n+6N2O3 => suy luận ngay là muối của amin và axit H2CO3 Với công thức phân tử có dạng CnH2n+3NO3 => suy luận là muối của amin với axit H2CO3 hoặc HNO3 Lời giải chi tiết :
P: C3H12N2O3 có CTCT (CH3NH3)2CO3 Q: C2H7NO3 có CTCT CH3NH3HCO3 Khí Z: CO2 Khí Y: CH3NH2 PTHH: (CH3NH3)2CO3 + 2HCl → 2CH3NH3Cl + CO2↑ + H2O CH3NH3HCO3 + HCl → CH3NH3Cl + CO2↑ + H2O (CH3NH3)2CO3 + 2NaOH → Na2CO3 + 2CH3NH2 + 2H2O CH3NH3HCO3 + 2NaOH → Na2CO3 + CH3NH2 + 2H2O
Câu 23 :
Cho một lượng hộp kim Ba – Na vào 200 ml dung dịch X gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
Đáp án : C Phương pháp giải :
Kim loại sau khi phản ứng xong với axit sẽ tiếp tục phản ứng với H2O có trong dung dịch 2nH2 = nHCl + nOH => nOH = ? Kết tủa thu được là Cu(OH)2 Lời giải chi tiết :
nHCl = nCuCl2= 0,2. 0,1 = 0,02 (mol) => nH+ = 0,02 (mol); nCu2+ = 0,02(mol) nH2 = 0,448 :22,4 = 0,02 (mol) Gọi chung kim loại Ba – Na là M hóa trị n Kim loại sau khi phản ứng xong với axit sẽ tiếp tục phản ứng với H2O có trong dung dịch PTHH: M + 2nH+ → Mn+ + nH2↑ 0,02→ 0,01 (mol) M + 2nH2O → Mn+ + 2nOH- + nH2↑ 0,02← (0,02-0,01) (mol) Cu2+ + 2OH- → Cu(OH)2 0,02 → 0,01 (mol) => mCu(OH)2↓ = 0,01. 98 = 0,98 (g)
Câu 24 :
Đốt cháy hoàn toàn V lít hỗn hợp X gồm H2, CH4, C2H6, C3H8, C4H10 thu được 7,84 lít khí CO2 và 9,9 gam nước, các khí đều đo ở đktc. Giá trị của V là
Đáp án : B Phương pháp giải :
Hỗn hợp X gồm ankan và H2 => khi đốt cháy cho nH2O > nCO2 và nX = nH2O – nCO2 = ? Lời giải chi tiết :
nCO2 = 7,84 : 22,4 = 0,35 (mol); nH2O = 9,9 :18 = 0,55 (mol) Hỗn hợp X gồm ankan và H2 => khi đốt cháy cho nH2O > nCO2 và nX = nH2O – nCO2 = 0,55 – 0,35 = 0,2 (mol) => VX(đktc) = 0,2. 22,4 = 4,48 (l)
Câu 25 :
Thực hiện các thí nghiệm sau ở nhiệt độ thường (1) Cho bột Al vào dung dịch NaOH. (2) Cho bột Fe vào dung dịch AgNO3. (3) Cho CaO vào dung dịch CH3COOH. (4) Cho dung dịch Na2CO3 vào dung dịch AlCl3. Số thí nghiệm có phản ứng xảy ra là:
Đáp án : A Phương pháp giải :
Dựa vào kĩ năng viết phương trình vô cơ Lời giải chi tiết :
Tất cả 4 thí nghiệm đều xảy ra phản ứng (1) Al + NaOH + H2O → NaAlO2 + 3/2H2↑ (2) Fe + 2AgNO3 → Fe(NO3)2 + Ag↓ (3) CaO + 2CH3COOH → (CH3COO)2Ca + H2O (4) 3Na2CO3 + 2AlCl3 + 3H2O → 6NaCl + 2Al(OH)3↓ + 3CO2
Câu 26 :
Cho 10 ml dung dịch cồn 460 vào bình đựng Na dư, sau khi phản ứng xong thu được V lít khí H2 (đktc), biết khối lượng riêng của ancol etylic và nước lần lượt là 0,8 g/ml và 1,0 g/ml. Giá trị của V là
Đáp án : D Phương pháp giải :
áp dụng công thức: \(\begin{gathered}D_r^0 = \dfrac{{{V_r}}}{{{V_{dd\,r}}}}.100 \hfill \\m = V.d \hfill \\ \end{gathered} \) Từ đó tính được mol rượu và mol H2O. Thể tích H2 thoát ra là cả rượu và H2O pư với Na Lời giải chi tiết :
\(\begin{gathered}{V_{{C_2}{H_5}OH}} = \dfrac{{{V_{dd}}}}{{100}}.D_r^0 = \dfrac{{10}}{{100}}.46 = 4,6\,(ml) \hfill \\\Rightarrow {m_{{C_2}{H_5}OH}} = {V_{{C_2}{H_5}OH}}.d = 4,6.0,8 = 3,68(g) \hfill \\\Rightarrow {n_{{C_2}{H_5}OH}} = \dfrac{{3,68}}{{46}} = 0,08\,(mol) \hfill \\ \end{gathered} \) VH2O = 10 – 4,6 = 5,4 (ml) => mH2O = VH2O.DH2O = 5,4 (g) => nH2O =0,3 (mol) Bảo toàn e: nH2 = ½(nH2O + nC2H5OH) = ½ (0,08 + 0,3) = 0,19 (mol) => VH2(đktc) = 0,19.22,4 = 4,256 (l)
Câu 27 :
Cho các chất rắn sau: Cr2O3, Fe(NO3)2, Al(OH)3, Mg. Số chất tan được trong dung dịch HCl loãng nguội (dư) là
Đáp án : D Lời giải chi tiết :
Tất cả 4 chất đều tan trong dd HCl loãng nguội Cr2O3 + 6HCl → 2CrCl3 + 3H2O 9Fe(NO3)2 + 12HCl → 4FeCl3 + 5Fe(NO3)3 + 4NO + 6H2O 2Al(OH)3 + 6HCl → 2AlCl3 + 6H2O Mg + 2HCl → MgCl2 + H2↑
Câu 28 :
X là axit đơn chức, mạch hở; Y là ancol đơn chức, mạch hở. Đung hỗn hợp X, Y với H2SO4 đặc thu được este Z. Biết trong Z có chứa 54,54% khối lượng cacbon. Số cặp chất phù hợp với X, Y là
Đáp án : A Phương pháp giải :
Gọi công thức của este Z là: CxHyO2 (đk: y ≤ 2x +2; x ≥ 2 ) Ta có: \(\begin{gathered}\% C = \frac{{12x}}{{12x + y + 32}}.100\% = 54,54\% \hfill \\\Rightarrow 10x = y + 32 \hfill \\ \end{gathered} \) Chạy thấy giá trị x = 4 và y = 8 thỏa mãn Vậy công thức của Z: C4H8O2 => viết các CTCT thỏa mãn Lời giải chi tiết :
Gọi công thức của este Z là: CxHyO2 (đk: y ≤ 2x +2; x ≥ 2 ) Ta có: \(\begin{gathered}\% C = \frac{{12x}}{{12x + y + 32}}.100\% = 54,54\% \hfill \\\Rightarrow 10x = y + 32 \hfill \\ \end{gathered} \) Chạy thấy giá trị x = 4 và y = 8 thỏa mãn Vậy công thức của Z: C4H8O2 Các CTCT thỏa mãn là: HCOOCH2CH2CH3 HCOOCH(CH3)CH3 CH3COOC2H5 C2H5COOCH3 => Có 4 CTCT thỏa mãn
Câu 29 :
Cho V lít đktc hỗn hợp khí gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
Đáp án : B Phương pháp giải :
Khối lượng rắn giảm chính là khối lượng oxi trong oxit => mO(oxit) = 0,32 (g) => nhh CO+ H2 = nO(oxit) = ? (mol) => Vhh CO+H2 = ? Lời giải chi tiết :
Khối lượng rắn giảm chính là khối lượng oxi trong oxit => mO(oxit) = 0,32 (g) => nhh CO+ H2 = nO(oxit) = 0,32 : 16 = 0,02 (mol) => Vhh CO+H2 = 0,02.22,4 = 0,448 (l)
Câu 30 :
Hợp chất hữu cơ A có công thức phân tử C9H8O4 thỏa mãn các phương trình hóa học sau: (1) A + 3NaOH \(\xrightarrow{{{t^0}}}\) 2X + Y + H2O (2) 2X + H2SO4 \(\xrightarrow{{{t^0}}}\) Na2SO4 + 2Z (3) Z + 2AgNO3 + 4NH3 + H2O \(\xrightarrow{{}}\)T + 2Ag + 2NH4NO3 Nhận xét nào sau đây đúng
Đáp án : C Phương pháp giải :
Suy luận A phải là este 2 chức và có 3 trung tâm phản ứng với NaOH => có nhóm -OH đính vào phenol Suy luận được Z phải là HCOOH Từ đó tìm đc CTCT của A Lời giải chi tiết :
A: C9H8O4 có độ bất bão hòa k = (9.2+2-8)/2 = 6 A phản ứng với NaOH theo tỉ lệ 1:3 => A có 3 trung tâm phản ứng với NaOH CTCT A: HOOC-C6H4-CH2-OOCH X: HCOONa ; Z: HCOOH; T là: HCOONH4 (1) HOOC-C6H4-CH2-OOCH + NaOH → 2HCOONa + NaO-C6H4-CH2-OH + H2O (2) 2HCOONa + H2SO4 → Na2SO4 + 2HCOOH (3) HCOOH + 2AgNO3 + 4NH3 + H2O → HCOONH4 + 2Ag↓ +2NH4NO3.
Câu 31 :
Đốt cháy hoàn toàn m gam một triglixerit X cần dùng 1,61 mol O2, thu được 1,14 mol CO2 và 1,06 mol H2O. Cho 26,58 gam X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tố O ta có: nO(X) = 2nCO2 + nH2O – 2nO2 → nCOOH(X) Bảo toàn khối lượng ta có mX + mO2 = mCO2 + mH2O → m Tính tỉ lệ suy ra số mol COOH trong 26,58 gam X => nNaOH và n glixerol Bảo toàn khối lượng: m muối = mX + mNaOH – mC3H5(OH)3 Lời giải chi tiết :
Bảo toàn nguyên tố O ta có → nO(X) = nO(X) = 2nCO2 + nH2O – 2nO2 = 0,12 → nCOOH(X) = 0,06 mol Bảo toàn khối lượng ta có mX + mO2 = mCO2 + mH2O → m + 1,61.32 = 1,14.44 + 1,06.18 → m = 17,72 g 17,72 g X có 0,06 mol COOH → 26,58 g X có 0,09 mol COOH → 26,58 g X + 0,09 mol NaOH → muối + 0,03 mol C3H5(OH)3 Bảo toàn khối lượng: m muối = mX + mNaOH – mC3H5(OH)3 = 26,58 + 0,09.40 – 0,03.92 = 27,42 gam
Câu 32 :
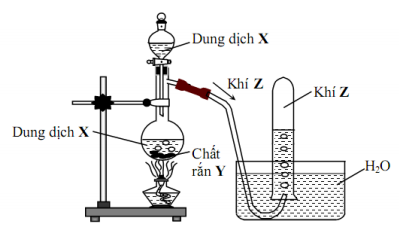
Mô hình thí nghiệm dùng để điều chế chất khí Z:
Phương trình hóa học nào sau đây phù hợp với mô hình trên?
Đáp án : B Phương pháp giải :
Thu khí Z bằng cách đẩy nước nên khí Z phải hầu như không tan trong nước và không phản ứng với nước. Lời giải chi tiết :
Thu khí Z bằng cách đẩy nước nên khí Z phải hầu như không tan trong nước và không phản ứng với nước. A loại vì CaC2 tác dụng với H2O không cần nhiệt độ, H2O không được gọi là dung dịch B phù hợp C loại vì SO2 là khí độc không thu bằng cách đẩy nước D loại vì chất tham gia đều là chất rắn còn mô hình thí nghiệm là chất rắn tác dụng với chất lỏng
Câu 33 :
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
Dung dịch X, Y, Z, T lần lượt là
Đáp án : C Phương pháp giải :
Xem lại lý thuyết về cacbohidrat, protein Lời giải chi tiết :
Loại B vì lòng trắng trứng không thỏa mãn tính chất của X (tạo chất màu xanh tím với I2) Loại D vì fructozo không thỏa mãn tính chất của Y (tác dụng với Cu(OH)2 tạo màu tím) Loại A vì phenyl amoniclorua không thỏa mãn tính chất của Z (tạo kết tủa Ag khi tác dụng với AgNO3/NH3, to)
Câu 34 :
Cho m gam hỗn hợp Al và BaO vào nước thu được dung dịch X và V lít khí H2 (đktc). Khi nhỏ từ từ dung dịch HCl vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:  Giá trị của m là
Đáp án : C Phương pháp giải :
Do trên đồ thị không tạo kết tủa ngay => dung dịch thu được có chứa OH- => Dung dịch X gồm: AlO2-, Ba2+, OH- - Tại nHCl = 0,1 mol: OH- bị trung hòa vừa hết => nOH- = nHCl - Tại nHCl = 0,3 mol: Kết tủa chưa đạt cực đại nH+ = nOH- + nAl(OH)3 => nAl(OH)3 - Tại nHCl = 0,7 mol: Kết tủa bị hòa tan một phần nH+ = nOH- + nAlO2- + 3(nAlO2- - nAl(OH)3) => nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => nAlO2- BTNT “Al”: nAl = nAlO2- BTNT “Ba”: nBaO = nBa2+ => m = mAl + mBaO Lời giải chi tiết :
Do trên đồ thị không tạo kết tủa ngay => dung dịch thu được có chứa OH- => Dung dịch X gồm: AlO2-, Ba2+, OH- - Tại nHCl = 0,1 mol: OH- bị trung hòa vừa hết => nOH- = nHCl = 0,1 mol - Tại nHCl = 0,3 mol: Kết tủa chưa đạt cực đại nH+ = nOH- + nAl(OH)3 => 0,3 = 0,1 + nAl(OH)3 => nAl(OH)3 = 0,2 mol - Tại nHCl = 0,7 mol: Kết tủa bị hòa tan một phần nH+ = nOH- + nAlO2- + 3(nAlO2- - nAl(OH)3) => nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => 0,7 = 0,1 + 4.nAlO2- - 3.0,2 => nAlO2- = 0,3 mol BTĐT cho dung dịch X: nBa2+ = (nAlO2- + nOH-)/2 = (0,3 + 0,1)/2 = 0,2 mol BTNT “Al”: nAl = nAlO2- = 0,3 mol BTNT “Ba”: nBaO = nBa2+ = 0,2 mol => m = mAl + mBaO = 0,3.27 + 0,2.153 = 38,7 gam
Câu 35 :
Đốt cháy m gam anđehit đơn chức mạch hở X (phân tử chứa không quá 4 nguyên tử cacbon), thu được 6,72 lít CO2 (đktc) và 1,8 gam nước. Mặt khác, khi cho 1,7 gam X phản ứng tối đa với a mol AgNO3 trong NH3. Giá trị của a là
Đáp án : D Phương pháp giải :
Giả sử công thức phân tử của anđehit là CnH2n+2-2kO CnH2n+2-2kO → nCO2 + (n+1-k)H2O 0,3 0,1 => 0,1n = 0,3(n+1-k) => 2n = 3k-3 => \(k = \frac{{2n + 3}}{3}\) Biện luận dựa vào dữ kiện số C không quá 4 để tìm được giá trị phù hợp của k và n. => CTPT và CTCT Dựa vào đặc điểm cấu tạo để xác định 1 mol X tác dụng được tối đa bao nhiêu mol AgNO3. Lời giải chi tiết :
nCO2 = 0,3 mol; nH2O = 0,1 mol Giả sử công thức phân tử của anđehit là CnH2n+2-2kO CnH2n+2-2kO → nCO2 + (n+1-k)H2O 0,3 0,1 => 0,1n = 0,3(n+1-k) => 2n = 3k-3 => \(k = \frac{{2n + 3}}{3}\) Do anđehit không chứa quá 4C nên thay các giá trị n = 1, 2, 3, 4 vào thu được nghiệm thỏa mãn là n = 3, k = 3 Vậy CTPT của anđehit là C3H2O, CTCT là CH≡C-CHO - Cho 1,8 gam X tác dụng với AgNO3: nX = 1,8/54 = 1/30 mol Cấu tạo của X là CH≡C-CHO: CH≡C- tác dụng với 1 AgNO3; CHO tác dụng với 2 AgNO3 => 1 X tác dụng với tối đa 3 AgNO3 => nAgNO3 = 3nX = 0,1 mol
Câu 36 :
Có các nhận xét sau: (1) Nhúng thanh Fe vào dung dịch FeCl3 xảy ra ăn mòn điện hóa. (2) Sục khí H2S vào dung dịch CuSO4 thấy xuất hiện kết tủa màu xanh nhạt. (3) Nhỏ dung dịch Na2CO3 vào dung dịch FeCl3 thấy có kết tủa màu đỏ nâu và thoát khí. (4) Nhúng thanh nhôm vào dung dịch NaOH loãng nguội, thấy thanh nhôm tan dần. (5) Đốt cháy dây sắt trong khí clo thấy hình thành muối sắt (II) clorua bám trên thanh sắt. Số nhận xét đúng là
Đáp án : B Lời giải chi tiết :
(1) sai vì không tạo thành cặp điện cực có bản chất khác nhau (2) sai vì tạo kết tủa CuS có màu đen (3) đúng, vì ban đầu tạo Fe2(CO3)3 muối này không bền nên bị thủy phân tạo Fe(OH)3 màu đỏ nâu và thoát khí CO2 3Na2CO3 + 2FeCl3 + 3H2O → 6NaCl + 2Fe(OH)3 + 3CO2 (4) đúng, vì Al tan được trong dung dịch NaOH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (5) sai vì Fe tác dụng với Cl2 đun nóng tạo thành FeCl3 2Fe + 3Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3 Vậy có tất cả 2 nhận xét đúng
Câu 37 :
Hỗn hợp X gồm metyl acrylat, vinyl axetat, buta-1,3-đien và vinyl axetilen. Để đốt cháy hoàn toàn 0,5 mol hỗn hợp X cần dùng 54,88 lít O2 (đktc) thu được khí CO2 và 23,4 gam H2O. Phần trăm khối lượng của vinyl axetilen có trong X là
Đáp án : B Phương pháp giải :
Đặt công thức của 3 chất đầu tiên metyl acrylat (CH2=CH-COOCH3), vinyl axetat (CH3COOCH=CH2), buta-1,3-đien (CH2=CH-CH=CH2) là C4H6On Như vậy hỗn hợp gồm C4H6On (x mol) và C4H4 (y mol) nX = x + y = 0,5 (1) nH2O = 3x + 2y = 1,3 (2) Giải (1) và (2) thu được x và y Các chất đều chứa 4C nên nCO2 = 4nX BTNT “O”: nO(X) + 2nO2 = 2nCO2 + nH2O => nO(X) Tính được mX = mC + mH + mO => %mC4H4 Lời giải chi tiết :
nO2 = 2,45 mol; nH2O = 1,3 mol Đặt công thức của 3 chất đầu tiên metyl acrylat (CH2=CH-COOCH3), vinyl axetat (CH3COOCH=CH2), buta-1,3-đien (CH2=CH-CH=CH2) là C4H6On Như vậy hỗn hợp gồm C4H6On (x mol) và C4H4 (y mol) nX = x + y = 0,5 (1) nH2O = 3x + 2y = 1,3 (2) Giải (1) và (2) thu được x = 0,3 và y = 0,2 nCO2 = 4nX = 4.0,5 = 2 mol (do các chất đều chứa 4C) BTNT “O”: nO(X) + 2nO2 = 2nCO2 + nH2O => nO(X) + 2.2,45 = 2.2 + 1,3 => nO(X) = 0,4 mol X chứa: C (2 mol), H (2.1,3 = 2,6 mol), O (0,4 mol) mX = mC + mH + mO = 12.2 + 1.2,6 + 16.0,4 = 33 gam => %mC4H4 = (0,2.52/33).100% = 31,52%
Câu 38 :
Điện phân 200 ml dung dịch hỗn hợp MgCl2 1M và NaCl 1M, với I = 2,68A, trong thời gian 3 giờ với điện cực trơ, màng ngăn xốp. Sau khi kết thúc điện phân thấy khối lượng dung dịch giảm m gam so với dung dịch ban đầu. Giá trị của m là
Đáp án : C Phương pháp giải :
ne = It/F Catot: Mg2+ và Na+ không bị điện phân, H2O điện phân hộ. H2O +1e → OH- + 0,5 H2 Anot: Cl- điện phân Cl- → 0,5Cl2 + 1e Chú ý còn phản ứng: Mg2+ + 2OH- → Mg(OH)2 => m dd giảm = mH2 + mCl2 + mMg(OH)2 Lời giải chi tiết :
ne = It/F = 2,68.3.3600/96500 = 0,3 mol nMg2+ = 0,2 mol; nCl- = 2nMgCl2 + nNaCl = 0,6 mol Catot: Mg2+ và Na+ không bị điện phân, H2O điện phân hộ. H2O +1e → OH- + 0,5 H2 0,3 → 0,3 → 0,15 mol Anot: Cl- (0,6 mol) Cl- → 0,5Cl2 + 1e 0,15 ← 0,3 mol Chú ý còn phản ứng: Mg2+ + 2OH- → Mg(OH)2 0,15 ← 0,3 → 0,15 (mol) m dd giảm = mH2 + mCl2 + mMg(OH)2 = 0,15.2 + 0,15.71 + 0,15.58 = 19,65 gam
Câu 39 :
Hỗn hợp X gồm alanin và đipeptit (Gly-Val). Cho m gam X vào 100 ml dung dịch hỗn hợp H2SO4 0,25M và HCl 0,25M, thu được dung dịch Y. Cho toàn bộ Y phản ứng vừa đủ với 240 ml gồm NaOH 0,3M và KOH 0,2M đun nóng, thu được dung dịch chứa 10,9155 gam muối trung hòa. Phần trăm khối lượng của alanin trong X là
Đáp án : B Phương pháp giải :
\(m(g)\,X\left\{ \begin{gathered}Ala:a \hfill \\Gly - Val:b \hfill \\ \end{gathered} \right. + \left\{ \begin{gathered}{H_2}S{O_4}:0,025 \hfill \\HCl:0,025 \hfill \\ \end{gathered} \right. + \left\{ \begin{gathered}NaOH:0,072 \hfill \\KOH:0,048 \hfill \\ \end{gathered} \right. \to 10,9155(g)\,muoi + {H_2}O\) nH2O = nAla + nGly-Val + 2nH2SO4 + nHCl BTKL: mX + mH2SO4 + mHCl + mNaOH + mKOH = m muối + mH2O => (1) nNaOH + nKOH = nAla + 2nGly-Val + 2nH2SO4 + nHCl => (2) Giải (1) và (2) thu được a và b => %mAla Lời giải chi tiết :
\(m(g)\,X\left\{ \begin{gathered}Ala:a \hfill \\Gly - Val:b \hfill \\\end{gathered} \right. + \left\{ \begin{gathered}{H_2}S{O_4}:0,025 \hfill \\HCl:0,025 \hfill \\\end{gathered} \right. + \left\{ \begin{gathered}NaOH:0,072 \hfill \\KOH:0,048 \hfill \\ \end{gathered} \right. \to 10,9155(g)\,muoi + {H_2}O\) nH2O = nAla + nGly-Val + 2nH2SO4 + nHCl = a + b + 0,075 BTKL: mX + mH2SO4 + mHCl + mNaOH + mKOH = m muối + mH2O => 89a + (75+117-18)b + 0,025.98 + 0,025.36,5 + 0,072.40 + 0,048.56 = 10,9155 + 18(a+b+0,075) (1) nNaOH + nKOH = nAla + 2nGly-Val + 2nH2SO4 + nHCl => 0,072 + 0,048 = a + 2b + 0,025.2 + 0,025 (2) Giải (1) và (2) thu được a = 0,025 và b = 0,01 => \(\% {m_{Ala}} = \frac{{0,025.89}}{{0,025.89 + 0,01.174}}.100\% = 56,12\% \)
Câu 40 :
Hòa tan hết 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu dược 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quá trình trên, sản phẩm khử duy nhất của NO3- là NO. Giá trị của m là
Đáp án : A Phương pháp giải :
nHNO3 > nNO => Trong dd Y có chứa NO3-: nNO3- = nHNO3 – nNO Sơ đồ phản ứng: \(X\left\{ \begin{gathered}Fe \hfill \\Cu \hfill \\S \hfill \\ \end{gathered} \right. + HN{O_3} \to Y\left\{ \begin{gathered}F{e^{3 + }} \hfill \\C{u^{2 + }} \hfill \\{H^ + } \hfill \\S{O_4}^{2 - } \hfill \\N{O_3}^ - \hfill \\\end{gathered} \right. + NO + {H_2}O\) Cho Y tác dụng với tối đa Fe: 3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O Fe + 2Fe3+ → 3Fe2+ Fe + Cu2+ → Fe2+ + Cu Lời giải chi tiết :
nHNO3 = 0,864 mol; nNO = 0,186 mol nHNO3 > nNO => Trong dd Y có chứa NO3-: nNO3- = 0,864 – 0,186 = 0,678 mol Khi cho BaCl2 dư tác dụng với Y: m kết tủa = mBaSO4 = 11,184 gam => nSO42- = nBaSO4 = 11,184:233 = 0,048 mol BTNT “O”: 3nHNO3 = 4nSO42- + 3nNO3- + nNO + nH2O => 3.0,864 = 0,048.4 + 0,678.3 + 0,186 + nH2O => nH2O = 0,18 mol BTNT “H”: nHNO3 = nH+ (Y) + 2nH2O => 0,864 = nH+(Y) + 0,18.2 => nH+(Y) = 0,504 mol Như vậy ta có sơ đồ sau: \(8,976(g)\left\{ \begin{gathered}Fe:x \hfill \\Cu:y \hfill \\ S:0,048 \hfill \\ \end{gathered} \right. + HN{O_3}:0,864 \to Y\left\{ \begin{gathered}F{e^{3 + }}:x \hfill \\C{u^{2 + }}:y \hfill \\{H^ + }:0,504 \hfill \\S{O_4}^{2 - }:0,048 \hfill \\N{O_3}^ - :0,678 \hfill \\ \end{gathered} \right. + NO:0,186 + {H_2}O:0,18\) 56x + 64y = 8,976 – 0,048.32 (1) BTĐT dd Y: 3x + 2y + 0,504 = 0,048.2 + 0,678 (2) Giải (1) và (2) được x = 0,03 và y = 0,09 Cho Y tác dụng với tối đa Fe: 3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O 0,189 ← 0,504 Fe + 2Fe3+ → 3Fe2+ 0,015 ← 0,03 Fe + Cu2+ → Fe2+ + Cu 0,09 ← 0,09 => m = (0,189 + 0,015 + 0,09).56 = 16,464 gam |