Đề thi thử THPT QG môn Hóa trường THPT chuyên Long AnĐề bài
Câu 1 :
Để khắc chữ lên thủy tinh người ta dùng phản ứng nào sau đây
Câu 2 :
Trong thành phần của gang, nguyên tố chiếm thành phần cao nhất là :
Câu 3 :
Nhôm không tan trong dung dịch :
Câu 4 :
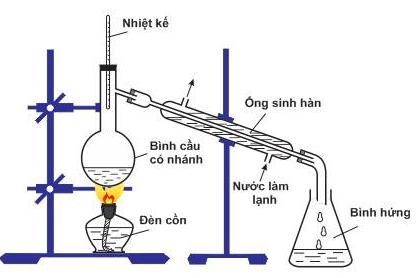
Bộ dụng cụ như hình vẽ bên mô tả cho phương pháp tách chất nào :
Câu 5 :
Gốc Glucozo và gốc Fructozo trong phân tử saccarozo liên kết với nhau qua nguyên tử :
Câu 6 :
Oxi hóa NH3 bằng CrO3 sinh ra N2 , H2O và Cr2O3. Số phân tử NH3 tác dụng với 1 phân tử CrO3 là :
Câu 7 :
Protein phản ứng với Cu(OH)2 tạo ra sản phẩm có màu đặc trưng :
Câu 8 :
Polime được tổng hợp bằng phản ứng trùng ngưng là :
Câu 9 :
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S. Hóa chất cần dùng là :
Câu 10 :
Phản ứng nào sau đây giải thích cho hiện tượng “Nước chảy, đá mòn” :
Câu 11 :
Phản ứng giữa C2H5OH và CH3COOH (xúc tác H2SO4 đặc đun nóng) là phản ứng :
Câu 12 :
Dân gian xưa kia dùng phèn chua làm thuốc chữa đau răng, đau mắt, cầm máu và đặc biệt dùng làm trong nước. Nguyên nhân nào sau đây làm cho phèn chua có khả năng làm trong nước :
Câu 13 :
Cho dung dịch Na2CO3 vào dung dịch Ca(HCO3)2 thấy :
Câu 14 :
Phương trình 2H+ + S2- → H2S là phương trình rút gọn của phản ứng :
Câu 15 :
Cho dãy kim loại : Zn, Fe, Cr. Thứ tự giảm dần độ hoạt động hóa học của các kim loại từ trái sang phải là :
Câu 16 :
Amilozo được tạo thành từ gốc:
Câu 17 :
Điều chế kim loại K bằng phương pháp :
Câu 18 :
Cho Glixerol tác dụng với axit axetic thì có thể sinh ra tối đa bao nhiêu chất có chứa gốc este ?
Câu 19 :
Đốt cháy hoàn toàn m gam chất béo X (chứa triglixerit của axit stearic, axit panmitic). Sau phản ứng thu được 20,16 lit khí CO2 (dktc) và 15,66g nước . Xà phòng hóa m gam X (H = 90%) thì thu được khối lượng glixerol là :
Câu 20 :
Khí cacbonic chiếm 0,03% thể tích không khí. Muốn tạo ra 500 g tinh bột thì cần bao nhiêu lit không khí (dktc) để cung cấp đủ CO2 cho phản ứng quang hợp :
Câu 21 :
Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ :
Câu 22 :
Hỗn hợp M gồm axit cacboxylic X, ancol Y (đều đơn chức) và este Z được tạo ra từ X và Y (trong M , oxi chiếm 43,795% về khối lượng). Cho 10,96g M tác dụng vừa đủ với 40g dung dịch NaOH 10% tạo ra 9,4g muối. Công thức của X và Y lần lượt là :
Câu 23 :
Nhóm vật liệu vào được chế tạo từ polime thiên nhiên :
Câu 24 :
Người ta có thể bảo vệ vỏ tàu biển bằng cách gắn những tấm kẽm vào vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện ly) vì :
Câu 25 :
Hỗn hợp X gồm M2CO3 , MHCO3 và MCl (trong đó M là kim loại kiềm). Nung nóng 20,29g hỗn hợp X, sau phản ứng xảy ra hoàn toàn thấy còn lại 18,74g chất rắn. Cũng đem 20,29g hỗn hợp X tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lit khí (dktc) và dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thu được 74,62g kết tủa . Kim loại M là :
Câu 26 :
Trong phân tử este đa chức mạch hở X có 2 liên kết pi, số nguyên tử cacbon và oxi khác nhau là 2. Cho X tác dụng với dung dịch NaOH, thu được sản phẩm gồm 1 muối của axit cacboxylic Y và một ancol Z. Biết X không có phản ứng tráng bạc . Số công thức cấu tạo phù hợp của X là :
Câu 27 :
Cho các phát biểu sau : (1) Tất cả các amino axit đều là chất rắn điều kiện thường (2) Tất cả các amino axit đều không làm đổi màu quì tím (3) Glyxin phản ứng được với tất các chất sau : dung dịch NaOH, dung dịch H2SO4 (4) Tất cả các amino axit đều có khả năng trùng hợp tạo peptit (5) Có thể dùng quì tím để phân biệt các dung dịch alanin, lysin, axit glutamic (6) Trong phân tử amino axit vừa chứa liên kết cộng hóa trị, vừa chứa liên kết ion Số phát biểu đúng là :
Câu 28 :
Hỗn hợp X gồm chất A (C5H16O3N2) và chất B (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ đung nóng cho đến khi phản ứng xảy ra hoàn toàn rồi cô cạn thu được m gam hỗn hợp Y gồm 2 muối D và E (MD < ME) và 4,48 lit khí (dktc) hỗn hợp Z gồm 2 amin no đơn chức đồng đẳng kế tiếp có tỉ khối so với H2 bằng 18,3. Khối lượng của muối E trong hỗn hợp Y là :
Câu 29 :
Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao. Sau phản ứng thu được 33,6 g chất rắn. Dẫn hỗn hợp khí sau phản ứng vào dung dịch Ca(OH)2 dư thu được 80g kết tủa . Giá trị của m là :
Câu 30 :
Chất A có công thức phân tử C6H8O4 . Cho sơ đồ phản ứng sau : (A) + 2NaOH → (B) + (C) + H2O (B) \(\xrightarrow{{{H_2}S{O_4},{t^0}}}\)(D) + H2O (C) + HCl → (E) + NaCl Phát biểu nào sau đây phù hợp với sơ đồ trên :
Câu 31 :
Hỗn hợp A chứa 3 ankin với tổng số mol là 0,1 mol. Chia A thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu 2,34g nước . Phần 2 tác dụng với vừa đủ 250 ml dung dịch AgNO3 0,12M trong NH3 tạo ra 4,55g kết tủa . Hãy gọi tên và phần trăm khối lượng của từng chất trong hỗn hợp A, biết rằng ankin có phân tử khối nhỏ nhất chiếm 40% về số mol.
Câu 32 :
Cho m gam hỗn hợp X gồm Na, Ca tan hết trong dung dịch Y chứa 0,08 mol NaHCO3 và 0,04 mol CaCl2. Sau phản ứng thu được 7g kết tủa và thấy thoát ra 0,896 lit khí (dktc). Giá trị của m là :
Câu 33 :
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31 : 24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên .
Giá trị của m và V lần lượt là :
Câu 34 :
Cho 38,55g hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 96,55g muối sunfat trong hòa và 3,92 lit khí Z (dktc) gồm 2 khí trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol Mg trong hỗn hợp X gần nhất với giá trị nào sau đây :
Câu 35 :
Cho các chất mạch hở : X là axit không no mạch phân nhánh, có 2 liên kết p ; Y và Z là 2 axit no đơn chức ; T là ancol no 3 chức ; E là este của X, Y, Z với T. Đốt cháy hoàn toàn m gam hỗn hợp M gồm X và E thu được a gam CO2 và (a – 4,62) gam H2O, mặt khác m gam M phản ứng vừa đủ với 0,04 mol NaOH trong dung dịch. Cho 13,2 gam M phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp muối khan V. Đốt cháy hoàn toàn V thu được 0,4 mol CO2 và 14,24 gam gồm Na2CO3 và H2O. Phần trăm khối lượng của E trong M có giá trị gần nhất với :
Câu 36 :
Hòa tan hoàn toàn 2 chất rắn X, Y (số mol bằng nhau) vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau : - Thí nghiệm 1 : Cho dung dịch NaOH dư vào V ml dung dịch Z thu được n1 mol kết tủa - Thí nghiệm 2 : Cho dung dịch NH3 dư vào V ml dung dịch X thu được n2 mol kết tủa - Thí nghiệm 3 : Cho dung dịch AgNO3 dư vào V ml dung dịch Z thu được n3 mol kết tủa Biết các phản ứng xảy ra hoàn toàn và n1 = n2 < n3. Hai chất X, Y không thể là :
Câu 37 :
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với :
Câu 38 :
Tiến hành thí nghiệm của 1 vài vật liệu polime với dung dịch kiềm theo các bước sau đây : - Bước 1 : Lấy 4 ống nghiệm đựng lần lượt các chất PE, PVC , sợi len, xenlulozo theo thứ tự 1,2,3,4 - Bước 2 : Cho vào mỗi ống nghiệm 2 ml dung dịch NaOH 10% đun sôi, để nguội - Bước 3 : Gạt lấy lớp nước ở mỗi ống nghiệm ta được tương ứng là các ống nghiệm 1’,2’,3’,4’ - Bước 4 : Thêm HNO3 và vài giọt AgNO3 vào ống nghiệm 1’,2’. Thêm vài giọt CuSO4 vào ống 3’,4’. Phát biểu nào sau đây sai :
Câu 39 :
Đốt cháy X cũng như Y với lượng oxi vừa đủ luôn thu được CO2 có số mol bằng số mol O2 đã phản ứng. Biết rằng X, Y (MX < MY) là 2 este đều mạch hở không phân nhánh và không chứa nhóm chức khác . Đun nóng 30,24g hỗn hợp E chứa X, Y (số mol của X gấp 1,5 lần số mol Y) cần dùng 400 ml dung dịch KOH 1M, thu được hỗn hợp F chứa 2 ancol và hỗn hợp chứa 2 muối. Dẫn toàn bộ F qua bình dựng Na dư thấy khối lượng bình tăng 15,2g. Đốt cháy hoàn toàn hỗn hợp muối cần dùng 0,42 mol O2. Tổng số nguyên tử có trong 1 phân tử Y là :
Câu 40 :
Điện phân V lit dung dịch X (điện cực trơ, màng ngăn xốp , cường độ dòng điện không đổi) chứa đồng thời R(NO3)2 0,45M (R là kim loại có hóa trị không đổi) và NaCl 0,4M trong thời gian t(giây) thu được 5,376 lit hỗn hợp khí ở anot (dktc). Nếu thời gian điện phân là 2t (giây) thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 320 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa . Biết hiệu suất điện phân 100%. Các khí sinh ra không tan trong dung dịch. Giá trị của V là :
Lời giải và đáp án
Câu 1 :
Để khắc chữ lên thủy tinh người ta dùng phản ứng nào sau đây
Đáp án : B Lời giải chi tiết :
Thành phần chính của thủy tinh chứa SiO2 tan được trong dd HF nên người ta dựa vào đặc điểm này để khác chữ lên thủy tinh
Câu 2 :
Trong thành phần của gang, nguyên tố chiếm thành phần cao nhất là :
Đáp án : D Lời giải chi tiết :
Trong gang có thành phần các nguyên tố là : Fe-C trong đó Cacbon chiếm 2 -5% về khối lượng tuy nhiên thành phần chính vẫn là Fe
Câu 3 :
Nhôm không tan trong dung dịch :
Đáp án : D Phương pháp giải :
Lý thuyết về tính chất hóa học của nhôm Lời giải chi tiết :
Nhôm là kim loại nên không phản ứng được với muối trung tính của kim loại kiềm (Na2SO4)
Câu 4 :
Bộ dụng cụ như hình vẽ bên mô tả cho phương pháp tách chất nào :
Đáp án : B Phương pháp giải :
Lý thuyết về các phương pháp tách chất hóa học Lời giải chi tiết :
Đáp án B
Câu 5 :
Gốc Glucozo và gốc Fructozo trong phân tử saccarozo liên kết với nhau qua nguyên tử :
Đáp án : D Lời giải chi tiết :
Trong phân tử saccarozo, gốc α-glucozo và gốc β-fructozo liên kết với nhau qua nguyên tử oxi giữa C1 của glucozo và C2 của fructozo
Câu 6 :
Oxi hóa NH3 bằng CrO3 sinh ra N2 , H2O và Cr2O3. Số phân tử NH3 tác dụng với 1 phân tử CrO3 là :
Đáp án : D Lời giải chi tiết :
Phản ứng : 2CrO3 + 2NH3 \(\xrightarrow{{{t^o}}}\) Cr2O3 + N2 + 3H2O => cứ 1 NH3 sẽ phản ứng với 1 CrO3
Câu 7 :
Protein phản ứng với Cu(OH)2 tạo ra sản phẩm có màu đặc trưng :
Đáp án : D Lời giải chi tiết :
Các peptit có từ 2 liên kết peptit trở lên sẽ phản ứng với Cu(OH)2 tạo màu tím đặc trưng. Protein chính là 1 polypeptit nên thỏa mãn điều kiện trên.
Câu 8 :
Polime được tổng hợp bằng phản ứng trùng ngưng là :
Đáp án : B Phương pháp giải :
Xem lại lý thuyết về polime Lời giải chi tiết :
nCH2=CHCN → (-CH2-CHCN-)n (poliacrilonitrin) nHO-CH2-CH2-OH + nHOOC-C6H4-COOH → (-O-C2H4-OOC –C6H4-CO-)n + 2nH2O (poli etylen-terephtalat) nCH2=CH2 → (-CH2-CH2-)n (polietilen) nCH2=CHCl → (-CH2-CHCl-)n (polivinylclorua)
Câu 9 :
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S. Hóa chất cần dùng là :
Đáp án : C Lời giải chi tiết :
Ag là kim loại hoạt động yếu, nguyên tắc là có thể dùng phương pháp thủy luyện như sau : Ag2S + 4NaCN → 2Na[Ag(CN)2] (phức tan) + Na2S Zn + 22Na[Ag(CN)2] → Na2[Zn(CN)4] + 2Ag↓
Câu 10 :
Phản ứng nào sau đây giải thích cho hiện tượng “Nước chảy, đá mòn” :
Đáp án : A Lời giải chi tiết :
“Nước chảy, đá mòn” là hiện tượng “ăn mòn” đá vôi dưới tác động của dòng nước có hòa tan CO2 theo phản ứng sau : CaCO3 + CO2 + H2O → Ca(HCO3)2 (Không tan) (tan)
Câu 11 :
Phản ứng giữa C2H5OH và CH3COOH (xúc tác H2SO4 đặc đun nóng) là phản ứng :
Đáp án : B Lời giải chi tiết :
Phản ứng giữa C2H5OH và CH3COOH (xúc tác H2SO4 đặc đun nóng) là phản ứng este hóa.
Câu 12 :
Dân gian xưa kia dùng phèn chua làm thuốc chữa đau răng, đau mắt, cầm máu và đặc biệt dùng làm trong nước. Nguyên nhân nào sau đây làm cho phèn chua có khả năng làm trong nước :
Đáp án : C Lời giải chi tiết :
Phèn chua có công thức là KAl(SO4)2.12H2O khi hòa vào nước thì phân ly ra Al3+ Sau đó có phản ứng : Al3+ + 3OH- → Al(OH)3 (kết tủa keo sẽ kéo các hạt bụi bẩn trong nước lắng xuống, từ đó làm trong nước)
Câu 13 :
Cho dung dịch Na2CO3 vào dung dịch Ca(HCO3)2 thấy :
Đáp án : C Lời giải chi tiết :
Phương trình phản ứng : Na2CO3 + Ca(HCO3)2 → 2NaHCO3 + CaCO3↓ => xuất hiện kết tủa trắng
Câu 14 :
Phương trình 2H+ + S2- → H2S là phương trình rút gọn của phản ứng :
Đáp án : A Phương pháp giải :
Các muối không tan, chất khí, các axit, bazo, chất điện li yếu giữ nguyên phân tử khi viết phương trình ion rút gọn Lời giải chi tiết :
Cả BaSO4 ; FeS ; CuS đều không tan nên không thể phân ly => phải xuất hiện trong phương trình rút gọn cuối cùng => Loại
Phương trình ion đầy đủ: 2H+ + 2Cl- + 2K+ + S2- → 2K+ + 2Cl- + H2S Phương trình ion rút gọn: 2H+ + S2- → H2S
Câu 15 :
Cho dãy kim loại : Zn, Fe, Cr. Thứ tự giảm dần độ hoạt động hóa học của các kim loại từ trái sang phải là :
Đáp án : C Phương pháp giải :
Xem lại lý thuyết về dãy hoạt động hóa học
Lời giải chi tiết :
Thứ tự độ hoạt động hóa học của kim loại giảm dần: Zn > Cr > Fe
Câu 16 :
Amilozo được tạo thành từ gốc:
Đáp án : A Lời giải chi tiết :
Amilozo được cấu tạo từ các gốc \(\alpha\)-Glucozo
Câu 17 :
Điều chế kim loại K bằng phương pháp :
Đáp án : D Lời giải chi tiết :
Điều chế kim loại kiềm có phương pháp là : Nhiệt phân nóng chảy muối Halogen của kim loại kiềm
Câu 18 :
Cho Glixerol tác dụng với axit axetic thì có thể sinh ra tối đa bao nhiêu chất có chứa gốc este ?
Đáp án : C Lời giải chi tiết :
Glixerol có 3 vị trí OH là 1, 2, 3. Axit axetic CH3COOH có 1 gốc COOH +) 3 gốc este : 1 chất +) 2 gốc este : 2 chất (1-2 ; 1-3) (1 và 3 đối xứng) +) 1 gốc este : 2 chất (1 ; 2) (1 và 3 đối xứng) => Có tổng cộng 5 chất
Câu 19 :
Đốt cháy hoàn toàn m gam chất béo X (chứa triglixerit của axit stearic, axit panmitic). Sau phản ứng thu được 20,16 lit khí CO2 (dktc) và 15,66g nước . Xà phòng hóa m gam X (H = 90%) thì thu được khối lượng glixerol là :
Đáp án : B Phương pháp giải :
Biện luận công thức este dựa vào số liên kết pi trong phân tử => CnH2n+2-2kO2m (m là số nhóm COO ; k là số liên kết pi trong phân tử) Bài toán hiệu suất : mThực tế = mLT.H% Lời giải chi tiết :
Este của axit no đơn chức (axit stearic và axit panmitic) và glyxerol => este này có 3 liên kết pi nằm trong 3 nhóm COO- => Công thức tổng quát của este là CnH2n - 4O6 - Phản ứng cháy : CnH2n – 4O6 + O2 → nCO2 + (n – 2)H2O - Theo phương trình, nCO2 – nH2O = 2neste Có : nCO2 = 20,16 : 22,4 = 0,9 mol ; nH2O = 15,66 : 18 = 0,87 mol => neste = ½ (0,9 – 0,87) = 0,015 mol - Phản ứng xà phòng hóa : Este + 3NaOH → 3Muối + Glycerol Mol 0,015 → 0,015 Vì hiệu suất phản ứng là 90% => nGlycerol thực = nGlycerol LT. H% = 0,015.90% = 0,0135 mol => mGlyxerol = 0,0135.92 = 1,242g
Câu 20 :
Khí cacbonic chiếm 0,03% thể tích không khí. Muốn tạo ra 500 g tinh bột thì cần bao nhiêu lit không khí (dktc) để cung cấp đủ CO2 cho phản ứng quang hợp :
Đáp án : D Phương pháp giải :
Phản ứng quang hợp : 6nCO2 + 5nH2O → (C6H10O5)n Tính toán số mol theo phản ứng => số mol CO2 => thể tích không khí cần dùng. Lời giải chi tiết :
Tinh bột có công thức : (C6H10O5)n => ntinh bột = \(\frac{{500}}{{162n}}\) mol - Phản ứng quang hợp : 6nCO2 + 5nH2O → (C6H10O5)n Mol 6n. \(\frac{{500}}{{162n}}\) ¬ \(\frac{{500}}{{162n}}\) => VCO2 = 22,4. 6n. \(\frac{{500}}{{162n}}\) = 414,815 lit => VKK = VCO2 : 0,03% = 1 382 716 lit
Câu 21 :
Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ :
Đáp án : A Lời giải chi tiết :
Phản ứng chuyển hóa giữa 2 dạng : 2H+ + 2CrO42- → Cr2O72- + H2O 2OH- + Cr2O72- → 2CrO42- + H2O (cam) (vàng)
Câu 22 :
Hỗn hợp M gồm axit cacboxylic X, ancol Y (đều đơn chức) và este Z được tạo ra từ X và Y (trong M , oxi chiếm 43,795% về khối lượng). Cho 10,96g M tác dụng vừa đủ với 40g dung dịch NaOH 10% tạo ra 9,4g muối. Công thức của X và Y lần lượt là :
Đáp án : B Phương pháp giải :
Bảo toàn nguyên tố. Phương pháp nguyên tử khối trung bình Gọi công thức tổng quát của các chất là : RCOOH ; R’OH ; RCOOR’ - Khi phản ứng với NaOH : RCOOH + NaOH → RCOONa + H2O RCOOR’ + NaOH → RCOONa + R’OH - Từ PT tính được số mol muối từ số mol NaOH => Mmuối và công thức phân tử của muối =>Y - Bảo toàn Oxi ta thấy : nO(M) = nO(X,Y,Z) . Mà nO(Y,Z) = nO(COO) và mO(M) = mM.43,795% = 4,8g => nO(Y) => nY => nM => Mtb (M) => biện luận công thức phân tử các chất trong M dựa vào Mtb Lời giải chi tiết :
Gọi công thức tổng quát của các chất là : RCOOH ; R’OH ; RCOOR’ - Khi phản ứng với NaOH : RCOOH + NaOH → RCOONa + H2O RCOOR’ + NaOH → RCOONa + R’OH \( \to \) nNaOH = \(\dfrac{{40.10}}{{100.40}}\) = 0,1 mol = nmuối \( \to \) Mmuối = \(\dfrac{{9,4}}{{0,1}}\) = 94g = R + 67 \( \to \) R = 27g (CH2=CH-) - Bảo toàn Oxi ta thấy : nO(M) = nO(X,Y,Z) . Mà nO(X,Z) = nO(COO) = 2nCOO = 2n(X,Z) = 0,2 mol mO(M) = mM.43,795% = 4,8g \( \to \) nO(M) = 0,3 mol \( \to \) nO(Y) = 0,3 – 0,2 = 0,1 mol = nY (Y có 1 nguyên tử oxi) \( \to \) Mtb (M) = 10,96 : (0,1 + 0,1) = 54,8g < MC2H3COO = 71g \( \to \) ancol Y phải có M < 54,8g +) TH1 : Y là CH3OH \( \to \) M gồm : 0,1 mol CH3OH ; x mol C2H3COOH ; (0,1 –x) mol C2H3COOCH3 \( \to \) mM = 0,1.32 + x.72 + (0,1 – x).86 = 10,96 \( \to \) x = 0,06 mol +) TH2 : Y là C2H5OH \( \to \) M gồm : 0,1 mol C2H5OH ; x mol C2H3COOH ; (0,1 –x) mol C2H3COOC2H5 \( \to \) mM = 0,1.46 + x.72 + (0,1 – x).86 = 10,96 \( \to \) x = 0,13 mol > 0,1 (Loại) Vậy chỉ có TH1 thỏa mãn \( \to \) X là CH3OH ; Y là C2H3COOH
Câu 23 :
Nhóm vật liệu vào được chế tạo từ polime thiên nhiên :
Đáp án : D Lời giải chi tiết :
Polime được chế tạo từ polime thiên nhiên thì có thể là polime thiên nhiên hoặc polime bán tổng hợp Polime bán tổng hợp : tơ axetat, tơ visco, phim ảnh (xenlulozo trinitrat) Polim tự nhiên : tơ tằm
Câu 24 :
Người ta có thể bảo vệ vỏ tàu biển bằng cách gắn những tấm kẽm vào vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện ly) vì :
Đáp án : A Lời giải chi tiết :
Khi gắn tấm kẽm lên vỏ tầu thủy tức là ta tạo ra 1 pin điện Zn-Fe trong đó Zn là cực âm là Zn và cực dương là Fe(trong thép). Trong pin điện hóa, cực dương diễn ra quá trình oxi hóa => Zn sẽ bị oxi hóa trước Fe
Câu 25 :
Hỗn hợp X gồm M2CO3 , MHCO3 và MCl (trong đó M là kim loại kiềm). Nung nóng 20,29g hỗn hợp X, sau phản ứng xảy ra hoàn toàn thấy còn lại 18,74g chất rắn. Cũng đem 20,29g hỗn hợp X tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lit khí (dktc) và dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thu được 74,62g kết tủa . Kim loại M là :
Đáp án : C Phương pháp giải :
- Khi nung nóng X chỉ có MHCO3 phản ứng : 2MHCO3 → M2CO3 + CO2 + H2O => mX - mrắn = mCO2 + mH2O (CO2 và hơi nước thoát đi làm cho khối lượng rắn giảm) => số mol các chất thoát ra => số mol MHCO3 - Khi X + HCl : nHCl = 0,5.1 = 0,5 mol ; nCO2 = 3,36 : 22,4 = 0,15 mol +) MHCO3 + HCl → MCl + CO2 + H2O +) M2CO3 + 2HCl → 2MCl + CO2 + H2O - Bảo toàn nguyên tố Clo : nCl-(Y) = nHCl + nMCl +) Ag+ + Cl- → AgCl => nMCl => mX = mMHCO3 + mM2CO3 + mMCl => kim loại M Lời giải chi tiết :
- Khi nung nóng X chỉ có MHCO3 phản ứng : 2MHCO3 → M2CO3 + CO2 + H2O mol x → 0,5x → 0,5x => mX - mrắn = mCO2 + mH2O (CO2 và hơi nước thoát đi làm cho khối lượng rắn giảm) => 20,29 – 18,74 = 44.0,5x + 18.0,5x => x = 0,05 mol - Khi X + HCl : nHCl = 0,5.1 = 0,5 mol ; nCO2 = 3,36 : 22,4 = 0,15 mol +) MHCO3 + HCl → MCl + CO2 + H2O Mol 0,05 → 0,05 +) M2CO3 + 2HCl → 2MCl + CO2 + H2O Mol 0,1 ¬ (0,15 – 0,05) - Bảo toàn nguyên tố Clo : nCl-(Y) = nHCl + nMCl +) Ag+ + Cl- → AgCl (nAgCl = 74,62 : 143,5 = 0,52 mol) Mol 0,52 ¬ 0,52 => 0,52 = nHCl + nMCl => nMCl = 0,52 – 0,5 = 0,02 mol => mX = mMHCO3 + mM2CO3 + mMCl => 20,29 = 0,05.(M + 61) + 0,1.(2M + 60) + 0,02.(M + 35,5) => M = 39g/mol (Kali)
Câu 26 :
Trong phân tử este đa chức mạch hở X có 2 liên kết pi, số nguyên tử cacbon và oxi khác nhau là 2. Cho X tác dụng với dung dịch NaOH, thu được sản phẩm gồm 1 muối của axit cacboxylic Y và một ancol Z. Biết X không có phản ứng tráng bạc . Số công thức cấu tạo phù hợp của X là :
Đáp án : B Phương pháp giải :
Biện luận, lập công thức cấu tạo của este Lời giải chi tiết :
Vì là este đa chức => có nhiều hơn 1 nhóm COO => có ít nhất 2 liên kết pi trong phân tử Mà theo đề bài X có 2 pi => X là este 2 chức, no và số C > 2 - Mặt khác , số oxi khác số C là 2 => X phải có 6 C trong phân tử. - X không có phản ứng tráng bạc => X không có gốc HCOO trong phân tử - X + NaOH → 1 muối + 1 ancol => 2 TH : X là este của axit 2 chức và ancol đơn chức hoặc axit đơn chức và ancol 2 chức +) TH1 : este của axit 2 chức và ancol đơn chức (COOC2H5)2 ; C2H4(COOCH3)2 (có 2 CTCT) +) TH2 : este của axit đơn chức và ancol 2 chức (CH3COO)2C2H4 => Tổng cộng có 4 công thức cấu tạo thỏa mãn
Câu 27 :
Cho các phát biểu sau : (1) Tất cả các amino axit đều là chất rắn điều kiện thường (2) Tất cả các amino axit đều không làm đổi màu quì tím (3) Glyxin phản ứng được với tất các chất sau : dung dịch NaOH, dung dịch H2SO4 (4) Tất cả các amino axit đều có khả năng trùng hợp tạo peptit (5) Có thể dùng quì tím để phân biệt các dung dịch alanin, lysin, axit glutamic (6) Trong phân tử amino axit vừa chứa liên kết cộng hóa trị, vừa chứa liên kết ion Số phát biểu đúng là :
Đáp án : B Phương pháp giải :
Xem lại lý thuyết về tính chất của aminoaxit Lời giải chi tiết :
(1) Đúng (2) Sai. Lysin làm quì tím chuyển xanh (tùy thuộc vào số nhóm NH2 và COOH trong phân tử amino axit) (3) Đúng (4) Sai. Peptit cấu thành từ các a-amino axit (5) Đúng . Vì : Alanin (tím) ; Lysin (xanh – 2 nhóm NH2,1 nhóm COOH) và Axit glutamic (đỏ - 2 nhóm COOH, 1 nhóm NH2) (6) Đúng. Vì amino axit còn được xem là muối nội phân tử : dạng +H3N-R-COO-
Câu 28 :
Hỗn hợp X gồm chất A (C5H16O3N2) và chất B (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ đung nóng cho đến khi phản ứng xảy ra hoàn toàn rồi cô cạn thu được m gam hỗn hợp Y gồm 2 muối D và E (MD < ME) và 4,48 lit khí (dktc) hỗn hợp Z gồm 2 amin no đơn chức đồng đẳng kế tiếp có tỉ khối so với H2 bằng 18,3. Khối lượng của muối E trong hỗn hợp Y là :
Đáp án : D Phương pháp giải :
Biện luận công thức cấu tạo của hợp chất có nguyên tố Nito Dạng 1: Muối cacboxylat của amin : Công thức phân tử chung của muối có dạng: CnH2n+3NO2 (n≥1) . Là muối của amino đơn chức mạch hở hoặc amoniac và axit cacboxylic no đơn chức mạch hở nên muối có tính lưỡng tính CnH2n+3NO2 + H+ → CxH2x+1COOH + CyH2y+3NH+ (x+y+1=n) CnH2n+3NO2 + OH- → CxH2x+1COO- + CyH2y+3N + H2O (x+y+1=n) Đặc điểm: khi phản ứng với NaOH thu được muối duy nhất và khí bay ra làm xanh quì tím ẩm Dạng 2: Muối nitrat của amin Công thức phân tử chung của muối có dạng: CnH2n+4O3N2 (n≥1) . Là muối của bazơ yếu ( CnH2n + 3N) và axit mạnh (HNO3) nên muối có tính axit yếu. Muối tác dụng với dung dịch kiềm tạo muối nitrat + amin + nước CnH2n+3NH+NO3- + NaOH → CnH2n+3N + H2O + NaNO3 Đặc điểm: phản ứng với NaOH thu được muối vô cơ và khí làm xanh quì tím ẩm Dạng 3: Muối cacbonat của amin: a- Công thức phân tử chung của muối có dạng: CnH2n+6 O3N2 (n≥2) .Là muối của amin no đơn chức mạch hở và axit cacbonic (muối cacbonat) nên muối có tính lưỡng tính. Khi tác dụng với dung dịch bazơ mạnh (VD: NaOH) tạo ra sản phẩm là:Na2CO3 + amin + nước Khi tác dụng với dung dịch axit mạnh (VD: HCl) tạo ra sản phẩm là: NaCl + khí cacbonic + nước. Cũng cần lưu ý: Công thức phân tử chung của muối có dạng : CnH2n+6O3N2 (n≥2) rất dễ nhầm lẫn với muối nitrat của amin có dạng CnH2n+4O3N2 . b- Công thức phân tử chung của muỗi có dạng CnH2n+3 O3N (n≥2). Là muối của amin no đơn chức mạch hở và axit cacbonic( muối hiđrocacbonat) nên muối có tính lưỡng tính. Khi tác dụng với dung dịch bazơ mạnh (VD: NaOH) tạo ra sản phẩm là :Na2CO3 + amin + nước Khi tác dụng với dung dịch axit mạnh (VD: HCl) tạo ra sản phẩm là : NaCl + khí cacbonic + nước Lời giải chi tiết :
- Xét khí Z : nZ = 4,48 : 22,4 = 0,2 mol. MZ = 18,3 . 2 = 36,6g => 2 amin phải là CH3NH2 và C2H5NH2 với số mol lần lượt là x và y => x + y = 0,2 và mZ = 31x + 45y = 36,6.0,2 => x = 0,12 ; y = 0,08 mol - Biện luận công thức cấu tạo của A và B : +) A là C5H16O3N2 có dạng CnH2n+6 O3N2 => A là muối cacbonat của amin: (C2H5NH3)2CO3 (A không thể là muối nitrat của amin vì không thể tạo ra CH3NH2 hay C2H5NH2) +) B là C4H12O4N2 có dạng muối cacboxylat của amin : (COONH3CH3)2 - Các phương trình phản ứng : (C2H5NH3)2CO3 + 2NaOH → 2C2H5NH2 + Na2CO3 + 2H2O (M = 106) (COONH3CH3)2 + 2NaOH → (COONa)2 + 2CH3NH2 + 2H2O (M = 134) => E => mE = 134.nE = 134.0,5nCH3NH2 = 134.0,5.0,12 = 8,04g
Câu 29 :
Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao. Sau phản ứng thu được 33,6 g chất rắn. Dẫn hỗn hợp khí sau phản ứng vào dung dịch Ca(OH)2 dư thu được 80g kết tủa . Giá trị của m là :
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tố: nO(oxit) = nCO2 = nCaCO3 =? Bảo toàn khối lượng : mOxit = mrắn + mO pứ = ? Lời giải chi tiết :
Tổng quát: Gọi công thức oxit là FexOy FexOy + yCO → xFe + yCO2 CO2 + Ca(OH)2 → CaCO3 + H2O Ta có : nCaCO3 = 80 : 100 = 0,8 mol = nCO2 = nO( Oxit pứ) Bảo toàn khối lượng : mOxit = mrắn + mO pứ = 33,6 + 16.0,8 = 46,4g
Câu 30 :
Chất A có công thức phân tử C6H8O4 . Cho sơ đồ phản ứng sau : (A) + 2NaOH → (B) + (C) + H2O (B) \(\xrightarrow{{{H_2}S{O_4},{t^0}}}\)(D) + H2O (C) + HCl → (E) + NaCl Phát biểu nào sau đây phù hợp với sơ đồ trên :
Đáp án : A Phương pháp giải :
Biện luận công thức cấu tạo của este dựa vào công thức phân tử và tính chất hóa họC. Công thức tính số liên kết pi + vòng = \(\frac{{2C + 2 - H}}{2}\) Lời giải chi tiết :
- Este là C6H8O4 : Số (pi + vòng) = \(\frac{{2.6 + 2 - 8}}{2}\)= 3 => Este 2 chức có 1 liên kết pi trong gốc hidrocacbon - Dựa vào phản ứng : (A) + 2NaOH → (B) + (C) + H2O => A có 1 nhóm COOH và 1 nhóm COOR - Mặt khác có phản ứng : (B) \(\xrightarrow{{{H_2}S{O_4},{t^0}}}\)(D) + H2O =>B phải là ancol có từ 2 C trở lên => Công thức của A chỉ có thể là : HOOC – CH = CH – COOC2H5
Câu 31 :
Hỗn hợp A chứa 3 ankin với tổng số mol là 0,1 mol. Chia A thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu 2,34g nước . Phần 2 tác dụng với vừa đủ 250 ml dung dịch AgNO3 0,12M trong NH3 tạo ra 4,55g kết tủa . Hãy gọi tên và phần trăm khối lượng của từng chất trong hỗn hợp A, biết rằng ankin có phân tử khối nhỏ nhất chiếm 40% về số mol.
Đáp án : A Phương pháp giải :
- Xét phần 1 : nA1 = nA2 = ½ nA = 0,05 mol Từ số mol H2O => số mol H trong A1 => Số H trung bình (A) - Xét phần 2 : Biện luận các chất trong A dựa vào mối tương quan giữa số mol AgNO3 và số mol ankin (Có chất nào không phản ứng hay không ? Có CH≡CH hay không ? ) CH≡CH + 2AgNO3 → Ag2C2 - Dựa vào Số H trung bình tính được ở A1 biện luận các chất trong A => số mol các chất trong A và % theo khối lượng. Lời giải chi tiết :
- Xét phần 1 : nA1 = nA2 = ½ nA = 0,05 mol nH(H2O) = nH(A1) = 2nH2O = 2.2,34 : 18 = 0,26 mol => Số H trung bình (A) = 0,26 : 0,05 = 5,2 - Xét phần 2 : nAgNO3 = 0,25.0,12 = 0,03 mol < nA2 = 0,05 mol => trong A có ankin không phản ứng với AgNO3 => But-2-in +) Không thể có CH≡CH trong A vì : nC2H2 = nA.40% = 0,02 mol (C2H2 có M nhỏ nhất trong A) CH≡CH + 2AgNO3 → Ag2C2 0,02 → 0,04 mol > 0,03 (Vô lý) - Dựa vào Số H trung bình = 5,2 => A phải chứa C3H4 (propin) => Bộ 3 ankin phù hợp là propin (0,02 mol) ; but-1-in ; but-2-in - Tổng quát : RC≡CH + AgNO3 → RC≡CAg ↓ => nankin = npropin + nbut-1-in = nAgNO3 = 0,03 => nbut-1-in = 0,03 – 0,02 = 0,01 mol => nbut-2-in = nA2 – npropin – nbut-1-in = 0,05 – 0,02 – 0,01 = 0,02 mol => mA2 = 0,02.MC3H4 + 0,02.MC4H6 + 0,01.MC4H6 = 2,42g => %mbut-2-in = 0,02.54 : 2,42 = 44,6%
Câu 32 :
Cho m gam hỗn hợp X gồm Na, Ca tan hết trong dung dịch Y chứa 0,08 mol NaHCO3 và 0,04 mol CaCl2. Sau phản ứng thu được 7g kết tủa và thấy thoát ra 0,896 lit khí (dktc). Giá trị của m là :
Đáp án : D Phương pháp giải :
nNaHCO3 = 0,08 mol ; nCaCl2 = 0,04 mol nCaCO3 = nCa2+ = nCa + nCaCl2 (Bảo toàn nguyên tố Ca) => nCa - Các phản ứng của kim loại khi thả vào nước : Na + H2O → NaOH + ½ H2 Ca + 2H2O → Ca(OH)2 + H2 => nH2 = ½ nNa + nCa => nNa => m = mNa + mCa Lời giải chi tiết :
nNaHCO3 = 0,08 mol ; nCaCl2 = 0,04 mol nCaCO3 = 7 : 100 = 0,07 mol = nCa2+ = nCa + nCaCl2 (Bảo toàn nguyên tố Ca) => nCa = 0,07 – 0,04 = 0,03 mol - Các phản ứng của kim loại khi thả vào nước : Na + H2O → NaOH + ½ H2 Ca + 2H2O → Ca(OH)2 + H2 => nH2 = 0,896 : 22,4 = 0,04 mol = ½ nNa + nCa => nNa = 2.(0,04 – 0,03) = 0,02 mol => m = mNa + mCa = 23.0,02 + 40.0,03 = 1,66g
Câu 33 :
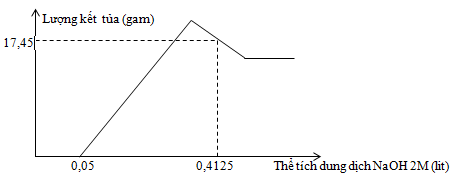
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31 : 24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên .
Giá trị của m và V lần lượt là :
Đáp án : D Phương pháp giải :
- Công thức tính nhanh khi hỗn hợp KL + HNO3 ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 - Bài toán Al3+ + OH- : Cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa: + Với muối nhôm Các phản ứng xảy ra: Al3+ + 3OH- → Al(OH)3 (1) Al(OH)3 + OH- → (Al(OH)4)- (2) Từ (1) và (2) ta rút ra kết luận: + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần Al3+ + 3OH- → Al(OH)3 (1) mol a → 3a → a Al(OH)3 + OH- (Al(OH)4)- (2) Mol b-3a b-3a nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
- Xét hỗn hợp khí : Mkhí = 32.31/24 = 124/3 => nN2 + nN2O = 0,084 mol và 28nN2 + 44nN2O = 0,084.124/3 => nN2 = 0,014 ; nN2O = 0,07 mol - Xét phản ứng kim loại và HNO3 : ne = 3nAl + 2nMg = 10nN2 + 8nN2O = 0,7 mol (*) nHNO3 pứ = 12nN2 + 10nN2O = 0,868 mol - Xét đồ thị : +) Tại nNaOH = 0,05.2 = 0,1 mol thì bắt đầu có kết tủa => nHNO3 dư = nNaOH = 0,1 mol => ånHNO3 = 0,868 + 0,1 = 0,968 mol => VHNO3 = 0,968 : 2,5 = 0,3872 lit = 387,2 ml +) Tại nNaOH = 0,4125.2 = 0,825 mol (Lúc này lượng kết tủa giảm sau khi đạt max) => Al(OH)3 tan 1 phần => nNaOH pứ = nNaOH – nHNO3 dư – 2nMg(OH)2 Các phản ứng : H+ + OH- → H2O Mg2+ + 2OH- → Mg(OH)2 Al3+ + 3OH- → Al(OH)3 Al(OH)3 + OH- → AlO2- + 2H2O => mkết tủa = mMg(OH)2 + mAl(OH)3 = 58.nMg + 78.(4nAl - nOH-) => 17,45 = 58.nMg + 78.(4nAl – (0,825 – 0,1 – 2nMg)) (**) Từ (*) và (**) => nMg = 0,2 ; nAl = 0,1 mol => m = mAl + mMg = 27.0,1 + 24.0,2 = 7,5g
Câu 34 :
Cho 38,55g hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 96,55g muối sunfat trong hòa và 3,92 lit khí Z (dktc) gồm 2 khí trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol Mg trong hỗn hợp X gần nhất với giá trị nào sau đây :
Đáp án : D Phương pháp giải :
\(\begin{array}{*{20}{c}}{38,55g} \\ X \end{array}\left\{ \begin{gathered} Mg \hfill \\Al \hfill \\ZnO \hfill \\F{\text{e}}{(N{O_3})_2} \hfill \\\end{gathered}\right.\xrightarrow[{0,725(mol)}]{{{H_2}S{O_{4(l)}}}}\left\{\begin{gathered}dd.Y:96,55g.muoi \hfill \\\uparrow Z:\left\{ \begin{gathered} V = 3,92(l) \hfill \\{d_{Z/{H_2}}} = 9 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \right.\) - Biện luận các chất trong hỗn hợp khí Z Công thức tính nhanh trong bài toán hỗn hợp chất + HNO3 : nH+ = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4 + 2nO + 2nH2 - Bảo toàn nguyên tố, Bảo toàn khối lượng , bảo toàn e. Lời giải chi tiết :
- Xét khí Z : nZ = 3,92 : 22,4 = 0,175 mol MZ = 9.2 = 18g. Vì có 1 khí hóa nâu ngoài không khí => NO => khí còn lại là H2 => nNO + nH2 = 0,175 mol và mZ = 30nNO + 2N2 = 18.0,175 = 3,15g => nNO = 0,1 ; nH2 = 0,075 mol - Bảo toàn khối lượng : mX + mH2SO4 = mmuối + mZ + mH2O => mH2O = 38,55 + 0,725.98 – 3,15 – 96,55 = 9,9g => nH2O = 0,55 mol - Bảo toàn nguyên tố H : 2nH2SO4 = 4nNH4 + 2nH2 + 2nH2O => nNH4 = 0,05 mol - Công thức tính nhanh : nH+ pứ = 4nNO + 2nH2 + 2nO(X) + 10nNH4 => nO(X) = 0,2 mol = nZnO (Bảo toàn nguyên tố Oxi) - Bảo toàn Nito : nNO + nNH4 = 2nFe(NO3)2 => nFe(NO3)2 = 0,075 mol - Ta có : mX = mAl + mMg + mZnO + mFe(NO3)2 => 24nMg + 27nAl = 8,85g Và : ne = 3nAl + 2nMg = 2nH2 + 8nNH4 + 3nNO = 0,85 mol (Vì có H2 nên H+ dư phản ứng với kim loại => chỉ có Fe2+ trong dung dịch) => nAl = 0,15 ; nMg = 0,2 mol => %mMg(X) = 0,2.24 : (0,2 + 0,15 + 0,2 + 0,075) = 32% (gần nhất với giá trị 30%)
Câu 35 :
Cho các chất mạch hở : X là axit không no mạch phân nhánh, có 2 liên kết p ; Y và Z là 2 axit no đơn chức ; T là ancol no 3 chức ; E là este của X, Y, Z với T. Đốt cháy hoàn toàn m gam hỗn hợp M gồm X và E thu được a gam CO2 và (a – 4,62) gam H2O, mặt khác m gam M phản ứng vừa đủ với 0,04 mol NaOH trong dung dịch. Cho 13,2 gam M phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp muối khan V. Đốt cháy hoàn toàn V thu được 0,4 mol CO2 và 14,24 gam gồm Na2CO3 và H2O. Phần trăm khối lượng của E trong M có giá trị gần nhất với :
Đáp án : C Phương pháp giải :
- Vì E là este của với 3 axit X,Y,Z => X cũng là axit đơn chức - Xét phản ứng đốt cháy M (X, E) Gọi công thức tổng quát của X : CnH2n-2O2 E : CmH2m-6O6 Khi đốt cháy : CnH2n-2O2 + (1,5n – 2)O2 → nCO2 + (n – 1)H2O CmH2m-6O6 + (1,5m – 5)O2 → mCO2 + (m – 3)H2O => nCO2 – nH2O = nX + 3nE - M phản ứng với NaOH : nNaOH = nCOO = nX + 3nE Mặt khác mCO2 – mH2O = a – (a – 4,62) = 4,62g => nCO2 và nH2O => khối lượng của M => Tính được số mol các chất phản ứng dựa vào tỉ lệ tương ứng khối lượng của M - Xét 13,2g M + NaOH => tính số mol các nguyên tố trong M - Gọi công thức tổng quát của các muối trong V là CxH2x+1COONa ; CyH2y-1COONa (y chẵn, x > 0) -Phản ứng cháy : CxH2x+1COONa + O2 → (x + 0,5)CO2 + (x + 0,5)H2O + 0,5Na2CO3 CyH2y-1COONa + O2 → (y + 0,5)CO2 + (y - 0,5)H2O + 0,5Na2CO3 => tính được số mol các muối => Biện luận công thức cấu tạo các chất => Thánh phần các chất trong M => %mE(M) Lời giải chi tiết :
- Vì E là este của với 3 axit X,Y,Z => X cũng là axit đơn chức - Xét phản ứng đốt cháy M (X, E) (Vì X có 2 liên kết pi => X có 1 pi trong gốc hidrocacbon và 1 pi trong nhóm COO) => E là este của X,Y,Z => số pi = pi(gốc R của X) + pi(COO) = 1 + 3 = 4) Gọi công thức tổng quát của X : CnH2n-2O2 : u mol E : CmH2m-6O6 : v mol Khi đốt cháy : CnH2n-2O2 + (1,5n – 2)O2 → nCO2 + (n – 1)H2O CmH2m-6O6 + (1,5m – 5)O2 → mCO2 + (m – 3)H2O => nCO2 – nH2O = nX + 3nE = u + 3v - M phản ứng với NaOH : nNaOH = nCOO = nX + 3nE = u + 3v = 0,04 mol Mặt khác mCO2 – mH2O = a – (a – 4,62) = 4,62g => nCO2 = 0,15 ; nH2O = 0,11 mol Bảo toàn nguyên tố : nC(M) = nCO2 = 0,15 mol ; nH(M) = 2nH2O = 0,22 mol nO(M) = 2nCOO(M) = 2nNaOH = 0,08 mol => mM = m = mC + mH + mO = 3,3g - Xét 13,2g M + NaOH → Muối V thì số mol nguyên tố trong M gấp 13,2 : 3,3 = 4 lần Và số mol NaOH + M cũng gấp 4 lần => nNaOH = 0,04.4 = 0,16 mol = nmuối V ( Phản ứng tổng quát : Este/Axit + NaOH → Muối + Ancol/H2O ) Khi đốt cháy tạo nCO2 = 0,4 mol Bảo toàn Na : nNa2CO3 = ½ nNaOH = 0,08 mol Có : mNa2CO3 + mH2O =14,24g => nH2O = 0,32 mol Bảo toàn Oxi : nO(V) + 2nO2 = 2nCO2 + nH2O + 3nNa2CO3 => nO2 = 0,52 mol Bảo toàn khối lượng : mV + mO2 = mCO2 + mNa2CO3 + mH2O => mV = 15,2g - Gọi công thức tổng quát của các muối trong V là CxH2x+1COONa ; CyH2y-1COONa (y chẵn, x > 0) -Phản ứng cháy : CxH2x+1COONa + O2 → (x + 0,5)CO2 + (x + 0,5)H2O + 0,5Na2CO3 Mol p CyH2y-1COONa + O2 → (y + 0,5)CO2 + (y - 0,5)H2O + 0,5Na2CO3 Mol q => nCO2 – nH2O = q = 0,4 – 0,32 = 0,08 mol => p = 0,16 – q = 0,08 mol Ta có : nC(V) = nCO2 + nNa2CO3 = 0,48 mol = 0,08.(x+1) + 0,08(y+1) => x + y = 4 Vì X có gốc hidrocacbon mạch nhánh, có 1 liên kết pi trong gốc hidrocacbon => số C trong gốc hidrocacbon của X ≥ 3 => y = 3 và x = 1 thỏa mãn điều kiện => X là C3H5COOH, 2 axit còn lại là HCOOH và C2H5COOH với số mol bằng nhau = 0,04 mol (Vì : Số C trung bình = 1 = ½ (tổng số C của 2 axit) => tỉ lệ mol 1 : 1) Vậy Trong M có : 0,04 mol este E(gốc ancol là R) và 0,04 mol X => mM = 13,2 = 0,04.(R + 203) + 0,04.86 => R = 41 (C3H5) => %mE(M) = 73,94%
Câu 36 :
Hòa tan hoàn toàn 2 chất rắn X, Y (số mol bằng nhau) vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau : - Thí nghiệm 1 : Cho dung dịch NaOH dư vào V ml dung dịch Z thu được n1 mol kết tủa - Thí nghiệm 2 : Cho dung dịch NH3 dư vào V ml dung dịch X thu được n2 mol kết tủa - Thí nghiệm 3 : Cho dung dịch AgNO3 dư vào V ml dung dịch Z thu được n3 mol kết tủa Biết các phản ứng xảy ra hoàn toàn và n1 = n2 < n3. Hai chất X, Y không thể là :
Đáp án : B Phương pháp giải :
Xem lại lý thuyết tính chất hóa học của các hợp chất vô cơ Lời giải chi tiết :
Xét thí nghiệm 1 và 2 có tạo số mol kết tủa bằng nhau => 2 chất X và Y không thể là Al3+ và Fe2+ vì Al(OH)3 tan trong NaOH và không tan trong NH3 Do đó số kết tủa ở thí nghiệm 1 sẽ phải nhỏ hơn thí nghiệm 2 => không thỏa mãn đề bài
Câu 37 :
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với :
Đáp án : D Phương pháp giải :
- Tìm số mol các chất trong X dựa vào các dữ kiện : mX ; nFeO = 1/3nX ; Thí nghiệm 2 - Qui đổi cả quá trình thành sơ đồ sau : \(\left. \begin{gathered}F{\text{e}} \hfill \\Cu \hfill \\O \hfill \\ \end{gathered} \right\} + \left\{ \begin{gathered}NaN{{\text{O}}_3} \hfill \\HCl \hfill \\AgN{O_3} \hfill \\ \end{gathered} \right. \to \left\{\begin{gathered}F{{\text{e}}^{3 + }} \hfill \\C{u^{2 + }} \hfill \\ \end{gathered} \right. + \left\{\begin{gathered}Ag \hfill \\ AgCl \hfill \\ \end{gathered} \right. + NO + {H_2}O\) => Áp dụng định luật bảo toàn electron để tìm ra số mol Ag Lời giải chi tiết :
- Gọi số mol FeO, Fe3O4, Cu trong X lần lượt là a ; b ; c => nX = a + b + c = 3a (= 3nFeO) => 2a – b – c = 0 (1) - Ta có : mX = mFeO + mFe3O4 + mCu => 72a + 232b + 64c = 16,4g (2) - Khi X + HCl : Bảo toàn H : nH2O.2 = nHCl = 2x => Bảo toàn khối lượng : mX + mHCl = mmuối + mH2O => 16,4 + 36,5.2x = 29,6 + 18x => x = 0,24 mol Bảo toàn nguyên tố oxi : nO(X) = nO(H2O) => a + 4b = 0,24 (3) => nHCl (TN2) = 2nH2O = 0,48 mol Từ (1,2,3) => a = 0,04 ; b = 0,05 ; c = 0,03 mol - Thí nghiệm 1 có : nNO = 0,896 : 22,4 = 0,04 mol => Công thức tính nhanh : nHCl = 4nNO + 2nO(X) = 0,64 mol => nHCl tổng = 0,64 + 0,48 = 1,12 mol - Trộn dung dịch Y và dung dịch Z để phản ứng với AgNO3 dư => Qui đổi về thành quá trình sau : \(\left. \begin{gathered}F{{\text{e}}_{0,38}} \hfill \\C{u_{0,06}} \hfill \\{O_{0,48}} \hfill \\ \end{gathered} \right\} + \left\{ \begin{gathered}NaN{{\text{O}}_3} \hfill \\HC{l_{1,12}} \hfill \\AgN{O_3} \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}F{{\text{e}}^{3 + }} \hfill \\C{u^{2 + }} \hfill \\\end{gathered} \right. + \left\{ \begin{gathered}Ag \hfill \\AgCl \hfill \\\end{gathered} \right. + N{O_{0,04}} + {H_2}O\) (Trong đó : nFe = nFeO + 3nFe3O4 ; nO = nFeO + 4nFe3O4) (Số mol X gấp đôi vì gộp cả 2 thí nghiệm) - Bảo toàn electron : 3nFe + 2nCu = nAg + 2nO + 3nNO => nAg = 0,18 mol Lại có : nAgCl = nHCl = 1,12 mol (Bảo toàn nguyên tố Cl) => mkết tủa = mAg + mAgCl = 180,16g (Gần nhất với giá trị 180,15)
Câu 38 :
Tiến hành thí nghiệm của 1 vài vật liệu polime với dung dịch kiềm theo các bước sau đây : - Bước 1 : Lấy 4 ống nghiệm đựng lần lượt các chất PE, PVC , sợi len, xenlulozo theo thứ tự 1,2,3,4 - Bước 2 : Cho vào mỗi ống nghiệm 2 ml dung dịch NaOH 10% đun sôi, để nguội - Bước 3 : Gạt lấy lớp nước ở mỗi ống nghiệm ta được tương ứng là các ống nghiệm 1’,2’,3’,4’ - Bước 4 : Thêm HNO3 và vài giọt AgNO3 vào ống nghiệm 1’,2’. Thêm vài giọt CuSO4 vào ống 3’,4’. Phát biểu nào sau đây sai :
Đáp án : B Lời giải chi tiết :
- PE (-CH2-CH2-)n không phản ứng với NaOH và AgNO3 - PVC (-CH2-CHCl-)n + nNaOH → (CH2-CHOH-)n + NaCl Khi gạt lấy lớp nước thì cũng bao gồm các chất tan trong nước => không còn NaCl => không có phản ứng với AgNO3/HNO3 => không thể có kết tủa trắng - Sợi len nếu làm từ hữu cơ (polypeptit) thì sẽ phản ứng với Cu(OH)2/OH- tạo màu tím đặc trưng CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 - Xenlulozo không phản ứng với NaOH, khi thêm CuSO4 vào thì xuất hiện màu xanh của CuSO4.
Câu 39 :
Đốt cháy X cũng như Y với lượng oxi vừa đủ luôn thu được CO2 có số mol bằng số mol O2 đã phản ứng. Biết rằng X, Y (MX < MY) là 2 este đều mạch hở không phân nhánh và không chứa nhóm chức khác . Đun nóng 30,24g hỗn hợp E chứa X, Y (số mol của X gấp 1,5 lần số mol Y) cần dùng 400 ml dung dịch KOH 1M, thu được hỗn hợp F chứa 2 ancol và hỗn hợp chứa 2 muối. Dẫn toàn bộ F qua bình dựng Na dư thấy khối lượng bình tăng 15,2g. Đốt cháy hoàn toàn hỗn hợp muối cần dùng 0,42 mol O2. Tổng số nguyên tử có trong 1 phân tử Y là :
Đáp án : A Phương pháp giải :
- Tìm công thức của 2 ancol thông quá phương pháp trung bình - Biện luận tìm công thức cấu tạo của 2 muối (Bảo toàn khối lượng, Bảo toàn nguyên tố) Lời giải chi tiết :
Phản ứng este tổng quát : R(COO)nR’ + nKOH → R(COOK)n + R’(OH)n - Xét thí nghiệm với bình F : - Có : nKOH = 0,4.1 = 0,4 mol => nOH(ancol/F) = nKOH = 0,4 mol => nH2 = 0,2 mol ( R’(OH)n + nNa → R’(ONa)n + 0,5nH2 ) Bảo toàn khối lượng : mF = mbình tăng + mH2 = 15,6g (mbình tăng = mancol – mH2) - Bảo toàn khối lượng : mE + mKOH = mmuối + mancol(F) => mmuối = 30,24 + 56.0,4 – 15,6 = 37,04g Gọi công thức tổng quát chung của các muối có dạng : CxHyKzO2z => nmuối = nKOH/z = 0,4/z (mol) (Bảo toàn nguyên tố K) Phản ứng cháy : CxHyKzO2z + (2x + 0,5y – 1,5z)O2 → (2x – z)CO2 + yH2O + zK2CO3 Với nZ = 0,4/z => nO2 = 0,1.(4x + y – 3z)/z = 0,42 mol => 4x + y = 7,2z (1) Ta có : mZ = (12x + t + 71z).0,4/z = 37,04 => 12x + y = 21,6z (2) Lấy (1) – (2) => y = 0 => cả 2 muối đều không có Hidro => Muối tạo từ X là KOOC-Cn-COOK (a mol) Và Muối tạo từ Y là KOOC-Cm-COOK (b mol) => nKOH = 2a + 2b = 0,4 và a = 1,5b (Vì số mol X gấp 1,5 lần số mol Y) => a = 0,12 ; b = 0,08 mol => mmuối = 0,12(12n + 166) + 0,08(12m + 166) = 37,04 => 3n + 2m = 8 (3) - Biện luận : Este mạch hở nên cả 2 ancol đều đơn chứC. Đốt este có nCO2 = nO2, mà este 2 chức nên cả 2 este đều có 8H, các gốc axit không có H nên tổng số H trong 2 gốc ancol của mỗi este là 8 Mặt khác nF = 0,4 mol => MF = 39 (MTB) => 2 ancol là CH3OH và C2H5OH - Do MX < MY nên từ (3) => n = 0 và m = 4 là nghiệm duy nhất thỏa mãn => X là CH3OOC-COOC2H5 và Y là CH3OOC-C≡C-C≡C-COOC2H5 => Y là C9H8O4 có 21 nguyên tử
Câu 40 :
Điện phân V lit dung dịch X (điện cực trơ, màng ngăn xốp , cường độ dòng điện không đổi) chứa đồng thời R(NO3)2 0,45M (R là kim loại có hóa trị không đổi) và NaCl 0,4M trong thời gian t(giây) thu được 5,376 lit hỗn hợp khí ở anot (dktc). Nếu thời gian điện phân là 2t (giây) thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 320 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa . Biết hiệu suất điện phân 100%. Các khí sinh ra không tan trong dung dịch. Giá trị của V là :
Đáp án : B Phương pháp giải :
- Biện luận 2 trường hợp : +) R2+ chưa bị điện phân hoàn toàn +) R2+ đã bị điện phân hết, H2O đã bị điện phân ở catot (Bảo toàn electron : ne trao đổi) Lời giải chi tiết :
Do Y có phản ứng với kiềm nên Y là không phải là K-Na-Ca-Ba => R2+ có thể bị điện phân - Các quá trình có thể xảy ra ở các điện cực : +) Anot : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e +) Catot : R2+ + 2e → R 2H2O + 2e → 2OH- + H2 - nR(NO3)2 = 0,45V và nNaCl = 0,4V mol ; nkhí (Anot) = 5,376 : 22,4 = 0,24 mol - Phản ứng điện phân tổng quát chung : R(NO3)2 + 2NaCl → R + Cl2 + 2NaNO3 (1) => nCl2 = ½ nNaCl = 0,2V => nO2 = 0,24 – 0,2V - Trong t giây : ne tđ = 2nCl2 + 4nO2 = 0,96 – 0,4V => Trong t giây tiếp theo anot sinh ra nO2 = 0,25ne = 0,24 – 0,1V => nO2 tổng = (0,24 – 0,2V) + (0,24 – 0,1V) = 0,48 – 0,3V - Có : nOH = nKOH + nNaOH = 0,32.0,75 + 0,32.0,5 = 0,4 mol => Ta xét 2 trường hợp +) TH1 : Trong 2t giây R2+ vẫn chưa bị điện phân hết => chưa điện phân nước ở catot => 2nR2+ < ne tđ => 0,45V.2 < (0,96 – 0,4V).2 => V < 1,129 - nR2+ dư = 0,96 – 0,4V – 0,45V = 0,96 – 0,85V Lúc này nH+ = 4nO2 tổng = 4.(0,48 – 0,3V) Thêm kiềm vào không có kết tủa chứng tỏ R(OH)2 lưỡng tính đã tan trở lại R2+ + 2OH- → R(OH)2 R(OH)2 + 2OH- → RO22- + 2H2O => nOH = nH+ + 4nR2+ dư => 0,4 = 4.(0,48 – 0,3V) + 4.(0,96 – 0,85V) => V = 1,165 (Loại) +) TH2 : Trong 2t giây R2+ đã bị điện phân hết, H2O đã bị điện phân ở catot : Sau (1) còn : nR2+ = 0,45V – 0,2V = 0,25V => Khi điện phân hết R2+ thì nH+ = 0,25V.2 = 0,5V => nH+ = nOH- = 0,4 = 0,5V => V = 0,8 lit |