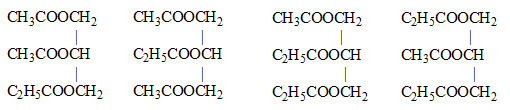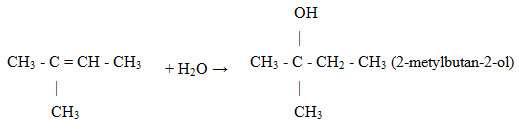Đề thi THPT QG môn Hóa trường THPT chuyên KHTN lần 3Đề bài
Câu 1 :
Tơ capron thuộc loại
Câu 2 :
Điện phân dung dịch X chứa đồng thời 0,1 mol FeCl3 và 0,1 mol CuCl2 (điện cực trơ, màng ngăn xốp) một thời gian thì dừng lại, thấy catot tăng 3,584 gam (toàn bộ kim loại giải phóng bám trên catot). Khối lượng dung dịch X sau khi điện phân giảm là
Câu 3 :
Tiến hành các thí nghiệm sau: (1) Lên men giấm ancol etylic thu được chất hữu cơ X (2) Hidrat hóa etilen thu được hợp chất hữu cơ Y (3) Z là sản phẩm hữu cơ thu được khi cho X tác dụng với Y (H2SO4 đặc, đun nóng) (4) Hợp chất hữu cơ T là sản phẩm của axetilen tác dụng với nước (dung dịch HgSO4, 800C) Thứ tự tăng dần về nhiệt độ sôi của các chất X,Y, Z, T là
Câu 4 :
Cho m gam kim loại kiềm vào nước thu được 500 ml dung dịch A và 1,12 lít khí H2(đktc). Nồng độ mol/lít của dung dịch A là
Câu 5 :
Cho dãy các chất sau: glucozo, poli(vinyl axetat), saccarozo, glixerol, lysin, phenol, triolein, Gly-Gly-Ala. Số chất tác dụng với dung dịch NaOH là
Câu 6 :
Cho các phát biểu sau: (1) Xenlulozo là chất rắn dạng sợi, màu trắng, tan trong nước Svayde (2) Ở điều kiện thường, etyl axetat là chất lỏng, tan vô hạn trong nước. (3) Gly- Val và Gly - Ala-Gly đều có phản ứng màu biure. (4) Ancol etylic có nhiệt độ sôi cao hơn axit fomic (5) Dung dịch saccarozo hòa tan Cu(OH)2 cho dung dịch màu tím Có bao nhiêu phát biểu đúng?
Câu 7 :
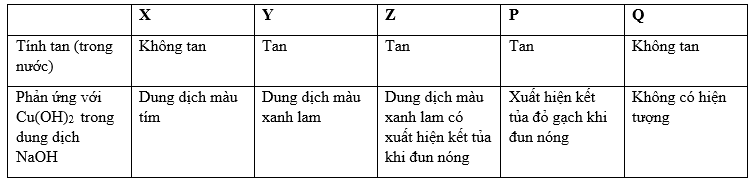
Cho bảng sau:
Các chất X,Y,Z,P,Q lần lượt là
Câu 8 :
Khi cho X (C3H6O2) tác dụng với NaOH, đun nóng thu được CH3COONa. Tên gọi của X là
Câu 9 :
Có 6 lọ mất nhãn đựng các dụng dịch: KNO3, Cu(NO3)2, FeCl3, FeCl2, AlCl3, NH4Cl. Có thể dùng hóa chất nào sau đây để nhận biết các dung dịch trên?
Câu 10 :
Nung hỗn hợp muối cacbonat của hai kim loại liên tiếp trong nhóm IIA tới khối lượng không đổi thu được 1,12 lít khí CO2(đktc) và 2,32 gam hỗn hợp 2 oxit. Hai kim loại là
Câu 11 :
Dãy các chất điện li mạnh?
Câu 12 :
Phương trình phản ứng nào sau đây không đúng?
Câu 13 :
Cho các chất m- HOC6H4OH, p-CH3COOC6H4OH, CH3CH2COOH, (CH3NH3)2CO3, o-CH3C6H4OH, CH2(Cl)COOC2H5, HOOC-CH2-CH(NH2)-COOH, ClH3N-CH(CH3)COOH. Số chất phản ứng với dung dịch NaOH theo tỉ lệ mol 1:2 là
Câu 14 :
Công thức hóa học của tristearin là
Câu 15 :
Kim loại nào sau đây có độ cứng cao nhất?
Câu 16 :
Nhỏ dung dịch Ba(OH)2 dư vào dung dịch chứa m gam hỗn hợp gồm NH4HCO3 và (NH4)2CO3, đun nóng, thu được 1,12 lít khí NH3(đktc) và 5,91 gam kết tủa.Giá trị của m là
Câu 17 :
Cho 300 ml dung dịch Ba(OH)2 0,1M vào 400 ml dung dịch NaHCO3 0,1M thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
Câu 18 :
Cho các phát biểu sau: (a) Xenlulozo là polime thiên nhiên và là nguyên liệu để sản xuất các tơ tổng hợp (b) Cho nhúm bông vào dung dịch H2SO4 70%, đun nóng thu được dung dịch trong suốt; (c) Trong công nghiệp dược phẩm, saccarozo được dùng để pha chế thuốc; (d) Ở điều kiện thường, glucozo, fructozo và saccarozo đều tan tốt trong nước; (e) Amilozo trong tinh bột chứa liên kết α - 1,4- glicozit và α - 1,6- glicozit; (f) Glucozo và fructozo đều bị khử bởi khí H2 (xúc tác Ni, đun nóng); Số phát biểu đúng là
Câu 19 :
X, Y, Z, T là các chất khác nhau trong số các chất sau: NH3, C6H5NH2, CH3NH2, CH2(NH2)COOH. Biết X, Z là chất khí ở điều kiện thường, lực bazo của X mạnh hơn Z Y, T không làm đổi màu quỳ tím, T phản ứng được với ancolPhát biểu nào sau đây đúng?
Câu 20 :
Cho hình vẽ mô tả thí nghiệm điều chế Y từ dung dịch X.
X có thể chứa
Câu 21 :
Khi cho H3PO4 tác dụng với NaOH tỉ lệ số mol 1:2. Muối thu được là
Câu 22 :
Một dung dịch A chứa 0,01 mol K+, 0,02 mol HCO3-, 0,02 mol Mg2+ và x mol SO42-. Khối lượng muối khan thu được khi cô cạn dung dịch là
Câu 23 :
Cho 5 gam Mg vào 100 ml dung dịch AgNO3 2M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
Câu 24 :
Hỗn hợp tecmit dùng để hàn những chỗ vỡ, mẻ của đường tàu hỏa là
Câu 25 :
Chất hữu cơ mạch hở X có công thức C8H15O4N. Cho m gam X tác dụng với lượng dư NaOH thu được (m +1) gam muối aminoaxit và hỗn hợp Y gồm hai ancol. Tính giá trị của m
Câu 26 :
Đốt cháy hoàn toàn một hỗn hợp X: axit axetic, andehit fomic, glucozo và fructozo cần 3,36 lít O2(đktc). Hấp thụ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Khối lượng dung dịch Ca(OH)2 thay đổi như thế nào?
Câu 27 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2. (b) Cho dung dịch KHSO4 vào dung dịch BaCl2 (c) Cho dung dịch Na2S vào dung dịch Fe2(SO4)3. (d) Sục khí CO2 tới dư vào dung dịch NaAlO2. (e) Cho kim loại Zn vào lượng dư dung dịch FeCl3. (f) Sục khí SO2 vào lượng dư dung dịch Ba(OH)2. (g) Sục khí NH3 dư vào dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
Câu 28 :
Nhỏ dung dịch NH3 dư vào dung dịch chứa AlCl3, FeCl2 và CuCl2 thu được kết tủa X. Nung X trong không khí đến phản ứng hoàn toàn được chất rắn Y. Y là
Câu 29 :
Đun nóng glixerol với hỗn hợp CH3COOH, C2H5COOH, trong H2SO4 đặc.Số loại tri este có chứa cả 2 gốc axit là
Câu 30 :
Đốt cháy hoàn toàn một amin no, đơn chức, mạch hở thu được 4,48 lít CO2 và 4,95 gam nước. CÔng thức phân tử của amin X là:
Câu 31 :
Axit glutamic là một chất dẫn truyền thần kinh, giúp kích thích thần kinh. Axit glutamic giúp phòng ngừa và điều trị các triệu chứng suy nhược thần kinh do thiếu hụt axit glutamic như mất ngủ, nhức đầu, ù tai, chóng mặt... Phát biểu đúng về axit glutamic?
Câu 32 :
X là một α-amino axit no, phân tử chỉ chứa 1 nhóm amino và 1 nhóm cacboxyl. Cho 13,35 gam X tác dụng với dung dịch HCl dư thu được 18,825 gam muối. X là
Câu 33 :
Một số người lạm dụng bóng cười làm ảnh hưởng xấu đến sức khỏe và hệ thần kinh, khí trong bóng cười là
Câu 34 :
Hidrat hóa 2-metylbut-2-en (ở điều kiện xúc tác và nhiệt độ thích hợp) thu được sản phẩm chính là
Câu 35 :
Những nhận định sau về kim loại sắt: (1) Kim loại sắt có tính khử trung bình. (2) Ion Fe2+ bền hơn Fe3+. (3) Fe bị thụ động trong H2SO4 đặc nguội. (4) Quặng manhetit là quặng có hàm lượng sắt cao nhất. (5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính. (6) Kim loại sắt có thể khử được ion Fe3+. Số nhận định đúng là
Câu 36 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Al, Zn trong 500 ml dung dịch HNO3 4M, sau phản ứng hoàn toàn thu được dung dịch Y và 4,48 lít (đktc) hỗn hợp gồm hai khí không màu có tỉ khối so với H2 là 18,5 trong đó có 1 khí hóa nâu ngoài không khí. Trung hòa dung dịch Y bằng lượng vừa đủ 100 ml dung dịch NaOH 1M, thu được dung dịch Z. Cô cạn Z, thu được 134,5 gam muối khan. Giá trị của m là
Câu 37 :
Thủy phân hoàn toàn m gam hỗn hợp A gồm tetrapeptit X và pentapeptit Y (đều mạch hở) bằng dung dịch KOH vừa đủ, sau phản ứng cô cạn cẩn thận thì thu được (m + 11,42) gam hỗn hợp muối khan vủa Val và Ala. Đốt cháy hoàn toàn muối sinh ra bằng một lượng oxi vừa đủ thu được K2CO3; 2,464 lít N2 (đktc) và 50,96 gam hỗn hợp CO2 và nước. Phần trăm khối lượng của Y trong hỗn hợp A là
Câu 38 :
Este X được tạo từ một axit cacboxylic hai chức và hai ancol đơn chức. Đốt cháy hoàn toàn X luôn thu được CO2 có số mol bằng O2 phản ứng. Cho 1 mol X phản ứng vừa hết 2 mol H2 (xúc tác Ni, to) thu được chất Y. Cho 1 mol chất Y tác dụng với 2 mol NaOH thu được 3 chất A, B, C trong đó B và C là đồng đẳng kế tiếp và khi đun nóng B với H2SO4 đặc ở 170oC không thu được anken. Cho các nhận định: (1) Chất X có CTPT là C7H8O4. (2) Chất A có CTPT là C4H2O4Na. (3) Chất C là ancol etylic. (4) Hai chất X và Y đều có mạch không phân nhánh. Số nhận định đúng là
Câu 39 :
Đốt cháy hoàn toàn m gam hỗn hợp gồm glyxin, anlanin, amoni acrylat và etylamin bằng lượng oxi vừa đủ. Sản phẩm cháy hấp thụ vào dung dịch Ba(OH)2 dư thu được 41,37 gam kết tủa, khối lượng dung dịch Ba(OH)2 giảm 26,82 gam và 1,008 lít khí (đktc) không bị hấp thụ. Giá trị của m là
Câu 40 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba và Al2O3 vào nước được dung dịch Y. Nhỏ từ từ V lít dung dịch H2SO4 0,3M vào Y. Đồ thị mô tả sự phụ thuộc giữa khối lượng kết tủa vào V như sau:
Giá trị của m là
Lời giải và đáp án
Câu 1 :
Tơ capron thuộc loại
Đáp án : C Phương pháp giải :
Dựa vào kiến thức học về polime sgk hóa 12 Lời giải chi tiết :
Tơ capron thuộc loại tơ poliamit được tổng hợp từ axit-↋-aminocaproic nH2N[CH2]5COOH \(\xrightarrow{{{t^0},p,xt}}\)(-NH[CH2]5CO)-n + nH2O axit-↋-aminocaproic nilong-6 ( tơ capron)
Câu 2 :
Điện phân dung dịch X chứa đồng thời 0,1 mol FeCl3 và 0,1 mol CuCl2 (điện cực trơ, màng ngăn xốp) một thời gian thì dừng lại, thấy catot tăng 3,584 gam (toàn bộ kim loại giải phóng bám trên catot). Khối lượng dung dịch X sau khi điện phân giảm là
Đáp án : D Phương pháp giải :
Thứ tự điện phân tại catot: Fe3+, Cu2+, Fe Điện phân tại anot: Cl- Xác định xem tại catot chất nào điện phân hết, sau đó viết quá trình nhường, nhận e. Dùng bảo toàn e mdd giảm = mKL sinh ra + mCl2 bay lên Lời giải chi tiết :
mcatot tăng = mKL bám vào = 3,584 < mCu = 0,1.64 = 6,4 → Cu chưa điện phân hết → mcatot tăng = mCu sinh ra = 3,584 (g) → nCu sinh ra = 0,056 (mol) Tại catot xảy ra pư theo thứ tự: Fe3+ +1e → Fe2+ 0,1 → 0,1 (mol) Cu2+ + 2e → Cu 0,112 ← 0,056 (mol) Tổng mol e nhường = 0,1 + 0,112 = 0,212 = nCl- nhận Tại anot xảy ra quá trình: 2Cl- → Cl2 + 2e 0,106 ← 0,212 (mol) → Khối lượng dd giảm = mCu sinh ra + mCl2↑ = 3,584 + 0,106.71 = 11,11 (g)
Câu 3 :
Tiến hành các thí nghiệm sau: (1) Lên men giấm ancol etylic thu được chất hữu cơ X (2) Hidrat hóa etilen thu được hợp chất hữu cơ Y (3) Z là sản phẩm hữu cơ thu được khi cho X tác dụng với Y (H2SO4 đặc, đun nóng) (4) Hợp chất hữu cơ T là sản phẩm của axetilen tác dụng với nước (dung dịch HgSO4, 800C) Thứ tự tăng dần về nhiệt độ sôi của các chất X,Y, Z, T là
Đáp án : B Phương pháp giải :
Cùng phân tử khối phân tử có liên kết hidro càng mạnh thì nhiệt độ sôi càng cao Phân tử khối tăng thì nhiệt độ sôi tăng theo Tóm gọn: Nhiệt độ sôi: axit > ancol> amin > este > xeton > andehit > ete > dẫn xuất halogen > CxHy Đồng phân cis có nhiệt độ sôi cao hơn trans Lời giải chi tiết :
(1) C2H5OH + O2 \(\buildrel {men\,giấm} \over\longrightarrow \) CH3COOH(X) + CO2↑ (2) C2H4 + H2O → C2H5OH (Y) (3) CH3COOH(X) + C2H5OH (Y) \(\buildrel {{H_2}S{O_4}\,đặc,{t^0}} \over\longrightarrow \) CH3COOC2H5 (Z) + H2O (4) C2H2 + H2O \(\buildrel {HgS{O_4},{{80}^0}C} \over\longrightarrow \) CH3CHO (T) Nhiệt độ sôi: CH3CHO(T) < CH3COOC2H5 (Z) < C2H5OH (Y) < CH3COOH(X)
Câu 4 :
Cho m gam kim loại kiềm vào nước thu được 500 ml dung dịch A và 1,12 lít khí H2(đktc). Nồng độ mol/lít của dung dịch A là
Đáp án : A Phương pháp giải :
Đặt kim loại kiềm là M PTHH: 2M + 2H2O → 2MOH + H2↑ → nMOH = 2nH2 =? → CM = nMOH : V =? Lời giải chi tiết :
nH2(đktc) = 1,12 :22,4 = 0,05 (mol) Đặt kim loại kiềm là M 2M + 2H2O → 2MOH + H2↑ 0,1 ← 0,05 (mol) → nMOH = 2nH2 = 2.0,05 = 0,1 (mol) → CM MOH = n:V = 0,1 : 0,5 = 0,2 (M)
Câu 5 :
Cho dãy các chất sau: glucozo, poli(vinyl axetat), saccarozo, glixerol, lysin, phenol, triolein, Gly-Gly-Ala. Số chất tác dụng với dung dịch NaOH là
Đáp án : D Phương pháp giải :
Các chất tác dụng được với dd NaOH là: polime; các chất có nhóm -NH2; este, peptit Lời giải chi tiết :
Các chất tác dụng được với dd NaOH là: poli(vinyl axetat), lysin, phenol, triolein, Gly-Gly-Ala → có 5 chất
Câu 6 :
Cho các phát biểu sau: (1) Xenlulozo là chất rắn dạng sợi, màu trắng, tan trong nước Svayde (2) Ở điều kiện thường, etyl axetat là chất lỏng, tan vô hạn trong nước. (3) Gly- Val và Gly - Ala-Gly đều có phản ứng màu biure. (4) Ancol etylic có nhiệt độ sôi cao hơn axit fomic (5) Dung dịch saccarozo hòa tan Cu(OH)2 cho dung dịch màu tím Có bao nhiêu phát biểu đúng?
Đáp án : A Phương pháp giải :
Xem lại lý thuyết về este, cacbohidrat, ancol và peptit Lời giải chi tiết :
(1) đúng (2) sai, etyl axetat ít tan trong nước (3) sai, Gly- Val là đipeptit nên không có phản ứng màu biure (4) sai, C2H5OH có nhiệt độ sôi thấp hơn HCOOH vì HCOOH có liên kết hidro mạnh hơn (5) sai, dd saccarozo hòa tan Cu(OH)2 cho dung dịch màu xanh. → có 1 phát biểu đúng
Câu 7 :
Cho bảng sau:
Các chất X,Y,Z,P,Q lần lượt là
Đáp án : A Phương pháp giải :
X không tan trong nước và có phản ứng màu với dd Cu(OH)2/OH- tạo màu tím → X là protein Y tan trong nước tạo và tạo dd màu xanh lam với Cu(OH)2/OH- → Y có nhiều nhóm -OH kề nhau trong phân tử Z phải có chứa nhiều nhóm -OH kề nhau và có nhóm -CHO trong phân tử T chỉ chứa nhóm -CHO trong phân tử Lời giải chi tiết :
X không tan trong nước và có phản ứng màu với dd Cu(OH)2/OH- tạo màu tím → X là protein Y tan trong nước tạo và tạo dd màu xanh lam với Cu(OH)2/OH- → Y có nhiều nhóm -OH kề nhau trong phân tử → Y là saccarozo Z phải có chứa nhiều nhóm -OH kề nhau và có nhóm -CHO trong phân tử → Z là glucozo T chỉ chứa nhóm -CHO trong phân tử → T là andehit axetic Q không tan và cũng không có hiện tượng gì với Cu(OH)2/OH- → Q là tristearin.
Câu 8 :
Khi cho X (C3H6O2) tác dụng với NaOH, đun nóng thu được CH3COONa. Tên gọi của X là
Đáp án : B Phương pháp giải :
Tên este RCOOR' = tên gốc R' (đuôi yl) + tên gốc RCOO (đuôi at) Lời giải chi tiết :
X là CH3COOCH3: metyl axetat CH3COOCH3 + NaOH → CH3COONa + CH3OH
Câu 9 :
Có 6 lọ mất nhãn đựng các dụng dịch: KNO3, Cu(NO3)2, FeCl3, FeCl2, AlCl3, NH4Cl. Có thể dùng hóa chất nào sau đây để nhận biết các dung dịch trên?
Đáp án : C Phương pháp giải :
Ta thấy các dung dịch trên đều là các muối có cùng anion là NO3- và Cl- còn các gốc kim loại khác nhau → chọn thuốc thử là dd kiềm để phân biệt được các cation kim loại. Lời giải chi tiết :
Câu 10 :
Nung hỗn hợp muối cacbonat của hai kim loại liên tiếp trong nhóm IIA tới khối lượng không đổi thu được 1,12 lít khí CO2(đktc) và 2,32 gam hỗn hợp 2 oxit. Hai kim loại là
Đáp án : A Phương pháp giải :
Đặt công thức chung của 2 muối là MCO3 nMO = nCO2 = ? → Phân tử khối trung bình của MO, từ đó suy ra được 2 kl kiềm thổ Lời giải chi tiết :
Đặt công thức chung của 2 muối là MCO3 nCO2(đktc) = 1,12:22,4 = 0,05 (mol) PTHH: MCO3 \(\buildrel {{t^0}} \over\longrightarrow \) MO + CO2↑ 0,05 ← 0,05 (mol) nMO = nCO2 = 0,05 (mol) → MMO = 2,32 : 0,05 = 46,4 (g/mol) Ta có: M + 16 = 46,4 → M = 30,4 (g/mol) Vì hai kim loại IIA liên tiếp nên 2 kim loại là Mg và Ca
Câu 11 :
Dãy các chất điện li mạnh?
Đáp án : A Phương pháp giải :
Các chất điện li mạnh là các axit mạnh, bazo mạnh, các muối Lời giải chi tiết :
A. Đúng B,C Loại CH3COOH là chất điện li yếu D. Loại H2S là chất điện li yếu
Câu 12 :
Phương trình phản ứng nào sau đây không đúng?
Đáp án : C Phương pháp giải :
điều kiện phản ứng trao đổi xảy ra: tạo thành chất kết tủa, bay hơi hoặc chất điện li yếu các chất phản ứng với H2SO4 đặc, nóng hoặc HNO3 đặc sẽ bị oxi hóa lên số oxi hóa cao nhất dựa vào quy tắc anpha khi 2 muối phản ứng với nhau để biết được phản ứng có xảy ra hay không Lời giải chi tiết :
C. sai, sửa lại 2FeCO3 + 4H2SO4(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) Fe2(SO4)3 + 2CO2↑ + SO2↑ + 4H2O
Câu 13 :
Cho các chất m- HOC6H4OH, p-CH3COOC6H4OH, CH3CH2COOH, (CH3NH3)2CO3, o-CH3C6H4OH, CH2(Cl)COOC2H5, HOOC-CH2-CH(NH2)-COOH, ClH3N-CH(CH3)COOH. Số chất phản ứng với dung dịch NaOH theo tỉ lệ mol 1:2 là
Đáp án : C Phương pháp giải :
Các trung tâm phản ứng được với NaOH: este (-COO); axit (-COOH); dẫn xuất halogen; -OH đính vòng của benzen; muối amin hoặc NH3 Các chất tác dụng được với dd NaOH theo tỉ lệ 1: 2 + Có 2 trung tâm tham gia phản ứng với NaOH hoặc este của phenol có dạng RCOOC6H4R' Lời giải chi tiết :
Các chất phản ứng được với NaOH theo tỉ lệ 1: 2 là: m- HOC6H4OH; (CH3NH3)2CO3; CH2(Cl)COOC2H5; HOOC-CH2-CH(NH2)-COOH, ClH3N-CH(CH3)COOH. → có 5 chất m- HOC6H4OH + 2NaOH → m-NaOC6H4ONa + 2H2O (CH3NH3)2CO3 + 2NaOH → Na2CO3 + 2NH3 + 2H2O CH2(Cl)COOC2H5 + 2NaOH → CH2(OH)COONa + C2H5OH + NaCl HOOC-CH2-CH(NH2)-COOH + 2NaOH → NaOOC-CH2-CH(NH2)-COONa + H2O ClH3N-CH(CH3)COOH + 2NaOH → H2N-CH(CH3)COONa + NaCl + 2H2O
Câu 14 :
Công thức hóa học của tristearin là
Đáp án : D Phương pháp giải :
Học thuộc tên các chất béo hay gặp Lời giải chi tiết :
A. (C15H31COO)3C3H5 - tripanmitin B. (C17H31COO)3C3H5 - trilinolein. C. (C17H33COO)3C3H5 - triolein. D. (C17H35COO)3C3H5 - tristearin
Câu 15 :
Kim loại nào sau đây có độ cứng cao nhất?
Đáp án : A Phương pháp giải :
Dựa vào tính chất vật lí chung của kim loại Lời giải chi tiết :
Cr là kim loại có độ cứng nhất,có thể rạch được cả thủy tinh
Câu 16 :
Nhỏ dung dịch Ba(OH)2 dư vào dung dịch chứa m gam hỗn hợp gồm NH4HCO3 và (NH4)2CO3, đun nóng, thu được 1,12 lít khí NH3(đktc) và 5,91 gam kết tủa.Giá trị của m là
Đáp án : A Phương pháp giải :
Ba(OH)2 + NH4HCO3 → BaCO3↓ + NH3↑+ 2H2O x → x → x (mol) Ba(OH)2 + (NH4)2CO3 → BaCO3↓ + 2NH3↑+ 2H2O y → y → 2y (mol) Ta có hệ phương trình:\(\left\{ \matrix{{n_{BaC{O_3}}} = x + y = 0,03 \hfill \cr {n_{N{H_3}}} = x + 2y = 0,05 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = ?\,(mol) \hfill \cr y = ?\,(mol) \hfill \cr} \right. \to m = ?\) Lời giải chi tiết :
nNH3(đktc) =1,12 :22,4 = 0,05 (mol); nBaCO3 = 5,91:197 = 0,03 (mol) Đặt số mol NH4HCO3 và (NH4)2CO3 lần lượt là x và y (mol) Ba(OH)2 + NH4HCO3 → BaCO3↓ + NH3↑+ 2H2O x → x → x (mol) Ba(OH)2 + (NH4)2CO3 → BaCO3↓ + 2NH3↑+ 2H2O y → y → 2y (mol) Ta có hệ phương trình:\(\left\{ \matrix{{n_{BaC{O_3}}} = x + y = 0,03 \hfill \cr {n_{N{H_3}}} = x + 2y = 0,05 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = 0,01\,(mol) \hfill \cr y = 0,02\,(mol) \hfill \cr} \right.\) → m = mNH4HCO3 + m(NH4)2CO3 = 0,01.79 + 0,02.96 = 2,71 (g)
Câu 17 :
Cho 300 ml dung dịch Ba(OH)2 0,1M vào 400 ml dung dịch NaHCO3 0,1M thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
Đáp án : B Phương pháp giải :
Cho Ba(OH)2 vào dd NaHCO3 có thể xảy ra pư Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO3 + 2H2O (1) Ba(OH)2 + NaHCO3 → BaCO3↓ + NaOH + H2O (2) Ta có: \(1 < {{{n_{NaOH}}} \over {{n_{Ba{{(OH)}_2}}}}} = {{0,04} \over {0,03}} = 1,33 < 2\) . Do vậy xảy ra cả (1) và (2) cả Ba(OH)2 và NaHCO3 đều pư hết Đặt số mol Ba(OH)2 ở (1) và (2) lần lượt là x và y (mol) Ta có hệ pt:\(\left\{ \matrix{{n_{Ba{{(OH)}_2}}} = x + y = 0,03 \hfill \cr {n_{NaHC{O_3}}} = 2x + y = 0,04 \hfill \cr} \right. \Rightarrow \left\{ \matrix{x = ? \hfill \cr y = ? \hfill \cr} \right.\) Vậy dd X chứa Na2CO3: x (mol) và NaOH: y (mol) Cho từ từ dd HCl vào dd X đến khi bắt đầu xuất hiện kết tủa xảy ra pư theo thứ tự HCl + NaOH → NaCl + H2O HCl + Na2CO3 → NaHCO3 + NaCl + H2O → nHCl pư = nNaOH + nNa2CO3 = x + y = ? (mol) Lời giải chi tiết :
nBa(OH)2 = 0,3.0,1= 0,03 (mol) ; nNaHCO3 = 0,4.0,1 = 0,04 (mol) Cho Ba(OH)2 vào dd NaHCO3 có thể xảy ra pư Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO3 + 2H2O (1) x → 2x → x (mol) Ba(OH)2 + NaHCO3 → BaCO3↓ + NaOH + H2O (2) y → y → y (mol) Ta có: \(1 < {{{n_{NaOH}}} \over {{n_{Ba{{(OH)}_2}}}}} = {{0,04} \over {0,03}} = 1,33 < 2\) . Do vậy xảy ra cả (1) và (2) cả Ba(OH)2 và NaHCO3 đều pư hết Đặt số mol Ba(OH)2 ở (1) và (2) lần lượt là x và y (mol) Ta có hệ pt: \(\left\{ \matrix{ Vậy dd X chứa Na2CO3: 0,01 (mol) và NaOH: 0,02 (mol) Cho từ từ dd HCl vào dd X đến khi bắt đầu xuất hiện kết tủa xảy ra pư theo thứ tự HCl + NaOH → NaCl + H2O 0,02← 0,02 (mol) HCl + Na2CO3 → NaHCO3 + NaCl + H2O 0,01 ← 0,01 (mol) →∑ nHCl pư = 0,02 + 0,01 = 0,03 (mol) → VHCl = nHCl : CM = 0,03 : 0,25 = 0,12 (lít) = 120 (ml)
Câu 18 :
Cho các phát biểu sau: (a) Xenlulozo là polime thiên nhiên và là nguyên liệu để sản xuất các tơ tổng hợp (b) Cho nhúm bông vào dung dịch H2SO4 70%, đun nóng thu được dung dịch trong suốt; (c) Trong công nghiệp dược phẩm, saccarozo được dùng để pha chế thuốc; (d) Ở điều kiện thường, glucozo, fructozo và saccarozo đều tan tốt trong nước; (e) Amilozo trong tinh bột chứa liên kết α - 1,4- glicozit và α - 1,6- glicozit; (f) Glucozo và fructozo đều bị khử bởi khí H2 (xúc tác Ni, đun nóng); Số phát biểu đúng là
Đáp án : D Phương pháp giải :
dựa vào kiến thức học về chương 2 - cacbohidart hóa lớp 12 Lời giải chi tiết :
(a) sai, xenlulozo là nguyên liệu để sản xuất các tơ bán tổng hợp (b) sai, vì dung dịch H2SO4 70% có thể coi là đặc, có thể hút nước trong bông tạo thành chất cacbon có màu đen (c) đúng (d) đúng (e) sai, Amilozo trong tinh bột chỉ chứa liên kết α - 1,4- glicozit (f) đúng → có 3 phát biểu đúng
Câu 19 :
X, Y, Z, T là các chất khác nhau trong số các chất sau: NH3, C6H5NH2, CH3NH2, CH2(NH2)COOH. Biết X, Z là chất khí ở điều kiện thường, lực bazo của X mạnh hơn Z Y, T không làm đổi màu quỳ tím, T phản ứng được với ancolPhát biểu nào sau đây đúng?
Đáp án : A Phương pháp giải :
X, Z ở thể khí ở điều kiện thường lực bazo của X mạnh hơn Z => X CH3NH2 còn Z là NH3 T không làm đổi màu quỳ tím và có phản ứng với ancol → T là CH2(NH2)COOH. Từ đó chọn được nhận định đúng hay sai Lời giải chi tiết :
X, Z ở thể khí ở điều kiện thường lực bazo của X mạnh hơn Z => X CH3NH2 còn Z là NH3 T không làm đổi màu quỳ tím và có phản ứng với ancol → T là CH2(NH2)COOH. Y còn lại là C6H5NH2. A. đúng C6H5NH2 + 3Br2 → 2,4,6 tribrom-alanin (kết tủa trắng) + 3HBr B,C, D sai
Câu 20 :
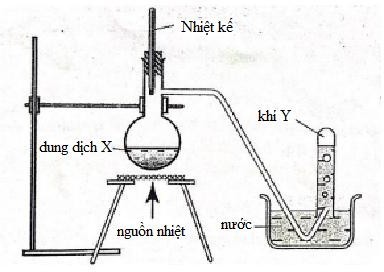
Cho hình vẽ mô tả thí nghiệm điều chế Y từ dung dịch X.
X có thể chứa
Đáp án : D Phương pháp giải :
Khí Y điều chế bằng phương pháp đẩy nước → Y không tan hoặc ít tan trong nước và không có phản ứng với nước → chọn được phương trình điều chế Y thích hợp Lời giải chi tiết :
Khí Y điều chế bằng phương pháp đẩy nước → Y không tan hoặc ít tan trong nước A. 2KMnO4 + 16HCl đặc 2KCl + 2MnCl2 + 5Cl2 + 8H2O → loại vì Cl2 phản ứng với nước. B. Không có pư C. NH4Cl + NaOH → NH3↑ + NaCl + H2O → loại vì NH3 tan nhiều trong nước. D. C2H5OH \(\buildrel {{H_2}S{O_4}\,đặc,{t^0}} \over\longrightarrow \) C2H4 + H2O → chọn vì C2H4 không tan trong nước và không có pư với H2O
Câu 21 :
Khi cho H3PO4 tác dụng với NaOH tỉ lệ số mol 1:2. Muối thu được là
Đáp án : B Phương pháp giải :
Mol NaOH gấp bao nhiêu lần mol H3PO4 thì số nguyên tử H trong H3PO4 cũng mất đi như vậy → Từ đó xác định được công thức muối Lời giải chi tiết :
Muối thu được là Na2HPO4 H3PO4 + 2NaOH → Na2HPO4 + H2O
Câu 22 :
Một dung dịch A chứa 0,01 mol K+, 0,02 mol HCO3-, 0,02 mol Mg2+ và x mol SO42-. Khối lượng muối khan thu được khi cô cạn dung dịch là
Đáp án : C Phương pháp giải :
BTĐT ta có: 1.nK+ + 2.nMg2+ = 1.nHCO3- + 2.nSO42- → nSO42- = ? Khi cô cạn dd A xảy ra phản ứng: 2HCO3- \(\buildrel {{t^0}} \over\longrightarrow \)CO32- + CO2 + H2O Xác định được dd thu được có chứa những ion nào vào bao nhiêu mol → từ đó tính được khối lượng Lời giải chi tiết :
BTĐT ta có: \(1.{{n}_{{{K}^{+}}}}+2.{{n}_{M{{g}^{2+}}}}=1.{{n}_{HCO_{3}^{-}}}+2.{{n}_{SO_{4}^{2-}}}=>{{n}_{SO_{4}^{2-}}}=?\) → 1.0,01 + 2.0,02 = 0,02.1 + 2.x → x = 0,015 (mol) Khi cô cạn dd A xảy ra phản ứng: 2HCO3- \(\buildrel {{t^0}} \over\longrightarrow \)CO32- + CO2 + H2O 0,02 → 0,01 (mol) Vậy dd thu được chứa: Mg2+ dư: 0,02 (mol); K+: 0,01 (mol); SO42-: 0,015 (mol); CO32-: 0,01 (mol) cô cạn thu được mmuối = mMg2+ + mK+ + \(m_{SO_{4}^{2-}} + m_{CO_{3}^{2-}}\) = 0,02.24 + 0,01.39 + 0,015.96 + 0,01.60 = 2,91 (g)
Câu 23 :
Cho 5 gam Mg vào 100 ml dung dịch AgNO3 2M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
Đáp án : C Phương pháp giải :
PTHH: Mg + 2AgNO3 → Mg(NO3)2 + 2Ag↓ Tính toán theo PTHH trên, chất nào phản ứng hết thì tính toán các chất còn lại theo chất đó Lời giải chi tiết :
nAgNO3 = 0,1.2 = 0,2 (mol) PTHH: Mg + 2AgNO3 → Mg(NO3)2 + 2Ag↓ 0,1 ← 0,2 → 0,2 (mol) → mrắn = mAg sinh ra + mMg dư = 0,2.108 + (5-0,1.24) = 24,2 (g)
Câu 24 :
Hỗn hợp tecmit dùng để hàn những chỗ vỡ, mẻ của đường tàu hỏa là
Đáp án : B Phương pháp giải :
Công thức hỗn hợp tecmit được học trong phần ứng dụng của nhôm Lời giải chi tiết :
Hỗn hợp tecmit gồm Al và Fe2O3.
Câu 25 :
Chất hữu cơ mạch hở X có công thức C8H15O4N. Cho m gam X tác dụng với lượng dư NaOH thu được (m +1) gam muối aminoaxit và hỗn hợp Y gồm hai ancol. Tính giá trị của m
Đáp án : B Phương pháp giải :
Đặt công thức của X có dạng R1OOCR(NH2)COOR2 ( giả sử R1 < R2) R1OOCR(NH2)COOR2 + 2NaOH → NaOOCR(NH2)COONa + R1OH + R2OH Vì khối lượng muối thu được sau phản ứng lớn hơn khối lượng của X nên tổng trung bình gốc ancol R1 và R2 phải nhỏ hơn phân tử khối của Na → chắc chắn phải chứa 1 gốc R1 là CH3, biện luận tìm ra được R2 =? Sau đó áp dụng phương pháp tăng giảm khối lượng mtăng = mmuối - mX = mNa - mR1 - mR2 Lời giải chi tiết :
X là este 2 chức của aminoaxit và 2 ancol Đặt công thức của X có dạng R1OOCR(NH2)COOR2 ( giả sử R1 < R2) R1OOCR(NH2)COOR2 + 2NaOH → NaOOCR(NH2)COONa + R1OH + R2OH Vì khối lượng muối thu được sau phản ứng lớn hơn khối lượng của X nên tổng trung bình gốc ancol R1 và R2 phải nhỏ hơn phân tử khối của Na → chắc chắn phải chứa 1 gốc R1 là CH3 Ta có: phân tử khối của 2 gốc ancol: \({{15 + {R_2}} \over 2} < 23 \to {R_2} < 31\) vậy R2 chỉ có thể là C2H5- (29) là thỏa mãn → este có dạng: CH3OOCR(NH2)COOC2H5: a (mol) CH3OOCR(NH2)COOC2H5 + 2NaOH → NaOOCR(NH2)COONa + CH3OH + C2H5OH a → a (mol) áp dụng phương pháp tăng giảm khối lượng ta có: mmuối - mX = mNa - mCH3 - mC2H5 → (m+1) - m = (23.2 - 15 - 29)a → 1 = 2a → a =0,5 (mol) → m = mC8H15O4N = 0,5. 189 = 94,5 (g)
Câu 26 :
Đốt cháy hoàn toàn một hỗn hợp X: axit axetic, andehit fomic, glucozo và fructozo cần 3,36 lít O2(đktc). Hấp thụ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Khối lượng dung dịch Ca(OH)2 thay đổi như thế nào?
Đáp án : C Phương pháp giải :
Hỗn hợp X gồm: C2H4O2; CH2O; C6H12O6; C6H12O6 → tất cả các chất này có công thức chung là (CH2O)n PTHH: (CH2O)n + nO2 → nCO2 + nH2O → nCO2 = nH2O = 0,15 (mol) Khi cho sp cháy vào dd Ca(OH)2 dư có phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O 0,15 → 0,15 (mol) Xét: ∆m = mCO2 + mH2O - mCaCO3 = ? ∆m > 0 thì khối lượng dd tăng; ∆m < 0 thì khối lượng dung dịch giảm Lời giải chi tiết :
Hỗn hợp X gồm: C2H4O2; CH2O; C6H12O6; C6H12O6 → tất cả các chất này có công thức chung là (CH2O)n nO2(đktc) = 3,36 : 22,4 = 0,15 (mol) PTHH: (CH2O)n + nO2 → nCO2 + nH2O 0,15 → 0,15 0,15 (mol) → nCO2 = nH2O = 0,15 (mol) Khi cho sp cháy vào dd Ca(OH)2 dư có phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O 0,15 → 0,15 (mol) Xét: ∆m = mCO2 + mH2O - mCaCO3 = 0,15.44 + 0,15.18 - 0,15.100 = -5,7 Vậy khối lượng dung dịch Ca(OH)2 giảm 5,7 g
Câu 27 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2. (b) Cho dung dịch KHSO4 vào dung dịch BaCl2 (c) Cho dung dịch Na2S vào dung dịch Fe2(SO4)3. (d) Sục khí CO2 tới dư vào dung dịch NaAlO2. (e) Cho kim loại Zn vào lượng dư dung dịch FeCl3. (f) Sục khí SO2 vào lượng dư dung dịch Ba(OH)2. (g) Sục khí NH3 dư vào dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
Đáp án : D Phương pháp giải :
Điều kiện để có phản ứng trao đổi xảy ra: sản phẩm tạo ra chất kết tủa, bay hơi hoặc chất điện li yếu Nhớ quy tắc anpha khi 2 muối tác dụng với nhau Chú ý đến đề bài cho chất nào dư để đoán được sản phẩm tạo thành là chất gì Lời giải chi tiết :
(a) Ba(OH)2 + FeCl2 → Fe(OH)2↓ + BaCl2 (b) 2KHSO4 + BaCl2 → BaSO4↓ + K2SO4 + 2HCl (c) 3Na2S + Fe2(SO4)3 + 6H2O → 2Fe(OH)3↓ + 3Na2SO4 + 3H2S↑ (d) CO2 dư + H2O + NaAlO2 → Al(OH)3↓ + NaHCO3 (e) Zn + 2FeCl3 → ZnCl2 + 2FeCl2 (f) SO2 + Ba(OH)2 dư → BaSO3↓ + H2O (g) 6NH3 dư + CuSO4 + 2H2O → [Cu(NH3)4](OH)2 + (NH4)2SO4 → có 5 thí nghiệm thu được kết tủa là (a), (b), (c), (d), (f)
Câu 28 :
Nhỏ dung dịch NH3 dư vào dung dịch chứa AlCl3, FeCl2 và CuCl2 thu được kết tủa X. Nung X trong không khí đến phản ứng hoàn toàn được chất rắn Y. Y là
Đáp án : B Lời giải chi tiết :
\(N{H_3} + \left\{ \matrix{
Câu 29 :
Đun nóng glixerol với hỗn hợp CH3COOH, C2H5COOH, trong H2SO4 đặc.Số loại tri este có chứa cả 2 gốc axit là
Đáp án : B Phương pháp giải :
Chú ý đến thứ tự vị trí các gốc axit gắn với các gốc ancol để được các CTCT khác nhau Lời giải chi tiết :
Các tri este thu được chứa cả 2 gốc axit là:
→ thu được 4 trieste
Câu 30 :
Đốt cháy hoàn toàn một amin no, đơn chức, mạch hở thu được 4,48 lít CO2 và 4,95 gam nước. CÔng thức phân tử của amin X là:
Đáp án : A Phương pháp giải :
Đặt công thức amin no đơn chức mạch hở là CnH2n+3N: a (mol) CnH2n+3N → nCO2 + (n+1,5)H2O a a a(n+1,5) (mol) \(\begin{gathered}{n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = ?\,(mol) \hfill \\ \to n = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = ? \hfill \\ \end{gathered} \) Lời giải chi tiết :
nCO2(đktc) = 4,48 : 22,4 = 0,2 (mol) nH2O = 4,95 : 18 = 0,275 (mol) Đặt công thức amin no đơn chức mạch hở là CnH2n+3N: a (mol) CnH2n+3N → nCO2 + (n+1,5)H2O a a a(n+1,5) (mol) \(\begin{gathered}{n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = \frac{{0,275 - 0,2}}{{1,5}} = 0,05\,(mol) \hfill \\ \to n = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = \frac{{0,2}}{{0,05}} = 4 \hfill \\ \end{gathered} \) Vậy công thức amin là C4H11N
Câu 31 :
Axit glutamic là một chất dẫn truyền thần kinh, giúp kích thích thần kinh. Axit glutamic giúp phòng ngừa và điều trị các triệu chứng suy nhược thần kinh do thiếu hụt axit glutamic như mất ngủ, nhức đầu, ù tai, chóng mặt... Phát biểu đúng về axit glutamic?
Đáp án : C Lời giải chi tiết :
A sai vì mì chính có thành phần chính là muối mononatri glutamat, không phải axit glutamic B sai vì axit glutamic có M = 147 C đúng vì phân tử axit glutamic có 1 nhóm NH2 D sai vì axit glutamic làm quỳ tím chuyển đỏ
Câu 32 :
X là một α-amino axit no, phân tử chỉ chứa 1 nhóm amino và 1 nhóm cacboxyl. Cho 13,35 gam X tác dụng với dung dịch HCl dư thu được 18,825 gam muối. X là
Đáp án : D Phương pháp giải :
X + HCl → Muối BTKL: mHCl = mmuối - mX = ? => nHCl = ? Do X chứa 1 nhóm NH2 nên ta có: nX = nHCl = ? => MX = mX : nX = ? Lời giải chi tiết :
X + HCl → Muối BTKL: mHCl = mmuối - mX = 18,825 - 13,35 = 5,475 gam => nHCl = 5,475 : 36,5 = 0,15 mol Do X chứa 1 nhóm NH2 nên ta có: nX = nHCl = 0,15 mol => MX = mX : nX = 13,35 : 0,15 = 89 Vậy X là Alanin (CH3CH(NH2)COOH)
Câu 33 :
Một số người lạm dụng bóng cười làm ảnh hưởng xấu đến sức khỏe và hệ thần kinh, khí trong bóng cười là
Đáp án : B Lời giải chi tiết :
Bóng cười chứa khí N2O.
Câu 34 :
Hidrat hóa 2-metylbut-2-en (ở điều kiện xúc tác và nhiệt độ thích hợp) thu được sản phẩm chính là
Đáp án : D Phương pháp giải :
Dựa vào quy tắc cộng Maccopnhicop: Cộng HX vào liên kết đôi C=C thì H sẽ cộng vào nguyên tử C bậc thấp hơn (có ít H hơn) và X sẽ cộng vào nguyên tử C có bậc cao hơn (có nhiều nguyên tử H hơn) Lời giải chi tiết :
Câu 35 :
Những nhận định sau về kim loại sắt: (1) Kim loại sắt có tính khử trung bình. (2) Ion Fe2+ bền hơn Fe3+. (3) Fe bị thụ động trong H2SO4 đặc nguội. (4) Quặng manhetit là quặng có hàm lượng sắt cao nhất. (5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính. (6) Kim loại sắt có thể khử được ion Fe3+. Số nhận định đúng là
Đáp án : B Lời giải chi tiết :
(1) đúng (2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+ (3) đúng (4) đúng, quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất. (5) sai, vì từ trường Trái Đất sinh ra do sự chuyển động của các chất lỏng dẫn điện (6) đúng, Fe + 2Fe3+ → 3Fe2+ Vậy có 4 phát biểu đúng
Câu 36 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Al, Zn trong 500 ml dung dịch HNO3 4M, sau phản ứng hoàn toàn thu được dung dịch Y và 4,48 lít (đktc) hỗn hợp gồm hai khí không màu có tỉ khối so với H2 là 18,5 trong đó có 1 khí hóa nâu ngoài không khí. Trung hòa dung dịch Y bằng lượng vừa đủ 100 ml dung dịch NaOH 1M, thu được dung dịch Z. Cô cạn Z, thu được 134,5 gam muối khan. Giá trị của m là
Đáp án : D Phương pháp giải :
M khí = 37 Khí hóa nâu ngoài không khí là NO (M = 30) => Khí còn lại có M > 37 Vì khí không màu nên khí đó là N2O Lập hệ: n khí = nNO + nN2O và m khí = 30nNO + 44nN2O để tìm số mol mỗi khí Trung hòa dd Y cần vừa đủ 0,1 mol NaOH nên ta có nHNO3 = nNaOH = ? Sơ đồ bài toán: \(m(g)\left\{ \matrix{ + Xét phản ứng của dd Y với NaOH: m ion dd Y = m muối + mH2O - mNaOH = ? + Ta có công thức: nHNO3 = nHNO3 dư + 4nNO + 10nN2O + 10nNH4NO3 => nNH4NO3 = ? + BTNT "N": nHNO3 = nNH4+ + nNO3- + nNO + 2nN2O => nNO3 (dd Y) = ? Ta có: m = mKL = m ion KL = m ion dd Y - mNH4+ - mH+ - mNO3- = ? Lời giải chi tiết :
M khí = 37 Khí hóa nâu ngoài không khí là NO (M = 30) => Khí còn lại có M > 37 Vì khí không màu nên khí đó là N2O Giả sử khí gồm NO (x mol) và N2O (y mol) Giải hệ: n khí = x + y = 0,2 và m khí = 30x + 44y = 0,2.27 được x = y = 0,1 Trung hòa dd Y cần vừa đủ 0,1 mol NaOH nên ta có nHNO3 = nNaOH = 0,1 mol Sơ đồ bài toán: \(m(g)\left\{ \matrix{ + Xét phản ứng của dd Y với NaOH: m ion dd Y = m muối + mH2O - mNaOH = 134,5 + 0,1.18 - 0,1.40 = 132,3 (g) + Ta có công thức: nHNO3 = nHNO3 dư + 4nNO + 10nN2O + 10nNH4NO3 => 2 = 0,1 + 4.0,1 + 10.0,1 + 10nNH4NO3 => nNH4NO3 = 0,05 mol + BTNT "N": nHNO3 = nNH4+ + nNO3- + nNO + 2nN2O => 2 = 0,05 + nNO3- (dd Y) + 0,1 + 2.0,1 => nNO3 (dd Y) = 1,65 mol Ta có: m = mKL = m ion KL = m ion dd Y - mNH4+ - mH+ - mNO3- = 132,3 - 0,05.18 - 0,1 - 1,65.62 = 29 gam
Câu 37 :
Thủy phân hoàn toàn m gam hỗn hợp A gồm tetrapeptit X và pentapeptit Y (đều mạch hở) bằng dung dịch KOH vừa đủ, sau phản ứng cô cạn cẩn thận thì thu được (m + 11,42) gam hỗn hợp muối khan vủa Val và Ala. Đốt cháy hoàn toàn muối sinh ra bằng một lượng oxi vừa đủ thu được K2CO3; 2,464 lít N2 (đktc) và 50,96 gam hỗn hợp CO2 và nước. Phần trăm khối lượng của Y trong hỗn hợp A là
Đáp án : C Phương pháp giải :
Do peptit được cấu tạo từ Val và Ala nên ta quy đổi hỗn hợp thành: CONH, CH2, H2O (với nH2O = n peptit) Bảo toàn nguyên tố, biện luận Lời giải chi tiết :
nN2 = 0,11 mol => nCONH = 2nN2 = 0,22 mol Do peptit được cấu tạo từ Val và Ala nên ta quy đổi hỗn hợp thành: CONH (0,22), CH2 (x), H2O (y) (với nH2O = n peptit) \(m(g)A\left\{ \matrix{ *Xét phản ứng của A và KOH: + mA = mCONH + mCH2 + mH2O => 0,22.43 + 14x + 18y = m (1) + m muối = mCOOK + mNH2 + mCH2 => 0,22.83 + 0,22.16 + 14x = m + 11,42 (2) Lấy (1) - (2) thu được: y = 0,05 => nA = nH2O = 0,05 mol *Xét phản ứng đốt muối: BTNT "C" và "H" tính được số mol CO2 và H2O như sơ đồ. Ta có: mCO2 + mH2O = 50,96 => 44(x + 0,11) + 18(x + 0,22) => x = 0,68 mol *Xét muối: m muối = mCOOK + mNH2 + mCH2 = 0,22.83 + 0,22.16 + 0,68.14 = 31,3 gam Giải hệ: n muối = nVal-K + nAla-K = 0,22 và m muối = 155.nVal-K + 127.nAla-K = 31,3 Được nVal-K = 0,12 mol và nAla-K = 0,1 *Xét A: Giả sử A chứa X (u mol) và Y (v mol). Ta có hệ: nN = 4u + 5v = 0,22 và u + v = nA = 0,05 Giải hệ thu được u = 0,03 và v = 0,02 A gồm ValnAla4-n (0,03) và ValmAla5-m (0,02) (n ≤ 4; m ≤ 5) nAla-K = 0,03n + 0,02m = 0,12 => 3n + 2m = 12 có 2 cặp nghiệm phù hợp là (n = 2; m = 3) và (n=4; m = 0) thỏa mãn TH1: (n = 2; m = 3) => A chứa Val2Ala2 (0,03) và Val3Ala2 (0,02) => %mY = 45,98% TH2: (n = 4; m = 0) => A chứa Val4 (0,03) và Ala5 (0,02) => %mY = 37,53% Xét các đáp án thấy giá trị 45,98% phù hợp
Câu 38 :
Este X được tạo từ một axit cacboxylic hai chức và hai ancol đơn chức. Đốt cháy hoàn toàn X luôn thu được CO2 có số mol bằng O2 phản ứng. Cho 1 mol X phản ứng vừa hết 2 mol H2 (xúc tác Ni, to) thu được chất Y. Cho 1 mol chất Y tác dụng với 2 mol NaOH thu được 3 chất A, B, C trong đó B và C là đồng đẳng kế tiếp và khi đun nóng B với H2SO4 đặc ở 170oC không thu được anken. Cho các nhận định: (1) Chất X có CTPT là C7H8O4. (2) Chất A có CTPT là C4H2O4Na. (3) Chất C là ancol etylic. (4) Hai chất X và Y đều có mạch không phân nhánh. Số nhận định đúng là
Đáp án : C Phương pháp giải :
Este X tạo từ 1 axit 2 chức và 2 ancol đơn chức nên este X là este hai chức. Đặt công thức của este là CnH2n+2-2kO4 *Đốt cháy: CnH2n+2-2kO4 + (3n-k-3)/2 O2 → nCO2 + (n+1-k) H2O Số mol CO2 bằng số mol O2 => n = (3n-k-3)/2 => n = k + 3 *X phản ứng vừa hết với 2 mol H2 nên X có 2 π ở gốc hidrocacbon. Ta thấy: X có 2π ở gốc hidrocacbon và 2π ở nhóm COO => k = ? => n = ? Suy ra CTPT của X *Y là este hai chức, no, mạch hở tác dụng với NaOH thu được A, B, C trong đó B, C là đồng đẳng kế tiếp nên B, C là 2 ancol no, đơn chức. Khi đun nóng B với H2SO4 đặc ở 170oC không thu được anken suy ra 2 ancol Từ đó xác định CTCT của các chất. Lời giải chi tiết :
Este X tạo từ 1 axit 2 chức và 2 ancol đơn chức nên este X là este hai chức. Đặt công thức của este là CnH2n+2-2kO4 *Đốt cháy: CnH2n+2-2kO4 + (3n-k-3)/2 O2 → nCO2 + (n+1-k) H2O Số mol CO2 bằng số mol O2 => n = (3n-k-3)/2 => n = k + 3 *X phản ứng vừa hết với 2 mol H2 nên X có 2 π ở gốc hidrocacbon. Ta thấy: X có 2π ở gốc hidrocacbon và 2π ở nhóm COO => k = 2 + 2 = 4 => n = 7 => X là C7H8O4 *Y là este hai chức, no, mạch hở tác dụng với NaOH thu được A, B, C trong đó B, C thuộc cùng dãy đồng đẳng nên B, C là 2 ancol no, đơn chức. Khi đun nóng B với H2SO4 đặc ở 170oC không thu được anken nên B là CH3OH => C là C2H5OH Vậy: X là CH3OOC-C≡C-COOC2H5; Y là CH3OOC-CH2-CH2-COOC2H5 A là NaOOC-C≡C-COONa Xét các nhận định: (1) Chất X có CTPT là C7H8O4 => đúng (2) Chất A có CTPT là C4H2O4Na => sai, A có CTPT là C4O4Na2 (3) Chất C là ancol etylic => đúng (4) Hai chất X và Y đều có mạch không phân nhánh => đúng Vậy có tất cả 3 nhận định đúng
Câu 39 :
Đốt cháy hoàn toàn m gam hỗn hợp gồm glyxin, anlanin, amoni acrylat và etylamin bằng lượng oxi vừa đủ. Sản phẩm cháy hấp thụ vào dung dịch Ba(OH)2 dư thu được 41,37 gam kết tủa, khối lượng dung dịch Ba(OH)2 giảm 26,82 gam và 1,008 lít khí (đktc) không bị hấp thụ. Giá trị của m là
Đáp án : A Phương pháp giải :
Glyxin: C2H5NO2 (H2N-CH2-COOH) Alanin: C3H7NO2 (H2N-CH(CH3)-COOH) Amoni acrylat: C3H7NO2 (CH2=CH-COONH4) Etylamin: C2H7N (C2H5NH2) Do Alanin và Amoni acrylat có cùng công thức phân tử nên ta coi hỗn hợp ban đầu gồm: C2H5NO2 (x mol) C3H7NO2 (y mol) C2H7N (z mol) Áp dụng bảo toàn nguyên tố C, H, N để lập hệ 3 phương trình và giải. Lời giải chi tiết :
Glyxin: C2H5NO2 (H2N-CH2-COOH) Alanin: C3H7NO2 (H2N-CH(CH3)-COOH) Amoni acrylat: C3H7NO2 (CH2=CH-COONH4) Etylamin: C2H7N (C2H5NH2) Do Alanin và Amoni acrylat có cùng công thức phân tử nên ta coi hỗn hợp ban đầu gồm: C2H5NO2 (x mol) C3H7NO2 (y mol) C2H7N (z mol) Ta có: + nBaCO3 = nCO2 = 41,37 : 197 = 0,21 mol + m dd giảm = mBaCO3 - (mCO2 + mH2O) => 26,82 = 41,37 - (0,21.44 + mH2O) => mH2O = 5,31 gam => nH2O = 0,295 mol + nN2 = 1,008 : 22,4 = 0,045 mol BTNT "C": 2x + 3y + 2z = 0,21 BTNT "H": 5x + 7y + 7z = 2nH2O = 2.0,295 BTNT "N": x + y + z = 2nN2 = 2.0,045 Giải hệ thu được x = 0,02; y = 0,03; z = 0,04 => m = 0,02.75 + 0,03.89 + 0,04.45 = 5,97 gam
Câu 40 :
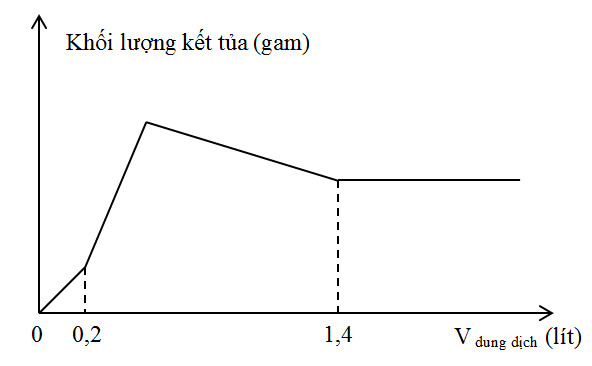
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba và Al2O3 vào nước được dung dịch Y. Nhỏ từ từ V lít dung dịch H2SO4 0,3M vào Y. Đồ thị mô tả sự phụ thuộc giữa khối lượng kết tủa vào V như sau:
Giá trị của m là
Đáp án : D Phương pháp giải :
+ Tại V = 0,2 lít thì OH- vừa bị trung hòa hết: => nOH- = nH+ + Tại V = 1,4 lít thì Al(OH)3 bị hòa tan hết: nH+ = nOH- + 4nAlO2- Lời giải chi tiết :
Giả sử hỗn hợp X gồm Ba (x mol) và Al2O3 (y mol) => Dung dịch Y gồm: Ba2+ (x mol); AlO2- (2y mol) và OH- BTĐT => 2nBa2+ = nAlO2- + nOH- => 2x = 2y + nOH- => nOH- = 2x - 2y + Tại V = 0,2 lít thì OH- vừa bị trung hòa hết: nH2SO4 = 0,06 mol => nH+ = 0,12 mol => nOH- = nH+ => 2x - 2y = 0,12 (1) + Tại V = 1,4 lít thì Al(OH)3 bị hòa tan hết: nH2SO4 = 0,42 mol => nH+ = 0,84 mol nH+ = nOH- + 4nAlO2- => 0,84 = 0,12 + 4.2y (2) Giải (1) và (2) được x = 0,15 và y = 0,09 => m = 0,15.137 + 0,09.102 = 29,73 gam |