Đề thi THPT QG môn Hóa trường THPT Chuyên Đại học Vinh lần 2Đề bài
Câu 1 :
Poli(vinyl clorua)(PVC) được điều chế từ phản ứng trùng hợp chất nào sau đây
Câu 2 :
Etyl fomat là một este có mùi thơm, không độc, được dùng để làm chất tạo hương trong công nghiệp thực phẩm. Công thức của etyl fomat là
Câu 3 :
Phản ứng nào sau đây có phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 ?
Câu 4 :
X là một loại tơ. Một mắt xích cơ bản của X có khối lượng 226u (hay đvC). X có thể là:
Câu 5 :
Thành phần chính của thạch cao nung là canxi sunfat. Công thức của canxi sunfat là
Câu 6 :
Thủy phân hoàn toàn xenlulozo, thu được monosaccarit X. Oxi hóa X bằng Cu(OH)2 trong dung dịch NaOH đun nóng, thu được chất hữu cơ Y. Hai chất X, Y lần lượt
Câu 7 :
Với cấu tạo tinh thể kim loại, kim loại nào sau đây có độ cứng cao nhất
Câu 8 :
Thủy phân hoàn toàn m gam tinh bột, thu lấy toàn bộ lượng glucozo đem lên men thành ancol etylic với hiệu suất 50% thu được V lít khí CO2 đktc . Hấp thụ hết lượng CO2 vào nước vôi trong dư thu được 40 gam kết tủa. Giá trị của m là
Câu 9 :
Một số cơ sở sản xuất thuốc bắc thường đốt một chất bột rắn màu vàng (là một đơn chất) để tạo ra khí X nhằm mục đích tẩy trắng, chống mốc. Tuy nhiên, theo các nghiên cứu khoa học thì khí X có ảnh hưởng không tốt đến cơ quan nội tạng và khí X cũng là một trong những nguyên nhân gây ra mưa axit. Khí X là
Câu 10 :
Kim loại nào sau đây không tan trong dung dịch kiểm
Câu 11 :
Cho dung dịch NaOH vào lượng dư dung dịch chất X, thu được kết tủa màu lục xám. Chất X là:
Câu 12 :
Oxit nào sau đây là oxit lưỡng tính
Câu 13 :
Dung dịch albumin của lòng trắng trứng dễ bị thủy phân trong dung dịch chất nào sau đây
Câu 14 :
Cho các chất sau đây: glyxylalanin (Gly-Ala), anilin, metyl amoniclorua, natri axetat, phenol. Số chất tác dụng được với NaOH trong dung dịch là
Câu 15 :
Đốt cháy hoàn toàn amin X bậc 2 no đơn chức, mạch hở, thu được 0,45 mol H2O và 0,05 mol N2. Công thức phân tử của X là
Câu 16 :
Chất nào sau đây thuộc loại polime tự nhiên:
Câu 17 :
Kim loại Fe không tan được trong dung dịch
Câu 18 :
Cho 6 gam Fe vào 100 ml dung dịch H2SO4 1M (loãng). Sau phản ứng xảy ra hoàn toàn thu được V lít khí đktc. Giá trị của V là
Câu 19 :
Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch CrCl3 1M, sau khi các phản ứng xảy ra hoàn toàn thu được 10,3 gam kết tủa. Giá trị lớn nhất của V là
Câu 20 :
Kim loại nào sau đây có thể điều chế được bằng phản ứng nhiệt nhôm
Câu 21 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, Na2O, Ba và BaO (trong đó oxi chiếm 10,435% về khối lượng hỗn hợp) vào nước , thu được 500 ml dung dịch Y có pH = 13 và 0,224 lít khí đktc. Sục từ từ đến hết 1,008 lít khí đktc CO2 vào Y thu được khối lượng kết tủa là
Câu 22 :
Hidrocacbon mạch hở X (26 < MX < 58). Trộn m gam X với 0,52 gam stiren thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được 2,24 lít khí CO2 đktc và 0,9 gam H2O. Mặt khác, toàn bộ lượng Y trên làm mất màu tối đa a gam Br2 trong dung dịch. Giá trị của a là
Câu 23 :
Phát biểu nào sau đây là sai:
Câu 24 :
Thực hiện các thí nghiệm sau a. Nung nóng KNO3 b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư c. Sục khí Cl2 vào dung dịch FeCl2 d. Cho dung dịch KHSO4 vào dung dịch FeCl2 e. Cho Si vào dung dịch NaOH Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
Câu 25 :
Cho các phương trình phản ứng sau đây X + Y + 2H2O → Z + T (1) T + NaOH → X + 2H2O (2) Y + 2NaOH → E + H2O (3) Y + E + H2O → 2Z (4) 2AlCl3 + 3E + 3H2O → 2T + 3Y + 6NaCl Các chất Z, T, E là
Câu 26 :
X và Y là 2 este mạch hở có công thức phân từ C5H8O2. Thuỷ phân X và Y trong dung dịch NaOH đun nóng thu được hỗn hợp sản phẩm trong đó có chứa hai chất hữu cơ tương ứng Z và T. Đem Z tác dụng với dung dịch AgNO3 trong NH3 dư thu được chất E. Lấy E tác dụng với NaOH thu được chất T. Công thức cấu tạo thu gọn của X, Y có thể lần lượt là
Câu 27 :
Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
Câu 28 :
Dung dịch X gồm KHCO3 aM và Na2CO3 1M. Dung dịch Y gồm H2SO4 0,25M và HCl 1,5M. Nhỏ từ từ đến hết 100 ml dung dịch X vào 100 ml dung dịch Y thấy thoát ra 2,688 lít khí CO2 đktc. Nhỏ từ từ cho đến hết 100 ml dung dịch Y vào 100 ml dung dịch X thu được dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của a và m lần lượt có thể là
Câu 29 :
Cho các phát biểu sau đây: (a) Sục khí CO2 tới dư vào dung dịch Ba(AlO2)2 , sau các phản ứng xảy ra hoàn toàn thu được kết tủa rắn gồm 2 chất (b) Nhỏ dung dịch NaAlO2 vào lượng dư dung dịch KHSO4 thu được kết tủa trắng (c) Chì và các hợp chất của chì đều rất độc (d) Nước có chứa nhiều cation Na+ (hoặc Mg2+) và HCO3- gọi là nước cứng tạm thời (e) Trong đời sống, người ta thường dùng clo để diệt trùng nước sinh hoạt Số phát biểu đúng là
Câu 30 :
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2 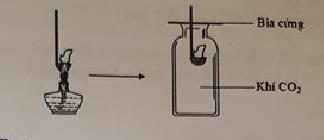 Kim loại M là
Câu 31 :
Tiến hành các thí nghiệm sau (a) Nhúng dây sắt nguyên chất vào dung dịch AgNO3 (b) Cắt miếng tôn (sắt tráng kẽm) để trong không khí ẩm (c) Nhúng dây sắt vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4. (d) Quấn dây đồng vào đinh sắt rồi nhúng vào dung dịch FeCl3 Số thí nghiệm Fe bị ăn mòn điện hóa học là
Câu 32 :
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH thu được glixerol, natri stearate và natri oleat. Đốt cháy hoàn toàn m gam X thu được H2O và 9,12 mol CO2. Mặt khác m gam X tác dụng hoàn toàn với H2 dư(xúc tác Ni, nung nóng) thu được chất béo Y. Đem toàn bộ Y tác dụng hoàn toàn với NaOH vừa đủ, thu lấy toàn bộ muối sau phản ứng đốt cháy trong oxi dư thì thu được tối đa a gam H2O. Giá trị của a gần nhất với giá trị nào sau đây ?
Câu 33 :
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
Câu 34 :
X và Y là hai chất hữu cơ có cùng công thức phân tử C6H13NO4 . Khi X tác dụng vừa đủ với dung dịch NaOH đun nóng thu được amin Z, ancol đơn chức T và dung dịch muối của axit cacboxylic E (Z, T, E đều có cùng số nguyên tử cacbon). Lấy m gam hỗn hợp X, Y tác dụng vừa đủ với 600 ml dung dịch NaOH 1M đun nóng, sau khi các phản ứng xảy ra hoàn toàn thu được 13,5 gam Z; 9,2 gam T và dung dịch Q gồm 3 chất hữu cơ có cùng số nguyên tử cacbon. Cô cạn dung dịch Q thu được a gam chất rắn khan M. Phần trăm khối lượng của chất có phân tử khối bé nhất M là
Câu 35 :
Cho X là axit cacboxylic đa chức (có MX < 200). Y, Z, T là ba ancol đơn chức có cùng số nguyên tử cacbon và trong phân tử mỗi chất có không quá 1 liên kết ∏. E là este đa chức tạo bởi X, Y, Z, T. Lấy m gam hỗn hợp Q gồm X, Y, Z, T, E tác dụng vừa đủ với dung dịch NaOH 18% thu được hỗn hợp G gồm các ancol có cùng số mol và dung dịch chứa một chất tan duy nhất có nồng độ 26,86%. Cô cạn dung dịch này, rồi đem toàn bộ ba muối khan đốt cháy hoàn toàn trong oxi dư, sau phản ứng thu được H2O; 0,09 mol Na2CO3 và 0,15 mol CO2. Cho G vào bình đựng Na dư thấy khối lượng bình tăng 38,5 gam và có 0,33 mol khí thoát ra. Phát biểu không đúng về các chất trong hỗn hợp Q là
Câu 36 :
Hòa tan hết a mol FeCO3 vào dung dịch HCl (lấy dư 10% so với lượng cần dùng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào dung dịch X thu được b gam kết tủa. Biết sản phẩm khử của N+5 là khí NO duy nhất, các phản ứng đều xảy ra hoàn toàn. Biểu thức về mối quan hệ giữa a và b là
Câu 37 :
Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2;Ba(AlO2)2; Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
Giá trị của m là:
Câu 38 :
Hòa tan hoàn toàn m gam hỗn hợp Cu(NO3)2 và KCl vào H2O thu được dung dịch X. Điện phân dung dịch X (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giờ thu được 1,12 lít (đktc) khí ở anot. Nếu điện phân trong thời gian 3,5t giờ thì thu được 2,8 lít khí (đktc) khí ở anot và thu được dung dịch Y. Cho 20 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được khí NO (sản phẩm khử duy nhất của N+5) và 16,4 gam hỗn hợp kim loại. Biết hiệu suất điện phân là 100%, các khí không tan trong dung dịch. Giá trị của m là
Câu 39 :
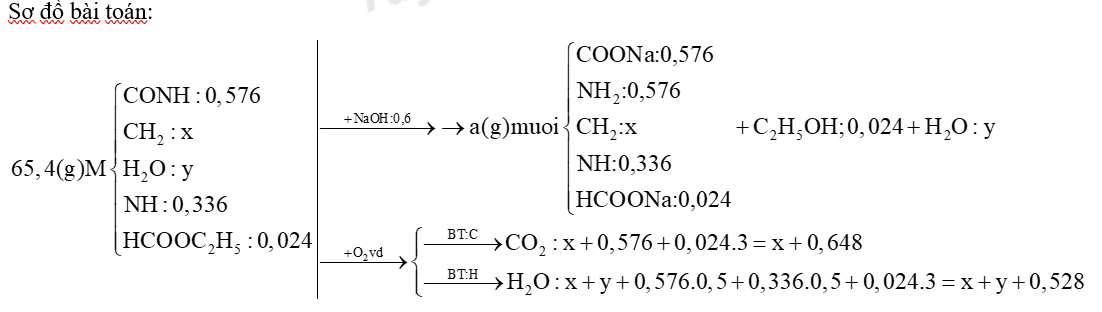
Hỗn hợp M gồm các este no, đơn chức mạch hở G, hai amino axit X, Y và ba peptit mạch hở Z, T, E đều tạo bởi X, Y. Cho 65,4 gam M phản ứng hoàn toàn với lượng vừa đủ 600 ml dung dịch NaOH 1M, thu được 1,104 gam ancol etylic và dung dịch F chứa a gam hỗn hợp ba muối natri của alanin, lysin và axit cacboxylic Q (trong đó số mol của lysin gấp 14 lần số mol của muối axit cacboxylic). Mặt khác, đốt cháy hoàn toàn b gam M bằng lượng oxi vừa đủ thu được 2,36 mol CO2 và 2,41 mol H2O. Kết luận nào sau đây là sai?
Câu 40 :
Cho các phát biểu sau: (a) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng (b) Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh (c) Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học (d) Phân tử amilopectin có cấu trúc mạch phân nhánh (e) Trong nọc kiến có axit fomic, để giảm đau nhức khi bị kiến đốt, có thể bôi vôi tôi vào vết đốt (f) Xenlulozơ trinitrat được ứng dụng sản xuất tơ sợi Số phát biểu đúng là
Lời giải và đáp án
Câu 1 :
Poli(vinyl clorua)(PVC) được điều chế từ phản ứng trùng hợp chất nào sau đây
Đáp án : C Lời giải chi tiết :
PVC poli vinyl clorua có CTHH là CH2=CHCl
Câu 2 :
Etyl fomat là một este có mùi thơm, không độc, được dùng để làm chất tạo hương trong công nghiệp thực phẩm. Công thức của etyl fomat là
Đáp án : A Lời giải chi tiết :
CH3COOC2H5
Câu 3 :
Phản ứng nào sau đây có phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 ?
Đáp án : C Phương pháp giải :
Chất điện li hoàn toàn là các axit mạnh, bazo mạnh hoặc muối tạo bởi axit hoặc bazo manh Xem lại cách viết phương trình ion thu gọn Lời giải chi tiết :
Phản ứng có phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 là: Ba(HCO3)2 + Na2SO4 → BaSO4 + 2NaHCO3
Câu 4 :
X là một loại tơ. Một mắt xích cơ bản của X có khối lượng 226u (hay đvC). X có thể là:
Đáp án : B Phương pháp giải :
Xem lại CTPT của các tơ và tính phân tử khối của chúng Lời giải chi tiết :
Xét các phương án A. Tơ nitron(hay olon) có CT là (-CH2=CHCN-)n → M = 53u B. Tơ nilon – 6,6 có CT là –( OC – (CH2)4 – CONH – (CH2)6 – NH)-n → M = 226u C. Xenlulozo triaxetat có CT là [C6H7O2(OCOCH3)3]n → M = 288 u D. Poli metyl metacrylat có CT là
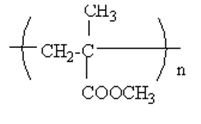 → M = 100u
Câu 5 :
Thành phần chính của thạch cao nung là canxi sunfat. Công thức của canxi sunfat là
Đáp án : C Lời giải chi tiết :
Công thức của canxi sunfat là CaSO4
Câu 6 :
Thủy phân hoàn toàn xenlulozo, thu được monosaccarit X. Oxi hóa X bằng Cu(OH)2 trong dung dịch NaOH đun nóng, thu được chất hữu cơ Y. Hai chất X, Y lần lượt
Đáp án : A Lời giải chi tiết :
(C6H10O5)n + nH2O → nC6H12O6 (glucozo) ( X) CH2OH – (CHOH)4 – CHO + 2Cu(OH)2 + NaOH → CH2OH – (CHOH)4 – COONa (Y) + Cu2O + 3H2O
Câu 7 :
Với cấu tạo tinh thể kim loại, kim loại nào sau đây có độ cứng cao nhất
Đáp án : C Lời giải chi tiết :
Với cấu tạo tinh thể kim loại, kim loại có độ cứng cao nhất Cr
Câu 8 :
Thủy phân hoàn toàn m gam tinh bột, thu lấy toàn bộ lượng glucozo đem lên men thành ancol etylic với hiệu suất 50% thu được V lít khí CO2 đktc . Hấp thụ hết lượng CO2 vào nước vôi trong dư thu được 40 gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
C6H12O6 → 2C2H5OH + 2CO2 CO2 + Ca(OH)2 → CaCO3 + H2O Lời giải chi tiết :
(C6H10O5)n → nC6H12O6 → 2nCO2 CO2 + Ca(OH)2 → CaCO3 + H2O Có nCaCO3 = 40 : 100 = 0,4 mol → nCO2 = 0,4 mol → ntinh bột = ½ . nCO2 : n = ½ . 0,4 : n = 0,2/n mol → mtinh bột (lý thuyết) = 0,2/n .162n = 32,4 gam Vì H = 50% → mtinh bột (thực tế) = 32,4 : 50 .100 = 64,8 gam
Câu 9 :
Một số cơ sở sản xuất thuốc bắc thường đốt một chất bột rắn màu vàng (là một đơn chất) để tạo ra khí X nhằm mục đích tẩy trắng, chống mốc. Tuy nhiên, theo các nghiên cứu khoa học thì khí X có ảnh hưởng không tốt đến cơ quan nội tạng và khí X cũng là một trong những nguyên nhân gây ra mưa axit. Khí X là
Đáp án : C Phương pháp giải :
Xem lại các khí gây mưa axit Lời giải chi tiết :
Chất rắn vàng là S → X là SO2 do X có khả năng tẩy trắng chống mốc và là nguyên nhân gây mưa axit
Câu 10 :
Kim loại nào sau đây không tan trong dung dịch kiểm
Đáp án : B Phương pháp giải :
Chất tan trong dung dịch kiềm là những chất tan trong nước hoặc những kim loại có oxit lưỡng tính như Zn, Al Lời giải chi tiết :
Kim loại không tan trong dung dịch kiểm là Fe. Vì Ba và Na tan được trong nước của dung dịch kiềm Còn Al + NaOH + H2O → NaAlO2 + 3/2 H2
Câu 11 :
Cho dung dịch NaOH vào lượng dư dung dịch chất X, thu được kết tủa màu lục xám. Chất X là:
Đáp án : B Phương pháp giải :
Viết PTHH và xem lại màu của các chất sản phẩm Lời giải chi tiết :
Cho dung dịch NaOH vào lượng dư dung dịch chất X, thu được kết tủa màu lục xám. Chất X là vì CrCl3 FeCl3 + 3NaOH → 3NaCl + Fe(OH)3 (màu nâu đỏ) CrCl3 + 3NaOH → 3NaCl + Cr(OH)3 (màu lục xám) MgCl2 + 2NaOH → 2NaCl + Mg(OH)2 (màu trắng) FeCl2 + 2NaOH → 2NaCl + Fe(OH)2 (trắng xanh)
Câu 12 :
Oxit nào sau đây là oxit lưỡng tính
Đáp án : C Phương pháp giải :
Xem lại các oxit lưỡng tính Lời giải chi tiết :
Oxit lưỡng tính : Cr2O3
Câu 13 :
Dung dịch albumin của lòng trắng trứng dễ bị thủy phân trong dung dịch chất nào sau đây
Đáp án : A Lời giải chi tiết :
Dung dịch albumin của lòng trắng trứng dễ bị thủy phân trong dung dịch HCl. Vì albumin là chuỗi polipeptit nên có tính chất như peptit : thủy phân trong môi trường axit → axit amin
Câu 14 :
Cho các chất sau đây: glyxylalanin (Gly-Ala), anilin, metyl amoniclorua, natri axetat, phenol. Số chất tác dụng được với NaOH trong dung dịch là
Đáp án : A Phương pháp giải :
Xem lại TCHH của aminoaxit, amin, phenol Lời giải chi tiết :
Có 3 chất tác dụng được với NaOH trong dung dịch là: glyxylalanin (Gly-Ala), metyl amoniclorua, phenol.
Câu 15 :
Đốt cháy hoàn toàn amin X bậc 2 no đơn chức, mạch hở, thu được 0,45 mol H2O và 0,05 mol N2. Công thức phân tử của X là
Đáp án : C Phương pháp giải :
Bào toàn nguyên tố N có nX = 2nN2 CTPT của X có dạng CnH2n+3N : 0,1 mol → n Lời giải chi tiết :
Ta có nX = 2nN2 (vì X là amin đơn chức) → nX = 0,1 mol X có số H = 2nH2O : nX = 2.0,45 : 0,1 = 9 Vì X là amin no bậc 2 đơn chức nên X có CTPT dạng CnH2n+3N → 2n + 3 = 9 → n = 3 X là C3H9N
Câu 16 :
Chất nào sau đây thuộc loại polime tự nhiên:
Đáp án : D Lời giải chi tiết :
Chất thuộc loại polime tự nhiên: tinh bột Amino axit, saccarozo, chất béo là chất tự nhiên nhưng không phải polime
Câu 17 :
Kim loại Fe không tan được trong dung dịch
Đáp án : C Lời giải chi tiết :
Kim loại Fe không tan được trong dung dịch ZnCl2 vì tính khử Zn > Fe
Câu 18 :
Cho 6 gam Fe vào 100 ml dung dịch H2SO4 1M (loãng). Sau phản ứng xảy ra hoàn toàn thu được V lít khí đktc. Giá trị của V là
Đáp án : A Phương pháp giải :
Tính theo PTHH : Fe + H2SO4 → FeSO4 + H2 Lời giải chi tiết :
nFe = 0,11 mol nH2SO4 = 0,1 mol Fe + H2SO4 → FeSO4 + H2 → nH2 = 0,1 mol → V = 2,24 lít
Câu 19 :
Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch CrCl3 1M, sau khi các phản ứng xảy ra hoàn toàn thu được 10,3 gam kết tủa. Giá trị lớn nhất của V là
Đáp án : B Phương pháp giải :
nCr(OH)3 = 0,1 mol; nCrCl3 = 0,2 mol → V max khi mà NaOH phản ứng tạo kết tủa tối đa rồi tan một phần 3NaOH + CrCl3 → 3NaCl + Cr(OH)3 Cr(OH)3 + NaOH → NaCrO2 + 2H2O Lời giải chi tiết :
nCr(OH)3 = 0,1 mol; nCrCl3 = 0,2 mol → V max khi mà NaOH phản ứng tạo kết tủa tối đa rồi tan một phần 3NaOH + CrCl3 → 3NaCl + Cr(OH)3 Cr(OH)3 + NaOH → NaCrO2 + 2H2O → nNaOH = 3nCrCl3 + nCr(OH)3(hòa tan) = 3.0,2 + (0,2 – 0,1) = 0,7 mol → V = 0,7 : 2 = 0,35 lít = 350 ml
Câu 20 :
Kim loại nào sau đây có thể điều chế được bằng phản ứng nhiệt nhôm
Đáp án : D Phương pháp giải :
Phản ứng nhiệt nhôm là phản ứng dùng Al để khử oxit của những kim loại đứng sau Al trong dãy điện hóa. Kim loại có thể điều chế được bằng phản ứng nhiệt nhôm là những kim loại đứng sau Al trong dãy điện hóa Lời giải chi tiết :
Kim loại có thể điều chế được bằng phản ứng nhiệt nhôm là những kim loại đứng sau Al trong dãy điện hóa → kim loại thỏa mãn là Cr : Cr2O3 + 2Al → 2Cr + Al2O3
Câu 21 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, Na2O, Ba và BaO (trong đó oxi chiếm 10,435% về khối lượng hỗn hợp) vào nước , thu được 500 ml dung dịch Y có pH = 13 và 0,224 lít khí đktc. Sục từ từ đến hết 1,008 lít khí đktc CO2 vào Y thu được khối lượng kết tủa là
Đáp án : A Phương pháp giải :
Quy đổi X thành Na: x mol; Ba : y mol và O : z mol %OX → pt (1) X + NaOH : Na → Na+ + 1e Ba → Ba+2 + 2e O + 2e → O-2 2H+1 + 2e → H2 Bảo toàn e có pt (2) Vì pH + pOH = 14 → pOH = 1 → [OH-] → pt (3) Giải (1) (2) và (3) có x ; y và z → thành phần các ion trong Y Y + 0,045 mol CO2 : 2OH- + CO2 → CO32- + H2O OH- + CO2 → HCO3- Ba2+ + CO32- → BaCO3 Lời giải chi tiết :
Quy đổi X thành Na: x mol; Ba : y mol và O : z mol %OX = \(\dfrac{{16z}}{{23x + 137y + 16z}}.100\% = 10,435\% \)(1) nH2 = 0,01 mol X + NaOH : Na → Na+ + 1e Ba → Ba+2 + 2e O + 2e → O-2 2H+1 + 2e → H2 Bảo toàn e có x + 2y = 2z + 0,01.2 (2) BTĐT: nOH- = nNa+ + 2nBa2+ = x + 2y (mol) Vì pH + pOH = 14 → pOH = 1 → [OH-] = 10-1 = 0,1 = \(\dfrac{{2x + y}}{{0,5}}\)→ x + 2y = 0,05 (3) Giải (1) (2) và (3) có x = 0,03 mol; y = 0,01 mol và z = 0,015 mol → Y có Na+ : 0,03 mol; Ba+2 : 0,01 mol; OH- : 0,05 mol Y + 0,045 mol CO2 : vì \(\dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = 1,11\) → phản ứng tạo ra cả HCO3- và CO32- 2OH- + CO2 → CO32- + H2O 2a a a OH- + CO2 → HCO3- b b Ta có nOH- = 2a + b = 0,05 mol và nCO2 = a + b = 0,045 mol nên a = 0,005 mol và b =0,04 mol Ba2+ + CO32- → BaCO3 → Phản ứng hết CO32- → nBaCO3 = 0,005 mol → mkết tủa = 0,985 gam
Câu 22 :
Hidrocacbon mạch hở X (26 < MX < 58). Trộn m gam X với 0,52 gam stiren thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được 2,24 lít khí CO2 đktc và 0,9 gam H2O. Mặt khác, toàn bộ lượng Y trên làm mất màu tối đa a gam Br2 trong dung dịch. Giá trị của a là
Đáp án : D Phương pháp giải :
nC8H8 = 0,005 mol nCO2 = 0,1 mol; nH2O = 0,05 mol Y + O2 : C8H8 + 10O2 → 8CO2 + 4H2O (1) 0,005 → 0,04 0,02 mol \({C_x}{H_y} + \dfrac{{4x + y}}{4}{O_2}\xrightarrow{{{t^o}}}xC{O_2} + \dfrac{y}{2}{H_2}O\) (2) 0,06 0,03 mol → x : y → X Lời giải chi tiết :
nC8H8 = 0,005 mol nCO2 = 0,1 mol; nH2O = 0,05 mol Y + O2 : C8H8 + 10O2 \(\xrightarrow{{{t^o}}}\) 8CO2 + 4H2O (1) 0,005 → 0,04 0,02 mol \({C_x}{H_y} + \dfrac{{4x + y}}{4}{O_2}\xrightarrow{{{t^o}}}xC{O_2} + \dfrac{y}{2}{H_2}O\) 0,06 0,03 mol → \(\dfrac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}} = \dfrac{x}{{\frac{y}{2}}} = \dfrac{{2x}}{y} = 2\) → x = y → CTPT CxHx → 28 < 13x < 58 → 2,15 < x < 4,46 Chọn x = 4 vì x chẵn →X là C4H4 : 0,015 mol Y + Br2 : C6H5CH=CH2 + Br2 → C6H5-CHBr – CH2Br C4H4 + 3Br2 → C4H4Br6 → nBr2 = 0,005 + 0,015.3 = 0,05 mol → mBr2 = 8 gam
Câu 23 :
Phát biểu nào sau đây là sai:
Đáp án : C Phương pháp giải :
Xem lại lý thuyết phần este, chất béo Lời giải chi tiết :
A đúng B đúng vì H2SO4 đặc có tính háo nước làm giảm lượng nước sản phẩm → chuyển dịch cân bằng theo chiều thuận C sai vì isoamyl axetat ít tan trong nước D đúng
Câu 24 :
Thực hiện các thí nghiệm sau a. Nung nóng KNO3 b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư c. Sục khí Cl2 vào dung dịch FeCl2 d. Cho dung dịch KHSO4 vào dung dịch FeCl2 e. Cho Si vào dung dịch NaOH Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
Đáp án : C Phương pháp giải :
Viết pthh Phản ứng oxh khử là phản ứng mà chất tham gia thay đổi số oxh Lời giải chi tiết :
(a) KNO3 KNO2 + ½ O2 → phản ứng oxh khử (b) 2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O → phản ứng oxh khử (c) Cl2 + 2FeCl2 → 2FeCl3 → phản ứng oxh khử (d) KHSO4 + FeCl2 → không phản ứng (e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 → Phản ứng oxh khử Số thí nghiệm xảy ra phản ứng oxi hóa khử là 4
Câu 25 :
Cho các phương trình phản ứng sau đây X + Y + 2H2O → Z + T (1) T + NaOH → X + 2H2O (2) Y + 2NaOH → E + H2O (3) Y + E + H2O → 2Z (4) 2AlCl3 + 3E + 3H2O → 2T + 3Y + 6NaCl Các chất Z, T, E là
Đáp án : D Phương pháp giải :
Viết PTHH Lời giải chi tiết :
Các chất Z, T, E là NaHCO3, Al(OH)3, Na2CO3 NaAlO2 (X) + CO2 (Y) + 2H2O → NaHCO3(Z) + Al(OH)3 (T) (1) Al(OH)3 (T) + NaOH → NaAlO2 (X) + 2H2O (2) CO2 (Y) + 2NaOH → Na2CO3 (E) + H2O (3) CO2 (Y) + Na2CO3 (E) + H2O → 2NaHCO3 (Z) (4) 2AlCl3 + 3Na2CO3 (E) + 3H2O → 2Al(OH)3 (T) + 3CO2 (Y) + 6NaCl (5)
Câu 26 :
X và Y là 2 este mạch hở có công thức phân từ C5H8O2. Thuỷ phân X và Y trong dung dịch NaOH đun nóng thu được hỗn hợp sản phẩm trong đó có chứa hai chất hữu cơ tương ứng Z và T. Đem Z tác dụng với dung dịch AgNO3 trong NH3 dư thu được chất E. Lấy E tác dụng với NaOH thu được chất T. Công thức cấu tạo thu gọn của X, Y có thể lần lượt là
Đáp án : D Phương pháp giải :
X và Y có số liên kết \(\pi + v = \dfrac{{2.5 - 8 + 2}}{2} = 2\)→ X và Y có 1 liên kết đôi ngoại trừ liên kết CO trong gốc cacboxyl X, Y + NaOH → Z có khả năng phản ứng với AgNO3/NH3 nên Z là andehit Viết PTHH Lời giải chi tiết :
X và Y có số liên kết \(\pi + v = \dfrac{{2.5 - 8 + 2}}{2} = 2\)→ X và Y có 1 liên kết đôi ngoại trừ liên kết CO trong gốc cacboxyl X, Y + NaOH → Z có khả năng phản ứng với AgNO3/NH3 nên Z là andehit ( Z không thể là HCOONa vì từ Z có thể tạo thành T) Z là RCHO (R no) + AgNO3/NH3 → RCOONH4 (E) E + NaOH → RCOONa (T) → T là axit no → loại A vì chứa este chứa gốc axit không no B sai vì CH3COOCH=CHCH3 tạo ra CH3 CH2CHO → muối CH3CH2COONa còn CH3COOCH2CH=CH2 tạo CH3COONa C sai vì chứa axit không no D đúng vì CH3COOCH=CH-CH3 → CH3CH2CHO → muối CH3CH2COONa C2H5COOCH=CH2 + NaOH → tạo CH3CH2COONa
Câu 27 :
Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
Đáp án : D Phương pháp giải :
Viết PTHH Xem lại TCHH của crom Lời giải chi tiết :
CrO3 + 2NaOH → Na2CrO4 (Y)+ H2O → X có màu đỏ thẫm → C đúng Y có màu vàng → D sai 2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O → Z là Na2Cr2O7 → A đúng Z + HCl : Na2Cr2O7 + 14HCl → 2NaCl + 2CrCl3 + 7H2O + 3Cl2 → khí T là Cl2 → B đúng
Câu 28 :
Dung dịch X gồm KHCO3 aM và Na2CO3 1M. Dung dịch Y gồm H2SO4 0,25M và HCl 1,5M. Nhỏ từ từ đến hết 100 ml dung dịch X vào 100 ml dung dịch Y thấy thoát ra 2,688 lít khí CO2 đktc. Nhỏ từ từ cho đến hết 100 ml dung dịch Y vào 100 ml dung dịch X thu được dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của a và m lần lượt có thể là
Đáp án : A Phương pháp giải :
Nhỏ từ từ Y vào X thì 2 phản ứng xảy ra đồng thời theo tỉ lệ số mol ban đầu HCO3- + H+ → H2O + CO2 x mol x x CO32- + 2H+ → H2O + CO2 y 2y y Ta có x + 2y = nH+ mol và x+ y = nCO2 → x , y→ a = 0,5 mol Nhỏ từ từ X vào Y thì CO32- + H+ → HCO3- HCO3- + H+ → H2O + CO2 → thành phần chất trong E Viết PTHH Lời giải chi tiết :
100 ml dung dịch X chứa HCO3- : 0,1a mol và CO32- : 0,1 mol 100 ml dung dịch Y chứa H+ : 0,2 mol; SO42- : 0,025 mol và Cl- : 0,15 mol Nhỏ từ từ Y vào X thì 2 phản ứng xảy ra đồng thời theo tỉ lệ số mol HCO3- + H+ → H2O + CO2 x mol x x CO32- + 2H+ → H2O + CO2 y 2y y Ta có x + 2y = 0,2 mol và x+ y = nCO2 = 0,12 mol → x = 0,08 mol và y = 0,04 mol → 0,1a : 0,1 = 0,04 : 0,08 → a = 0,5 mol Nhỏ từ từ X vào Y thì CO32- + H+ → HCO3- 0,1 0,1 0,1 HCO3- + H+ → H2O + CO2 0, 1 0,1 → nHCO3 =0,05 + 0,1 – 0,1 =0,05 mol → E có 0,05 mol HCO3-; 0,025 mol SO42-; Cl- : 0,15 mol; Na+: 0,2 mol và K+: 0,05 mol E + Ba(OH)2 : OH- + HCO3- → H2O + CO32- Ba+2 + CO32- → BaCO3 0,05 0,05 Ba2+ + SO42- → BaSO4 0,025 0,025 → mkết tủa = 0,05,197 + 0,025.233 = 15,675 gam
Câu 29 :
Cho các phát biểu sau đây: (a) Sục khí CO2 tới dư vào dung dịch Ba(AlO2)2 , sau các phản ứng xảy ra hoàn toàn thu được kết tủa rắn gồm 2 chất (b) Nhỏ dung dịch NaAlO2 vào lượng dư dung dịch KHSO4 thu được kết tủa trắng (c) Chì và các hợp chất của chì đều rất độc (d) Nước có chứa nhiều cation Na+ (hoặc Mg2+) và HCO3- gọi là nước cứng tạm thời (e) Trong đời sống, người ta thường dùng clo để diệt trùng nước sinh hoạt Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Viết PTHH Lời giải chi tiết :
(a) Sai vì chất rắn thu được chỉ có Al(OH)3 (b) Sai vì kết tủa Al(OH)3 bị KHSO4 hoàn tan (c) Đúng (d) Sai vì nước chứa nhiều Ca2+, Mg2+ và HCO3- gọi là nước cứng tạm thời (e) Đúng Vậy có 2 phát biểu đúng
Câu 30 :
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2  Kim loại M là
Đáp án : D Phương pháp giải :
Viết PTHH Lời giải chi tiết :
Kim loại M là Mg vì 2Mg + O2 \(\xrightarrow{{{t^o}}}\) 2MgO Mg + CO2 \(\xrightarrow{{{t^o}}}\) MgO + C
Câu 31 :
Tiến hành các thí nghiệm sau (a) Nhúng dây sắt nguyên chất vào dung dịch AgNO3 (b) Cắt miếng tôn (sắt tráng kẽm) để trong không khí ẩm (c) Nhúng dây sắt vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4. (d) Quấn dây đồng vào đinh sắt rồi nhúng vào dung dịch FeCl3 Số thí nghiệm Fe bị ăn mòn điện hóa học là
Đáp án : D Phương pháp giải :
Ăn mòn điện hóa xảy ra khi có 2 kim loại tiếp xúc trực tiếp với nhau hoặc tiếp xúc qua môi trường điện li Kim loại bị ăn mòn là kim loại mạnh hơn trong dãy điện hóa học Lời giải chi tiết :
Tiến hành các thí nghiệm sau (a) Nhúng dây sắt nguyên chất vào dung dịch AgNO3 → 2 kim loại Fe và Ag → Fe bị ăn mòn điện hóa (b) Cắt miếng tôn ( sắt tráng kẽm) để trong không khí ẩm → Zn bị ăn mòn điện hóa (c) Nhúng dây sắt vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4→ 2 kim loại Cu và Fe → Fe bị ăn mòn điện hóa (d) Quấn dây đồng vào đinh sắt rồi nhúng vào dung dịch FeCl3 → 2 kim loại Fe và Cu → Fe bị ăn mòn điện hóa Số thí nghiệm Fe bị ăn mòn điện hóa học là 3
Câu 32 :
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH thu được glixerol, natri stearate và natri oleat. Đốt cháy hoàn toàn m gam X thu được H2O và 9,12 mol CO2. Mặt khác m gam X tác dụng hoàn toàn với H2 dư(xúc tác Ni, nung nóng) thu được chất béo Y. Đem toàn bộ Y tác dụng hoàn toàn với NaOH vừa đủ, thu lấy toàn bộ muối sau phản ứng đốt cháy trong oxi dư thì thu được tối đa a gam H2O. Giá trị của a gần nhất với giá trị nào sau đây ?
Đáp án : B Phương pháp giải :
X có CTHH là (C17H33COO)n(C17H35COO)3-n C3H5 X + O2 → 57CO2 → nX X + H2 → (C17H35COO)3 C3H5 : ? mol Y + NaOH → 3C17H35COONa : ? mol C17H35COONa + O2 → CO2 +Na2CO3 + H2O Bảo toàn H Lời giải chi tiết :
X có CTHH là (C17H33COO)n(C17H35COO)3-n C3H5 X + O2 → 57CO2 → nX = 9,12 : 57 = 0,16 mol X + H2 → (C17H35COO)3 C3H5 : 0,16 mol Y + NaOH → 3C17H35COONa : 0,48 mol Bảo toàn nguyên tố H khi đốt muối có 2nH2O = nH = 0,48. 35 =16,8 mol → nH2O = 8,4 mol → mH2O = 151,2 gam gần nhất với 150 gam
Câu 33 :
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
Đáp án : A Phương pháp giải :
Đặt số mol của FeCO3 là x mol, FeS2 : y mol Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O Vì khí thu được có M = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO → khí còn lại có M < 13,2 → khí đó là H2 nNO < nNO3 nên xảy ra phản ứng tạo NH4+ 4H+ + NO3- + 3e → H2O + NO 10H+ + NO3- + 9e → 3H2O + NH4+ O + 2e → O2- O2- + 2H+ → H2O 2 H+ + 2e → H2 Bảo toàn nguyên tố Lời giải chi tiết :
Đặt số mol của FeCO3 là x mol, FeS2 : y mol Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O nkhí = 0,05 mol Vì khí thu được có M = 0,66 : 0,05 = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO → khí còn lại có M < 13,2 → khí đó là H2 nNO = a mol và nH2 = b mol thì nkhí = a + b =0,05 mol và mkhí = 30a + 2b = 0,66 nên a = 0,02 mol và b = 0,03 mol Vì khí sinh ra có H2 nên lượng NO3- phải phản ứng hết, mà nNO < nNO3 nên xảy ra phản ứng tạo NH4+ PTHH : 4H+ + NO3- + 3e → H2O + NO 0,08 0,02 0,06 0,02
10H+ + NO3- + 9e → 3H2O + NH4+ 0,1 0,01 0,09 0,01 O + 2e → O2- O2- + 2H+ → H2O 2 H+ + 2e → H2 Vì dung dịch thu được chỉ chứa muối clo nên H+ hết nên 0,08 + 0,1 + 2nO + 0,03.2= 0,72 mol→ nO = 0,24 mol Bảo toàn O cho phản ứng đốt cháy X có nO(X) + 2nO2 = nO(Y) + 2nSO2 + 2nCO2 → 3x + 2.0,16 = 0,24 + 2.2y + 2x → 3x + 0,32 = 0,24 + 2x + 2x → x = 0,08 mol → nO(X) = 0,08.3 = 0,24 mol → mO(X) = 3,84 gam Vì trong X chiếm 16,71% O nên mX = 3,84 : 16,71 .100 =22,98 gam gần nhất với 23 gam
Câu 34 :
X và Y là hai chất hữu cơ có cùng công thức phân tử C6H13NO4 . Khi X tác dụng vừa đủ với dung dịch NaOH đun nóng thu được amin Z, ancol đơn chức T và dung dịch muối của axit cacboxylic E (Z, T, E đều có cùng số nguyên tử cacbon). Lấy m gam hỗn hợp X, Y tác dụng vừa đủ với 600 ml dung dịch NaOH 1M đun nóng, sau khi các phản ứng xảy ra hoàn toàn thu được 13,5 gam Z; 9,2 gam T và dung dịch Q gồm 3 chất hữu cơ có cùng số nguyên tử cacbon. Cô cạn dung dịch Q thu được a gam chất rắn khan M. Phần trăm khối lượng của chất có phân tử khối bé nhất M là
Đáp án : D Phương pháp giải :
X + NaOH → amin Z + ancol T + muối E có cùng số nguyên tử C nên X tạo bởi amin, ancol và muối có 2C → X X, Y + NaOH : 0,6 mol → nZ = 0,3 mol = nX + nY và nC2H5OH = 0,2 mol < nX + nY → X và Y được tạo bởi C2H5NH2 còn C2H5OH tạo từ X Vì 3 muối trong M có cùng số C nên 3 muối cùng có 2 C→ Y tạo ra 2 muối 2C → Y Lời giải chi tiết :
X + NaOH → amin Z + ancol T + muối E có cùng số nguyên tử C nên X tạo bởi amin, ancol và muối có 2C → X là C2H5NH3 – OOC – COO – C2H5; Z là C2H5NH2, T là C2H5OH; E là (COONa)2 X, Y + NaOH : 0,6 mol → 13,5 g Z + 9,2 g T + Q gồm 3 chất hữu cơ cùng C và là các muối → Y có 2 nhóm chức este và nX + nY = ½ . nNaOH = 0,3 mol nZ = 0,3 mol = nX + nY và nC2H5OH = 0,2 mol < nX + nY → X và Y được tạo bởi C2H5NH2 còn C2H5OH chỉ được tạo từ X → nX = nC2H5OH = 0,2 mol → nY = 0,1 mol → (COONa)2 : 0,2 mol Vì 3 muối trong M có cùng số C nên 3 muối cùng có 2 C→ Y tạo ra 2 muối 2C → Y là CH3COOCH2COONH3C2H5 → 2 muối tạo ra là CH3COONa : 0,1 mol và OHCH2COONa: 0,1 mol → Trong M muối có phân tử khối nhỏ nhất là CH3COONa : 0,1 mol → %CH3COONa = 18,3%
Câu 35 :
Cho X là axit cacboxylic đa chức (có MX < 200). Y, Z, T là ba ancol đơn chức có cùng số nguyên tử cacbon và trong phân tử mỗi chất có không quá 1 liên kết ∏. E là este đa chức tạo bởi X, Y, Z, T. Lấy m gam hỗn hợp Q gồm X, Y, Z, T, E tác dụng vừa đủ với dung dịch NaOH 18% thu được hỗn hợp G gồm các ancol có cùng số mol và dung dịch chứa một chất tan duy nhất có nồng độ 26,86%. Cô cạn dung dịch này, rồi đem toàn bộ ba muối khan đốt cháy hoàn toàn trong oxi dư, sau phản ứng thu được H2O; 0,09 mol Na2CO3 và 0,15 mol CO2. Cho G vào bình đựng Na dư thấy khối lượng bình tăng 38,5 gam và có 0,33 mol khí thoát ra. Phát biểu không đúng về các chất trong hỗn hợp Q là
Đáp án : D Phương pháp giải :
Do E là este được tạo bởi 3 ancol đơn chức Y, Z, T nên E là este 3 chức => X là axit 3 chức. *Xét phản ứng của hỗn hợp ancol G và Na: nG = 2nH2 = ? Mà m bình tăng = mG - mH2 => mG = m bình tăng + mH2 = ? => M tb = ? => Các ancol *Xét phản ứng thủy phân Q trong NaOH: nNaOH = 2nNa2CO3 = ? => m dd NaOH = ? Quy đổi hỗn hợp Q thành: axit, ancol và H2O naxit = nNaOH : 3 = ?; n ancol = nG = ? Lập sơ đồ bài toán. Dựa vào các dữ kiện còn lại kết hợp BTNT và BTKL để tìm số mol của các chất trong sơ đồ. Lời giải chi tiết :
Do E là este được tạo bởi 3 ancol đơn chức Y, Z, T nên E là este 3 chức => X là axit 3 chức. *Xét phản ứng của hỗn hợp ancol G và Na: nG = 2nH2 = 0,66 mol (do là ancol đơn chức) Mà m bình tăng = mG - mH2 => mG = m bình tăng + mH2 = 38,5 + 0,33.2 = 39,16 gam => M tb = 39,16 : 0,66 = 178/3 Các ancol có cùng số C và không quá 1 liên kết π nên ta có: MCnH2nO < 178/3 < MCnH2n+2O => 2,95 < n < 3,09 => n = 3 Vậy G gồm ancol là: CH3-CH2-CH2-OH (0,22 mol), CH3-CH(OH)-CH3 (0,22 mol), CH2=CH-CH2-OH (0,22 mol) *Xét phản ứng thủy phân Q trong NaOH: nNaOH = 2nNa2CO3 = 0,18 mol => m dd NaOH = 0,18.40.(100/18) = 40 gam Quy đổi hỗn hợp Q thành: axit, ancol và H2O naxit = nNaOH : 3 = 0,06 mol; n ancol = nG = 0,66 mol 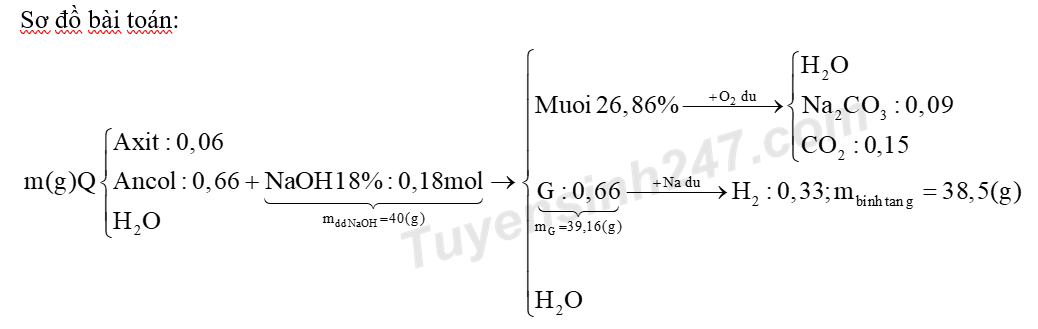 n muối = n axit = 0,06 mol. BTNT "C": nC(muối) = nNa2CO3 + nCO2 = 0,09 + 0,15 = 0,24 mol => Số C của muối = 0,24 : 0,06 = 4 => Muối là CH(COONa)3, X là CH(COOH)3 BTKL: m dd sau pư = m + mdd NaOH - mG = m + 40 - 39,16 = m + 0,84 (g) + C% muối = \(\dfrac{{0,06.214}}{{m + 0,84}}.100\% \) = 26,86% => m = 46,96 (gam) => D sai mH2O(Q) = m - m axit - m ancol = 46,96 - 0,06.148 - 39,16 = -1,08 gam => nH2O = -0,06 mol Vậy Q gồm: E: C13H20O6 (0,02 mol) X: CH(COOH)3 (0,04 mol) Y: CH2=CH-CH2-OH (0,22 - 0,02 = 0,2 mol) Z: CH3-CH2-CH2-OH (0,2 mol) T: CH3-CH(OH)-CH2-OH (0,2 mol) + %nX = 0,04/(0,02+0,04+0,2.3) = 6,06% => A đúng + Số nguyên tử H trong E là 20 => B đúng + m ancol (Q) = mY,Z,T = 0,2(58 + 60 + 60) = 35,6 (g) => C đúng
Câu 36 :
Hòa tan hết a mol FeCO3 vào dung dịch HCl (lấy dư 10% so với lượng cần dùng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào dung dịch X thu được b gam kết tủa. Biết sản phẩm khử của N+5 là khí NO duy nhất, các phản ứng đều xảy ra hoàn toàn. Biểu thức về mối quan hệ giữa a và b là
Đáp án : B Phương pháp giải :
FeCO3 + 2HCl → FeCl2 + H2O + CO2 3Fe+2 + NO3- + 4H+ → 3Fe+3 + 2H2O + NO Fe+2 + Ag+ → Fe+3 + Ag Ag+ + Cl- → AgCl Lời giải chi tiết :
FeCO3 + 2HCl → FeCl2 + H2O + CO2 a 2a a HCl lấy dư 10% nên X có nHCl dư = 0,2a mol → nCl- = 2a + 0,2a = 2,2a mol nFe2+ = a mol; nH+ = 0,2 mol X + AgNO3 thì 3Fe+2 + NO3- + 4H+ → 3Fe+3 + 2H2O + NO 0,15a 0,2a Fe+2 + Ag+ → Fe+3 + Ag 0,85a 0,85a Ag+ + Cl- → AgCl 2,2a 2,2a mol → mkết tủa = mAg + mAgCl = 0,85a. 108 + 2,2a.143,5 = 407,5a = b
Câu 37 :
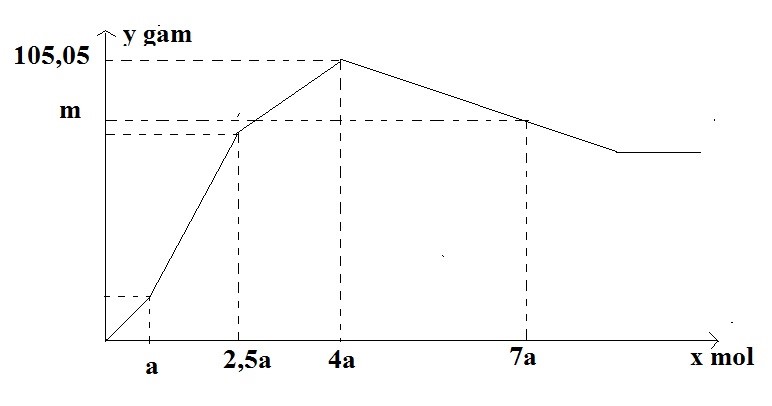
Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2;Ba(AlO2)2; Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
Giá trị của m là:
Đáp án : A Phương pháp giải :
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3 2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3 Tại thời điểm kết tủa max thì →phương trình của a → a Tại thời điểm 7a mol H2SO4 thì nH2SO4 = ? mol So với thời điểm kết tủa max thì nH2SO4 (thêm) = ? mol 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O → mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm Lời giải chi tiết :
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O a a a Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3 1,5a 1,5a 3a 2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3 1,5a 3a Tại thời điểm kết tủa max có mkết tủa = mBaSO4 + mAl(OH)3 = (a + 1,5a).233 + 78.(3a + 3a) → a = 0,1 mol Tại thời điểm 7a mol H2SO4 thì nH2SO4 = 0,7 mol So với thời điểm kết tủa max thì nH2SO4 (thêm) = 0,3 mol 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O 0,2 ← 0,3 → mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm = 105,05 – 0,2.78 = 89,45
Câu 38 :
Hòa tan hoàn toàn m gam hỗn hợp Cu(NO3)2 và KCl vào H2O thu được dung dịch X. Điện phân dung dịch X (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giờ thu được 1,12 lít (đktc) khí ở anot. Nếu điện phân trong thời gian 3,5t giờ thì thu được 2,8 lít khí (đktc) khí ở anot và thu được dung dịch Y. Cho 20 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được khí NO (sản phẩm khử duy nhất của N+5) và 16,4 gam hỗn hợp kim loại. Biết hiệu suất điện phân là 100%, các khí không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải :
Vì nkhí(1) . 3,5 ≠ nkhi(2) nên trường hợp 1 chỉ có khí là Cl2 còn trường hợp 2 tạo ra cả O2 Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Tại K : Cu+2 +2e → Cu → số mol Cl2 và O2 theo số mol e 3Fe + 8H+ + 2NO3- → 3Fe2+ + 4H2O + 2NO Nếu dung dịch Y không có Cu2+ thì mkm loại giảm = ? Nếu lượng giảm khác 3,6 thì dung dịch Y có Cu2+ : Fe + Cu2+ → Fe2+ +Cu Bảo toàn Cu Lời giải chi tiết :
Khi điện phân 3,5t giờ thì nkhí = 0,125 mol Vì nkhí(1) . 3,5 ≠ nkhi(2) nên trường hợp 1 chỉ có khí là Cl2 còn trường hợp 2 tạo ra cả O2 Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Tại K : Cu+2 +2e → Cu Xét trong trường hợp điện phân 3,5t giờ thì nCl2 = a mol và nO2 = b mol→ a + b = 0,125 mol Trong t giờ ne = 2nCl2 = 2.0,05 =0,1 mol → trong 3,5 t giờ thì ne = 0,35 mol e = 2a + 4b Giải được a = 0,075 mol; b = 0,05 mol Bảo toàn Cl có nKCl = 2nCl2 = 0,15 mol 3Fe + 8H+ + 2NO3- → 3Fe2+ + 4H2O + 2NO 0,075 ← 0,2 mol mkm loại giảm = 20 – 16,4 = 3,6 g Nếu dung dịch Y không có Cu2+ thì mkm loại giảm = 56.0,075 = 4,2 g ≠ 3,6g nên dung dịch chứa Cu2+ dư Fe + Cu2+ → Fe2+ +Cu x mol x mol → mkm loại giảm = 20 – 16,4 = 3,6 g = 56(0,075+x) – 64x → x = 0,075 mol Vì Y có dư Cu2+ nên phản ứng điện phân tại K chỉ có Cu → nCu = ne : 2 = 0,35 : 2 =0,175 mol Bảo toàn Cu có nCu(NO3)2 = nCu + nCu(Y) = 0,175 + 0,075 = 0,25 mol → m = mKCl + mCu(NO3)2 = 0,15.74,5 + 0,25.188 = 58,175 g
Câu 39 :
Hỗn hợp M gồm các este no, đơn chức mạch hở G, hai amino axit X, Y và ba peptit mạch hở Z, T, E đều tạo bởi X, Y. Cho 65,4 gam M phản ứng hoàn toàn với lượng vừa đủ 600 ml dung dịch NaOH 1M, thu được 1,104 gam ancol etylic và dung dịch F chứa a gam hỗn hợp ba muối natri của alanin, lysin và axit cacboxylic Q (trong đó số mol của lysin gấp 14 lần số mol của muối axit cacboxylic). Mặt khác, đốt cháy hoàn toàn b gam M bằng lượng oxi vừa đủ thu được 2,36 mol CO2 và 2,41 mol H2O. Kết luận nào sau đây là sai?
Đáp án : B Phương pháp giải :
Do các a.a và peptit đều được tạo nên bởi Ala và Lys nên ta có thể quy đổi thành: CONH, CH2, H2O, NH (nH2O = n peptit; nNH = nLys) Este là no, đơn, hở nên quy đổi thành: HCOOC2H5 và CH2 Vậy ta quy đổi hỗn hợp M thành: CONH, CH2, H2O, NH, HCOOC2H5 Lời giải chi tiết :
neste = nC2H5OH = n muối cacboxylic = 0,024 mol => nLys-Na = 14n muối cacboxylic = 0,024.14 = 0,336 mol Do các a.a và peptit đều được tạo nên bởi Ala và Lys nên ta có thể quy đổi thành: CONH, CH2, H2O, NH (nH2O = n peptit; nNH = nLys) Este là no, đơn, hở nên quy đổi thành: HCOOC2H5 và CH2 Vậy ta quy đổi hỗn hợp M thành: CONH, CH2, H2O, NH, HCOOC2H5 nCONH = nNaOH - nHCOOC2H5 = 0,6 - 0,024 = 0,576 (mol)
+ mM = 0,576.43 + 14x + 18y + 15.0,336 + 0,024.74 = 65,4 (1) + Xét phản ứng đốt cháy M: nCO2 : nH2O = 2,36 : 2,41 => \(\dfrac{{x + 0,648}}{{x + y + 0,528}} = \frac{{2,36}}{{2,41}}\\) (2) Giải hệ (1) và (2) được x = 2,184 và y = 0,18 BTKL: a = m muối = mM + mNaOH - mC2H5OH - mH2O = 65,4 + 0,6.40 - 0,024.46 - 0,18.18 = 85,056 gam => B sai Tỷ lệ: Đốt 65,4 gam M thu được x + 0,648 = 2,184 + 0,648 = 2,832 mol CO2 => b gam M ...................................................................2,36 mol CO2 => b = 54,5 gam => C đúng nLys-Na = 0,336 mol => nAla-Na = 0,576 - 0,336 = 0,24 mol => mAla-Na = 0,24.111 = 26,64 (g) => D đúng => mR-COONa = 85,056 - 0,24.111 - 0,336.168 = 1,968 gam => MR-COONa = 1,968 : 0,024 = 82 => CH3COONa => %m este = %mCH3COOC2H5 = 0,024.88/65,4 = 3,23% => A đúng
Câu 40 :
Cho các phát biểu sau: (a) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng (b) Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh (c) Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học (d) Phân tử amilopectin có cấu trúc mạch phân nhánh (e) Trong nọc kiến có axit fomic, để giảm đau nhức khi bị kiến đốt, có thể bôi vôi tôi vào vết đốt (f) Xenlulozơ trinitrat được ứng dụng sản xuất tơ sợi Số phát biểu đúng là
Đáp án : B Lời giải chi tiết :
(a), (b), (c), (d), (e) đúng (g) Sai vì xenlulozo trinitrat được dùng làm thuốc nổ Vậy có 5 phát biểu đúng |