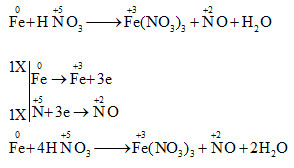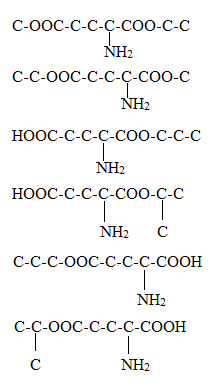Đề thi THPT QG môn Hóa trường THPT chuyên Đại học Sư phạm Hà Nội lần 1Đề bài
Câu 1 :
Trong các kim loại: Al, Mg, Fe và Cu, kim loại có tính khử mạnh nhất là
Câu 2 :
Chất nào sau đây là muối axit
Câu 3 :
Đốt cháy hoàn toàn 0,16 mol hỗn hợp X gồm CH4, C2H2, C2H4 và C3H6, thu được 6,272 lít CO2(đktc) và 6,12 gam H2O. Mặt khác 10,1 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Câu 4 :
Thuốc thử dùng để phân biệt giữa axit axetic và rượu etylic là
Câu 5 :
Đốt cháy hoàn toàn amin X (no, đơn chức, mạch hở), thu được 0,2 mol CO2 và 0,05 mol N2. Công thức phân tử X là
Câu 6 :
Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
Câu 7 :
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
Câu 8 :
Chất nào sau đây tác dụng được với dung dịch AgNO3 trong NH3?
Câu 9 :
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
Câu 10 :
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
Câu 11 :
Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ), thu được H2 ở catot. (b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu. (c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có thể xuất hiện ăn mòn điện hóa. (d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag. (e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl. Số phát biểu đúng là
Câu 12 :
Fructozơ là một loại monosaccarit có nhiều trong mật ong, có vị ngọt sắc. Công thức phân tử của fructozơ là
Câu 13 :
Polime nào sau đây thuộc loại polime thiên nhiên?
Câu 14 :
Dẫn khí CO dư qua ống sứ đựng 8 gam bột CuO nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 15 :
Một số loại khẩu trang y tế chứa hoạt chất bột màu đen có khả năng lọc không khí. Chất đó là
Câu 16 :
Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1:1 tạo ra chất Z tan trong nước. Chất Z là
Câu 17 :
ở nhiệt độ thường, chất nào sau đây làm mất màu dung dịch nước Br2?
Câu 18 :
Đốt cháy hoàn toàn hỗn hợp metyl axetat và etyl axetat, thu được CO2 và m gam H2O. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 25 gam kết tủa. Giá trị của m là
Câu 19 :
Lên men m gam glucozơ thành ancol etylic với hiệu suất 50%, thu được 4,48 lít CO2. Giá trị của m là
Câu 20 :
Cho axit acrylic tác dụng với ancol đơn chức X, thu được este Y. Trong Y, oxi chiếm 32% về khối lượng. Công thức của Y là
Câu 21 :
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a,b,c,d,e là những số nguyên, đơn giản nhất. Tổng (a+b) bằng:
Câu 22 :
Polime nào sau đây được tổng hợp bằng phản ứng trùng hợp?
Câu 23 :
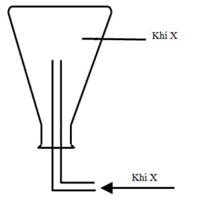
Thực hiện thí nghiệm điều chế khí X, khí X thu được vào bình tam giác theo hình vẽ bên.
Thí nghiệm đó là
Câu 24 :
Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 2 mol Gly, 2 mol Ala và 1 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Gly- Ala- Val). Số công thức cấu tạo phù hợp với tính chất của X là
Câu 25 :
Thực hiện các thí nghiệm sau: (a) Sục khí CH3NH2 vào dung dịch CH3COOH. (b) Đun nóng tinh bột trong dung dịch H2SO4 loãng. (c) Sục khí H2 vào nồi kín chứa triolein (xúc tác Ni), đun nóng. (d) Nhỏ vài giọt nước brom vào dung dịch anilin. (e) Cho dung dịch HCl vào dung dịch axit glutamic.(g) Cho dung dịch metyl fomat vào dung dịch AgNO3 trong NH3, đun nóng. Số thí nghiệm xảy ra phản ứng là
Câu 26 :
Đun nóng 48,2 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gia thu được 43,4 gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, sau phản ứng thu được 15,12 lít Cl2(đktc) và dung dịch gồm MnCl2, KCl và HCl dư.Số mol HCl phản ứng là
Câu 27 :
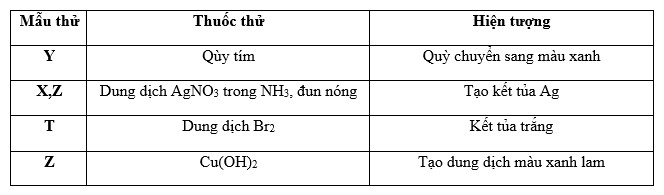
Tiến hành thí nghiệm với các dung dịch X, Y, Z và T. Kết quả được ghi ở bảng sau:
X, Y, Z, T lần lượt là
Câu 28 :
Este X có công thức phân tử C6H10O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được ba chất hữu cơ Y, Z, T. Biết Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam. Nung nóng Z với hỗn hợp rắn gồm NaOH và CaO, thu được CH4. Phát biểu nào sau đây sai ?
Câu 29 :
Cho 5 chất: NaOH, HCl, AgNO3, HNO3, Cl2. Số chất tác dụng được với dung dịch Fe(NO3)2 là
Câu 30 :
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearrat và natri oleat. Đốt cháy hoàn toàn m gam X cần vừa đủ 3,22 mol O2, thu được H2O và 2,28 mol CO2. Mặt khác, m gam Xtác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Câu 31 :
Điện phân dung dịch hỗn hợp NaCl và 0,05 mol CuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn). Sau thời gian t giây thì ngừng điện phân, thu được khí ở hai điện cực có tổng thể tích là 2,352 lít (đktc) và dung dịch X. Dung dịch X hòa tan được tối đa 2,04 gam Al2O3. Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là
Câu 32 :
Hỗn hợp E gồm bốn este đều có công thức C8H8O2 và có vòng benzen. Cho 16,32 gam E tác dụng tối đa với V ml dung dịch NaOH 1M (đun nóng), thu được hỗn hợp X gồm các ancol và 18,78 gam hỗn hợp muối. Cho toàn bộ X vào bình đựng kim loại Na dư, sau khi phản ứng kết thúc khối lượng chất rắn trong bình tăng 3,83 gam so với ban đầu. Giá trị của V là
Câu 33 :
Tiến hành các thí nghiệm sau: (a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường (b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH (c) Cho KMnO4 vào dung dịch HCl đặc, dư (d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư (e) Cho CuO vào dung dịch HNO3 (f) Cho KHS vào dung dịch NaOH vừa đủ Số thí nghiệm thu được 2 muối là
Câu 34 :
Hợp chất hữu cơ X (C8H15O4N) tác dụng với dung dịch NaOH dư, đun nóng, thu được sản phẩm hữu cơ gồm muối đinatri glutamat và ancol. Số công thức cấu tạo của X là
Câu 35 :
Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít khí (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối hơi của Z so với H2 là 16. Giá trị của m là
Câu 36 :
Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn B và 10,08 lít khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lít hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở đktc. Giá trị của m gần nhất với :
Câu 37 :
Điện phân dung dịch X gồm Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2,5A. Sau t giây, thu được 7,68 gam kim loại ở catot, dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối hơi so với H2 bằng 25,75. Mặt khác, nếu điện phân X trong thời gian 12352 giây thì tổng số mol khí thu được ở hai điện cực là 0,11 mol. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Số mol ion Cu2+ trong Y là
Câu 38 :
Cho X, Y là hai axit cacboxylic đơn chức, mạch hở, phân tử đều có chứa hai liên kết π; Z là ancol hai chức có cùng số nguyên tử cacbon với X; T là este được tạo bởi X, Y và Z. Đốt cháy hoàn toàn m gam hỗn hợp E gồm X, Y, Z và T cần vừa đủ 28,56 lít O2 (đktc), thu được 45,1 gam CO2 và 19,8 gam H2O. Mặt khác, m gam E tác dụng với tối đa 16 gam Br2 trong dung dịch. Nếu cho m gam E tác dụng hết với dung dịch NaOH (dư, đun nóng) thì thu được bao nhiêu gam muối?
Câu 39 :
Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp Z gần nhất với giá trị nào sau đây?
Câu 40 :
Cho hỗn hợp E gồm 0,1 mol X (C5H11O4N) và 0,15 mol Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được một ancol đơn chức, hai amin no (kế tiếp trong dãy đồng đẳng) và dung dịch T. Cô cạn T, thu được hỗn hợp G gồm ba muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có hai muối của hai axit cacboxylic và muối của một α-amino axit). Phần trăm khối lượng của muối có phân tử khối lớn nhất trong G là
Lời giải và đáp án
Câu 1 :
Trong các kim loại: Al, Mg, Fe và Cu, kim loại có tính khử mạnh nhất là
Đáp án : A Phương pháp giải :
Ghi nhớ dãy điện hóa của kim loại, tính kim loại càng mạnh thì tính khử càng mạnh
Lời giải chi tiết :
Mg là kim loại có tính khử mạnh nhất
Câu 2 :
Chất nào sau đây là muối axit
Đáp án : A Phương pháp giải :
Dựa vào định nghĩa của muối axit: là muối mà trong phân tử còn nguyên tử H co khả năng phân li cho ra H+ Lời giải chi tiết :
NaHSO4 là muối axit
Câu 3 :
Đốt cháy hoàn toàn 0,16 mol hỗn hợp X gồm CH4, C2H2, C2H4 và C3H6, thu được 6,272 lít CO2(đktc) và 6,12 gam H2O. Mặt khác 10,1 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Đáp án : D Phương pháp giải :
áp dụng công thức khi đốt cháy một hợp chất hữu cơ X có độ bất bão hòa k có: \({n_X} = {{{n_{C{O_2}}} - {n_{{H_2}O}}} \over {k - 1}} \Rightarrow k = ?\) Đặt công thức chung của X là: CxHy => nBr2 = nliên kết pi bị phá vỡ = k.nX = ? (mol) \( \Rightarrow \left\{ \matrix{ Lời giải chi tiết :
nCO2 = 6,272 :22,4 = 0,28 (mol) nH2O = 6,12 :18 = 0,34 (mol) áp dụng công thức khi đốt cháy một hợp chất hữu cơ X có độ bất bão hòa k có: \({n_X} = {{{n_{C{O_2}}} - {n_{{H_2}O}}} \over {k - 1}} \Rightarrow 0,16 = {{0,28 - 0,34} \over {k - 1}} \Rightarrow k = 0,625\) Đặt công thức chung của X là: CxHy \( \Rightarrow \left\{ \matrix{ CTPT chung của X là: C1,75H4,25 Xét 10,1 g X hay 0,4 mol X phản ứng với a mol dd Br2 => nBr2 = nliên kết pi bị phá vỡ = k.nX = 0,625.0,4 = 0,25 (mol)
Câu 4 :
Thuốc thử dùng để phân biệt giữa axit axetic và rượu etylic là
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học khác nhau của 2 chất để chọn thuốc thử phù hợp. Lời giải chi tiết :
Cho quỳ tím lần lượt vào axit axetic và rượu etylic + Qùy tím chuyển sang màu đỏ là axit axetic, còn lại quỳ tím không chuyển màu là rượu etylic
Câu 5 :
Đốt cháy hoàn toàn amin X (no, đơn chức, mạch hở), thu được 0,2 mol CO2 và 0,05 mol N2. Công thức phân tử X là
Đáp án : C Phương pháp giải :
Đặt công thức của amin no, đơn chức, mạch hở là: CnH2n+3N. BTNT “N”: nCnH2n+3N = 2nN2 = ? (mol) => n = nCO2/ nX = ? => CTPT của X Lời giải chi tiết :
Đặt công thức của amin no, đơn chức, mạch hở là: CnH2n+3N. BTNT “N”: nCnH2n+3N = 2nN2 = 2. 0,05 = 0,1 (mol) => n = nCO2/ nX = 0,2/0,1 = 2 => CTPT của X: C2H7N
Câu 6 :
Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
Đáp án : A Phương pháp giải :
Điều chế kim loại bằng phương pháp thủy luyện là dùng kim loại mạnh hơn để đẩy kim loại yếu hơn ra khỏi muối của chúng (từ Mg trở về sau) Lời giải chi tiết :
Fe đứng trước Cu trong dãy điện hóa học nên đẩy được Cu2+ ra khỏi muối của chúng Fe + CuSO4 → FeSO4 + Cu↓
Câu 7 :
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
Đáp án : B Phương pháp giải :
Ghi nhớ các loại phân bón hóa học Phân lân: cung cấp P Phân đạm: cung cấp N Phân kali: cung cấp K Lời giải chi tiết :
Phân lân cung cấp cho cây trồng nguyên tố photpho
Câu 8 :
Chất nào sau đây tác dụng được với dung dịch AgNO3 trong NH3?
Đáp án : C Phương pháp giải :
Các ank -1 –in đều tác dụng được với dd AgNO3/NH3 Lời giải chi tiết :
Propin (CH≡C-CH3) có phản ứng với AgNO3/NH3 tạo kết tủa vàng CH≡C-CH3 + AgNO3 + NH3 + H2O → CAg≡C-CH3↓ + NH4NO3
Câu 9 :
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
Đáp án : B Phương pháp giải :
Cho Ag và Al phản ứng với HCl dư, chỉ có Al tham gia phản ứng Tính toán mol Al theo mol H2 dựa vào PT: 2Al + 6HCl → 2AlCl3 +3H2↑ %Al = (mAl/ mhh).100% = ? Lời giải chi tiết :
nH2(ĐKTC) = 3,36 : 22,4 = 0,15 (mol) Cho Ag và Al phản ứng với HCl dư, chỉ có Al tham gia phản ứng 2Al + 6HCl → 2AlCl3 +3H2↑ 0,1 ← 0,15 (mol) => mAl = 0,1.27 = 2,7 (g) %Al = (mAl/ mhh).100% = (2,7/5).100% = 54,0%
Câu 10 :
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
Đáp án : D Phương pháp giải :
Ghi nhớ sự đổi màu của quỳ tím + Môi trường axit chuyển sang màu đỏ + Môi trường bazo chuyển sang màu xanh Lời giải chi tiết :
Dd NH3 có môi trường bazo nên làm quỳ tím chuyển sang màu xanh
Câu 11 :
Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ), thu được H2 ở catot. (b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu. (c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có thể xuất hiện ăn mòn điện hóa. (d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag. (e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl. Số phát biểu đúng là
Đáp án : D Phương pháp giải :
Xem lại lý thuyết về điện phân, đại cương kim loại, lý thuyết về C và hợp chất của C Lời giải chi tiết :
(a) đúng \(2NaCl + 2{H_2}O\buildrel {} \over\longrightarrow 2NaOH + C{l_2}(anot) + {H_2}(catot)\) (b) Sai vì CO không khử được Al2O3 (c) đúng vì khi đó hình thành 2 cặp oxi hóa khử khác nhau là Zn2+/Zn và Cu2+/Cu cùng nhúng trong 1 dung dịch chất điện li là H2SO4 => hình thành ăn mòn điện hóa. (d) đúng (e) đúng, 3AgNO3 + FeCl2 → Fe(NO3)3 + 2AgCl↓ + Ag↓ => có 4 phát biểu đúng
Câu 12 :
Fructozơ là một loại monosaccarit có nhiều trong mật ong, có vị ngọt sắc. Công thức phân tử của fructozơ là
Đáp án : C Lời giải chi tiết :
Công thức phân tử của fructozơ là C6H12O6.
Câu 13 :
Polime nào sau đây thuộc loại polime thiên nhiên?
Đáp án : B Phương pháp giải :
Dựa vào sự phân loại của polime + polime thiên nhiên: tơ tằm, bông, len sơi + polime bán tổng hợp: tơ visco, tơ axetat + polime tổng hợp: các loại còn lại Lời giải chi tiết :
Polime thuộc loại polime thiên nhiên là tơ tằm
Câu 14 :
Dẫn khí CO dư qua ống sứ đựng 8 gam bột CuO nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án : A Phương pháp giải :
BTNT C: nCaCO3 = nCO2 = nO(trong CuO) Lời giải chi tiết :
nCuO = 8 : 80 = 0,1 (mol) CO + CuO \(\xrightarrow{{{t^0}}}\) Cu + CO2 0,1 → 0,1 (mol) Hỗn hợp khí X có CO2 và CO dư, khi cho qua dung dịch nước vôi trong dư chỉ có CO2 tham gia phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O 0,1 → 0,1 (mol) => mkết tủa = mCaCO3 = 0,1.100 = 10 (g)
Câu 15 :
Một số loại khẩu trang y tế chứa hoạt chất bột màu đen có khả năng lọc không khí. Chất đó là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức ứng dụng của cacbon Lời giải chi tiết :
Than hoạt tính là chất thường được sử dụng trong khẩu trang y tế do khả năng hấp phụ tốt nên có thể lọc không khí
Câu 16 :
Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1:1 tạo ra chất Z tan trong nước. Chất Z là
Đáp án : A Phương pháp giải :
Suy luận Lời giải chi tiết :
\(2NaCl + 2{H_2}O\buildrel {} \over Dd X là NaOH CO2 dư + 2NaOH → NaHCO3 Dd Y là NaHCO3 + Ca(OH)2 theo tỉ lệ 1:1 NaHCO3 + Ca(OH)2 → CaCO3↓ + NaOH + H2O Z tan trong nước => Z là NaOH
Câu 17 :
ở nhiệt độ thường, chất nào sau đây làm mất màu dung dịch nước Br2?
Đáp án : A Phương pháp giải :
Các chất có cấu tạo phân tử có liên kết đôi mạch ngoài C=C đều có pư với Br2 ở nhiệt độ thường Lời giải chi tiết :
Eilen làm mất màu dd nước Br2 ở nhiệt độ thường CH2=CH2 + Br2 → CH2Br-CH2Br
Câu 18 :
Đốt cháy hoàn toàn hỗn hợp metyl axetat và etyl axetat, thu được CO2 và m gam H2O. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 25 gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
BTNT “C” nCO2 = nCaCO3 = ? (mol) Đốt cháy CH3COOCH3 và CH3COOC2H5 đều thu được số mol H2O = mol CO2 Lời giải chi tiết :
Đốt cháy CH3COOCH3 và CH3COOC2H5 đều thu được số mol H2O = mol CO2 BTNT “C” nCO2 = nCaCO3 = 25:100 =0,25 (mol) => nH2O = nCO2 = 0,25 (mol) => m = mH2O = 0,25.18 = 4,5 (g)
Câu 19 :
Lên men m gam glucozơ thành ancol etylic với hiệu suất 50%, thu được 4,48 lít CO2. Giá trị của m là
Đáp án : D Phương pháp giải :
C6H12O6 \(\buildrel {len\,men} \over\longrightarrow \)2CO2 + 2C2H5 Vì %H =50% => mC6H12O6 thực tế = mC6H12O6 lí thuyết :%H = ? Lời giải chi tiết :
nCO2(ĐKTC) = 4,48:22,4 = 0,2 (mol) C6H12O6 \(\buildrel {len\,men} \over\longrightarrow \)2CO2 + 2C2H5OH 0,1 ← 0,1 (mol) => mC6H12O6 lí thuyết = 0,1.180 = 18 (g) Vì %H =50% => mC6H12O6 thực tế = mC6H12O6 lí thuyết .100% :%H = 18 :0,5 = 36 (g)
Câu 20 :
Cho axit acrylic tác dụng với ancol đơn chức X, thu được este Y. Trong Y, oxi chiếm 32% về khối lượng. Công thức của Y là
Đáp án : C Phương pháp giải :
Đặt công thức của ancol đơn chức là ROH PTHH: CH2=CH-COOH + ROH → CH2=CH-COOR + H2O \(\% O = {{32} \over {71 + R}}.100\% = 32 \Rightarrow R = ?\) Lời giải chi tiết :
Đặt công thức của ancol đơn chức là ROH PTHH: CH2=CH-COOH + ROH → CH2=CH-COOR + H2O \(\% O = {{32} \over {71 + R}}.100\% = 32 \Rightarrow R = 29\,\,({C_2}{H_5} - )\) Vậy CTCT của Y là: CH2=CH-COOC2H5 hay C2H3COOC2H5
Câu 21 :
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a,b,c,d,e là những số nguyên, đơn giản nhất. Tổng (a+b) bằng:
Đáp án : C Phương pháp giải :
Cân bằng phương trình bằng phương pháp ion electron Lời giải chi tiết :
=> tổng hệ số a +b = 1 +4 = 5
Câu 22 :
Polime nào sau đây được tổng hợp bằng phản ứng trùng hợp?
Đáp án : A Phương pháp giải :
Dựa vào định nghĩa: + Trùng hợp: là quá trình kết hợp nhiều phân tử nhỏ(monome) giống nhau hay tương tự nhau thành phân tử lớn (polime) + Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ(monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác (như H2O…) Lời giải chi tiết :
Poli (vinyl clorua) được điều chế bằng pư trùng hợp Nilon -6,6, Poli (etylen terephtalat) được điều chế bằng pư trùng ngưng.
Câu 23 :
Thực hiện thí nghiệm điều chế khí X, khí X thu được vào bình tam giác theo hình vẽ bên.
Thí nghiệm đó là
Đáp án : A Phương pháp giải :
Ta thấy khí X thu bằng cách úp bình => khí X có phân tử khối nhẹ hơn không khí Lời giải chi tiết :
Ta thấy khí X thu bằng cách úp bình => khí X có phân tử khối nhẹ hơn không khí A. H2SO4 + Zn → ZnSO4 + H2↑ B. 2HCl + CaCO3↓ → CaCl2 + CO2↑ + H2O C. 14HCl đặc + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O D. 2H2SO4 đặc + Cu → CuSO4 + SO2↑ + 2H2O Trong tất cả các khí trên, chỉ có H2 là khí thỏa mãn nhẹ hơn không khí
Câu 24 :
Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 2 mol Gly, 2 mol Ala và 1 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Gly- Ala- Val). Số công thức cấu tạo phù hợp với tính chất của X là
Đáp án : C Phương pháp giải :
Bước 1: Xác định số mắt xích có trong X Thuỷ phân 1mol X thu được 2 Gly, 2 Ala, 1 Val ⟹ X là pentapeptit. Bước 2: Biện luận tìm CTCT phù hợp - Thủy phân không hoàn toàn peptit thu được Gly- Ala- Val và không có Gly-Gly => Trong trật tự sắp xếp của peptit bắt buộc phải có cấu tạo theo thứ tự Gly - Ala- Val Lời giải chi tiết :
Bước 1: Xác định số mắt xích có trong X - 1 phân tử X chứa 2 Gly, 2 Ala, 1 Val ⟹ X là pentapeptit. Bước 2: Biện luận tìm CTCT phù hợp - X thủy phân không hoàn toàn tạo Gly-Ala-Val nên các công thức cấu tạo thỏa mãn là: Gly – Ala – Val−Ala – Gly Gly – Ala – Val−Gly – Ala Gly- Gly – Ala – Val−Ala Ala – Gly – Ala – Val – Gly Gly –Ala - Gly – Ala – Val Ala – Gly - Gly – Ala – Val. Vậy có tất cả 6 công thức cấu tạo phù hợp với tính chất của X.
Câu 25 :
Thực hiện các thí nghiệm sau: (a) Sục khí CH3NH2 vào dung dịch CH3COOH. (b) Đun nóng tinh bột trong dung dịch H2SO4 loãng. (c) Sục khí H2 vào nồi kín chứa triolein (xúc tác Ni), đun nóng. (d) Nhỏ vài giọt nước brom vào dung dịch anilin. (e) Cho dung dịch HCl vào dung dịch axit glutamic.(g) Cho dung dịch metyl fomat vào dung dịch AgNO3 trong NH3, đun nóng. Số thí nghiệm xảy ra phản ứng là
Đáp án : C Phương pháp giải :
Xem lại lý thuyết về cacbohidrat, amin, lipt và este Lời giải chi tiết :
Các thí nghiệm xảy ra phản ứng là (a) CH3NH2 + CH3COOH → CH3COONH3CH3 (b) (C6H10O5)n\(\buildrel {{H_2}S{O_4}\,} \over\longrightarrow \) nC6H12O6 (glucozo) (c) 3H2 + (C17H33COO)3C3H5 \(\buildrel {Ni,{t^0}\,} \over\longrightarrow \) (C17H35COO)3C3H5 (d) C6H5NH2 + 3Br2 → 2,4,6- tri brom anlanin + 3HBr (e) HCl + HOOC-[CH2]2-CH(NH2)-COOH → HOOC-[CH2]2-CH(NH3Cl)-COOH (g) HCOOCH3 + 2AgNO3 + 2NH3 + H2O\(\buildrel {{t^0}\,} \over\longrightarrow \) NH4OOCCH3 + 2Ag↓ + NH4NO3 => cả 6 thí nghiệm đều xảy ra pư
Câu 26 :
Đun nóng 48,2 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gia thu được 43,4 gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, sau phản ứng thu được 15,12 lít Cl2(đktc) và dung dịch gồm MnCl2, KCl và HCl dư.Số mol HCl phản ứng là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng: mO2 = mX - mY Bảo toàn e: ne(Mn+7, Cl+5) nhường = ne (O2, Cl2) nhận BTNT Mn, K, Cl Lời giải chi tiết :
\(X\left\{ \matrix{ BTKL ta có: mO2 = mX – mY = 48,2 -43,4 = 4,8 (g) => nO2= 0,15(mol) Trong X đặt số mol KMnO4 và KClO3 lần lượt là a và b (mol) Ta có: \(\left\{ \matrix{ BTNT “Mn”: nMnCl2 = nKMnO4 = 0,15 (mol) BTNT “K’: nKCl = nKMnO4 + nKClO3 = 0,15 + 0,2 = 0,35 (mol) BTNT “Cl”: nKClO3 + nHCl = 2nMnCl2 + nKCl + 2nCl2 => nHCl = 2.0,15 + 0,35 +2.0,675 – 0,2 = 1,8 (mol)
Câu 27 :
Tiến hành thí nghiệm với các dung dịch X, Y, Z và T. Kết quả được ghi ở bảng sau:
X, Y, Z, T lần lượt là
Đáp án : C Phương pháp giải :
Suy luận kết hợp với đáp án Lời giải chi tiết :
X,Z tạo kết tủa Ag với AgNO3/NH3, Z còn tạo dd màu xanh lam với Cu(OH)2 => X là Etyl fomat và Z là glucozơ Y làm quỳ tím chuyển sang màu xanh => Y có môi trường bazo => Y là Lysin T tạo kết tủa trắng với dd Br2 => T là anilin hoặc phenol Từ đáp án X, Y, Z, T thỏa mãn lần lượt là: Etyl fomat, lysin, glucozơ, phenol
Câu 28 :
Este X có công thức phân tử C6H10O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được ba chất hữu cơ Y, Z, T. Biết Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam. Nung nóng Z với hỗn hợp rắn gồm NaOH và CaO, thu được CH4. Phát biểu nào sau đây sai ?
Đáp án : D Phương pháp giải :
Este X có CTPT C6H10O4 có độ bất bão hòa = 2 => este 2 chức Y + Cu(OH)2 => Dung dịch xanh lam nên Y là ancol 2 chức có OH kề nhau. => Y, Z là các muối đơn chức. Z+ NaOH/CaO → CH4 nên Z là CH3COONa X là CH3COO-CH2-CH(CH3)-OOC-H hoặc HCOO-CH2- CH(CH3)-OOC-CH3. Y là CH2OH-CH(CH3)OH T là HCOONa Từ đó xét kết luận đúng, sai Lời giải chi tiết :
Este X có CTPT C6H10O4 có độ bất bão hòa = 2 => este 2 chức Y + Cu(OH)2 => Dung dịch xanh lam nên Y là ancol 2 chức có OH kề nhau. => Y, Z là các muối đơn chức. Z+ NaOH/CaO → CH4 nên Z là CH3COONa X là CH3COO-CH2-CH(CH3)-OOC-H hoặc HCOO-CH2- CH(CH3)-OOC-CH3. Y là CH2OH-CH(CH3)OH T là HCOONa A. Đúng B. Đúng C. Đúng D. Sai, Y mạch thẳng
Câu 29 :
Cho 5 chất: NaOH, HCl, AgNO3, HNO3, Cl2. Số chất tác dụng được với dung dịch Fe(NO3)2 là
Đáp án : C Lời giải chi tiết :
Tất cả 5 chất đều có pư với Fe(NO3)2 2NaOH + Fe(NO3)2 → Fe(OH)2↓ + NaNO3 12HCl + 9Fe(NO3)2 → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ 4HNO3 + 3Fe(NO3)2 → 3Fe(NO3)3 + NO + H2O 3Cl2 + 6Fe(NO3)2 → 2Fe(NO3)3 + 2FeCl3
Câu 30 :
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearrat và natri oleat. Đốt cháy hoàn toàn m gam X cần vừa đủ 3,22 mol O2, thu được H2O và 2,28 mol CO2. Mặt khác, m gam Xtác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Đáp án : D Phương pháp giải :
X chứa 1 gộc stearat + 2 gốc oleat hoặc 2 gốc stearat và 1 gốc oleat => dù là trường hợp nào thì X cũng có 18 C => Gọi CTPT chung của X có dạng: C57HyO6 => nX= nCO2/57 = 2,28/57 = 0,04 (ol) BTNT “O”: 6.nX + 2nO2 = 2nCO2 + nH2O => nH2O = ? (mol) => y = số nguyên tử H = 2nH2O/nX = ? => Độ bất bão hòa của X là: \(k = {{2.57 + 2 - y} \over 2} = ?\) => số liên kết pi C=C có trong X là: 8 – pi (COO) = ? => số mol Br2 pư = số mol liên kết pi phá vỡ C=C = ? Lời giải chi tiết :
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearrat và natri oleat. => X chứa 1 gộc stearat + 2 gốc oleat hoặc 2 gốc stearat và 1 gốc oleat => dù là trường hợp nào thì X cũng có 18 C => Gọi CTPT chung của X có dạng: C57HyO6 C57HyO6 + 3,22 mol O2 → 2,28 molCO2 + 0,5y H2O => nX= nCO2/57 = 2,28/57 = 0,04 (ol) BTNT “O”: 6.nX + 2nO2 = 2nCO2 + nH2O => nH2O = 6.0,04 +2.3,22 – 2.2,28 = 2,12 (mol) => y = số nguyên tử H = 2nH2O/nX = 2.2,12/0,04 = 106 => CTPT của X: C57H106O6 => Độ bất bão hòa của X là: \(k = {{2.57 + 2 - 106} \over 2} = 8\) => số liên kết pi C=C có trong X là: 8 – pi (COO) = 8 – 6 = 2 => số mol Br2 pư = số mol liên kết pi phá vỡ = 2.0,04 = 0,08 (mol) = a
Câu 31 :
Điện phân dung dịch hỗn hợp NaCl và 0,05 mol CuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn). Sau thời gian t giây thì ngừng điện phân, thu được khí ở hai điện cực có tổng thể tích là 2,352 lít (đktc) và dung dịch X. Dung dịch X hòa tan được tối đa 2,04 gam Al2O3. Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là
Đáp án : B Phương pháp giải :
TH1: X chứa H+ => Cl- điện phân hết trước Cu2+ => a < 2nCu2+ Cu2+ + 2Cl- → Cu + Cl2 Cu2+ + H2O → Cu + 2H+ + 0,5O2 H2O → H2 + 0,5O2 Thấy trường hợp này vô lí vì nCu bị đp > nCu ban đầu => loại TH2: X chứa OH- => Cu2+ điện phân hết trước Cl- => a > 2nCu2+ (1) Cu2+ + 2Cl- → Cu + Cl2 (2) Cl- + H2O → 0,5Cl2 + 0,5H2 + OH- (3) H2O → H2 + 0,5O2 Lời giải chi tiết :
nAl2O3 = 0,02 mol; Đặt nNaCl = a mol TH1: X chứa H+ => Cl- điện phân hết trước Cu2+ => a < 2nCu2+ = 0,04 mol => nH+ = 6nAl2O3 = 1,2 mol Cu2+ + 2Cl- → Cu + Cl2 a →0,5a→0,5a Cu2+ + H2O → Cu + 2H+ + 0,5O2 0,6←1,2 H2O → H2 + 0,5O2 Thấy trường hợp này vô lí vì nCu bị đp = 0,5a + 0,6 > nCu ban đầu => loại TH2: X chứa OH- => Cu2+ điện phân hết trước Cl- => a > 2nCu2+ = 0,04 mol nOH- = 2nAl2O3 = 0,04 mol (1) Cu2+ + 2Cl- → Cu + Cl2 0,05 → 0,1 → 0,05 (2) Cl- + H2O → 0,5Cl2 + 0,5H2 + OH- 0,02← 0,02 ←0,04 (3) H2O → H2 + 0,5O2 x x 0,5x Khí gồm: Cl2 (0,07 mol); H2 (x + 0,02 mol) và O2 (0,5x mol) => n khí = nCl2 + nH2 + nO2 = 1,5x + 0,09 = 0,105 => x = 0,01 => n e = 2nCl2(1) + 2nH2 (2) + 2nH2 (3) = 0,05.2 + 0,02.2 + 0,01.2 = 0,16 mol => t = ne.F/I = 0,16.96500/2 = 7720 giây
Câu 32 :
Hỗn hợp E gồm bốn este đều có công thức C8H8O2 và có vòng benzen. Cho 16,32 gam E tác dụng tối đa với V ml dung dịch NaOH 1M (đun nóng), thu được hỗn hợp X gồm các ancol và 18,78 gam hỗn hợp muối. Cho toàn bộ X vào bình đựng kim loại Na dư, sau khi phản ứng kết thúc khối lượng chất rắn trong bình tăng 3,83 gam so với ban đầu. Giá trị của V là
Đáp án : A Phương pháp giải :
Ta thấy C8H8O2 có các đồng phân este là: HCOOCH2C6H5 C6H5COOCH3 HCOOC6H4CH3 (o,m,p) Do cho E tác dụng với NaOH thu được các ancol nên E chứa HCOOCH2C6H5, C6H5COOCH3 và 2 este còn lại đều có công thức là HCOOC6H4CH3 (o,m hoặc m,p hoặc o,p) Coi E chứa HCOOCH2C6H5 (x mol), C6H5COOCH3 (y mol), HCOOC6H4CH3 (z mol) Dựa vào các dữ kiện đề bài để lập hệ phương trình. Lời giải chi tiết :
Ta thấy C8H8O2 có các đồng phân este là: HCOOCH2C6H5 C6H5COOCH3 HCOOC6H4CH3 (o,m,p) Do cho E tác dụng với NaOH thu được các ancol nên E chứa HCOOCH2C6H5, C6H5COOCH3 và 2 este còn lại đều có công thức là HCOOC6H4CH3 (o,m hoặc m,p hoặc o,p) Coi E chứa HCOOCH2C6H5 (x mol), C6H5COOCH3 (y mol), HCOOC6H4CH3 (z mol) + nE = x + y + z = 16,32 : 136 = 0,12 mol (1) + X chứa: C6H5CH2OH (x mol) CH3OH (y mol) nH2 = 0,5x + 0,5y (mol) m bình tăng = m ancol – mH2 = 108x + 32y – 2.(0,5x+0,5y) = 3,83 (2) + Muối gồm: HCOONa (x + z mol); C6H5COONa (y mol) và CH3C6H4ONa (z mol) => m muối = 68(x+z) + 144y + 130z = 18,78 (3) Giải (1) (2) (3) được x = 0,03; y = 0,02; z = 0,07 nNaOH = x + y + 2z = 0,19 mol => V = 190ml
Câu 33 :
Tiến hành các thí nghiệm sau: (a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường (b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH (c) Cho KMnO4 vào dung dịch HCl đặc, dư (d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư (e) Cho CuO vào dung dịch HNO3 (f) Cho KHS vào dung dịch NaOH vừa đủ Số thí nghiệm thu được 2 muối là
Đáp án : D Phương pháp giải :
Viết PTHH để suy ra những phản ứng thu được dung dịch chứa 2 muối. Lời giải chi tiết :
(a) Cl2 + 2NaOH → NaCl + NaClO + H2O => thu được 2 muối NaCl, NaClO (b) nNaOH : nCO2 = 3 : 2 = 1,5 => thu được NaHCO3 và Na2CO3 2NaOH + CO2 → Na2CO3 + H2O NaOH + CO2 → NaHCO3 (c) 2KMnO4 + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O => thu được 2 muối KCl, MnCl2 (d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư Fe2O3 + 6HCl → 2FeCl3 + 3H2O 2 4 Cu + 2FeCl3 → 2FeCl2 + CuCl2 1 → 2 dư 2 → 2 → 1 => Thu được 3 muối là FeCl3, FeCl2, CuCl2 (e) CuO + 2HNO3 → Cu(NO3)2 + H2O => thu được 1 muối là Cu(NO3)2 (f) 2KHS + 2NaOH → Na2S + K2S + 2H2O => thu được 2 muối là K2S và Na2S Vậy có 4 phản ứng thu được 2 muối
Câu 34 :
Hợp chất hữu cơ X (C8H15O4N) tác dụng với dung dịch NaOH dư, đun nóng, thu được sản phẩm hữu cơ gồm muối đinatri glutamat và ancol. Số công thức cấu tạo của X là
Đáp án : B Phương pháp giải :
Viết các đồng phân cấu tạo thỏa mãn các dữ kiện đề bài. + 2 chức este + 1 chức este và 1 chức axit Lời giải chi tiết :
Các công thức cấu tạo thỏa mãn của X là:
Câu 35 :
Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít khí (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối hơi của Z so với H2 là 16. Giá trị của m là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố Bảo toàn điện tích Lời giải chi tiết :
Tính được nNO = 0,09 mol và nN2O = 0,015 mol \(\left\{ \begin{gathered} + BTNT “N”: 0,15.2 = c + d + 0,09 + 0,015.2 (1) + m muối = 56.0,25 + 27b + 18c + 62d + 0,61.35,5 = 47,455 (2) + BTNT “H” => nH2O = (nHCl – 4nNH4+)/2 = 0,305 – 2c (mol) BTNT “O”: 0,15.6 = 3d + 0,09 + 0,015 + 0,305 – 2c (3) + BTĐT: 2a + 3(0,25-a) + 3b + c = d + 0,61 (4) Giải (1) (2) (3) (4) được a = 0,1; b = 0,04; c = 0,01; d = 0,17 => m = mAl = 0,04.27 = 1,08 gam
Câu 36 :
Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn B và 10,08 lít khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lít hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở đktc. Giá trị của m gần nhất với :
Đáp án : D Phương pháp giải :
+) Tính nN2 và nH2 Trong Y chứa khí H2 chứng tỏ NO3- hết Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl Bảo toàn Clo => ${{n}_{N{{H}_{4}}Cl}}$ theo a Bảo toàn H : ${{n}_{{{H}_{2}O}}}~=\frac{1}{2}.\left( {{n}_{HCl}}+4{{n}_{N{{H}_{4}}Cl}}\text{-}2{{n}_{{{H}_{2}}}} \right)$ Bảo toàn O : ${{n}_{O}}{{~}_{(Cu{{\left( N{{O}_{3}} \right)}_{2}})}}={{n}_{O\,(D)}}+{{n}_{O\,({{H}_{2}}O)}}~\Rightarrow a$ => m Lời giải chi tiết :
nD = 0,45 => nO (D) = 0,9 mol nY = 0,05 mol Đặt ${{n}_{{{N}_{2}}}}~=x\text{ }\Rightarrow \text{ }{{n}_{{{H}_{2}}}}=0,05x$ => 28x + 2.(0,05 – x) = 0,05.11,4.2 = 1,14 => x = 0,04 mol => nN2 = 0,04 mol và nH2 = 0,01 mol Trong Y chứa khí H2 chứng tỏ NO3- hết Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl Bảo toàn Clo : ${{n}_{N{{H}_{4}}Cl}}$ = 1,3 – 2a – 0,5 = 0,8 – 2a Bảo toàn H : ${{n}_{{{H}_{2}O}}}~=\frac{1}{2}.\left( {{n}_{HCl}}+4{{n}_{N{{H}_{4}}Cl}}\text{-}2{{n}_{{{H}_{2}}}} \right)=4a-0,96$ Bảo toàn O : ${{n}_{O}}{{~}_{(Cu{{\left( N{{O}_{3}} \right)}_{2}})}}={{n}_{O\,(D)}}+{{n}_{O\,({{H}_{2}}O)}}~\Rightarrow \text{ }0,25.6=0,9+4a-0,96$ => a = 0,39 mol => m = 0,39.95 + 0,25.135 + (0,8 – 2.0,39).53,5 = 71,87 gam
Câu 37 :
Điện phân dung dịch X gồm Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2,5A. Sau t giây, thu được 7,68 gam kim loại ở catot, dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối hơi so với H2 bằng 25,75. Mặt khác, nếu điện phân X trong thời gian 12352 giây thì tổng số mol khí thu được ở hai điện cực là 0,11 mol. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Số mol ion Cu2+ trong Y là
Đáp án : D Phương pháp giải :
*t giây: nCu = 0,12 mol Catot: Cu2+ điện phân chưa hết Cu2+ + 2e → Cu Anot: Cl- bị điện phân hết, H2O đã bị điện phân Cl- → 0,5Cl2 + 1e H2O → 2H+ + 0,5O2 + 2e *t = 12352 giây Anot: Cl- → 0,5Cl2 + 1e H2O → 2H+ + 0,5O2 + 2e Catot: Cu2+ + 2e → Cu H2O + 1e → 0,5H2 + OH- Lời giải chi tiết :
*t giây: nCu = 0,12 mol Catot: Cu2+ điện phân chưa hết Cu2+ + 2e → Cu 0,24 ← 0,12 Anot: Cl- bị điện phân hết, H2O đã bị điện phân Áp dụng đường chéo ta có: Cl2: 71 19,5 51,5 => nCl2 = nO2 O2: 32 19,5 Cl- → 0,5Cl2 + 1e x → 2x H2O → 2H+ + 0,5O2 + 2e x → 4x ne = 2x + 4x = 0,24 => x = 0,04 mol *t = 12352 giây => ne = It/F = 2,5.12352/96500 = 0,32 mol Anot: Cl- → 0,5Cl2 + 1e 0,04 → 0,08 H2O → 2H+ + 0,5O2 + 2e 0,06 ← 0,24 Catot: n khí (catot) = 0,11 – 0,04 – 0,06 = 0,01 mol Cu2+ + 2e → Cu y 2y H2O + 1e → 0,5H2 + OH- 0,02 ← 0,01 => ne = 2y + 0,02 = 0,32 => y = 0,15 mol nCu2+ (Y) = 0,15 – 0,12 = 0,03 mol
Câu 38 :
Cho X, Y là hai axit cacboxylic đơn chức, mạch hở, phân tử đều có chứa hai liên kết π; Z là ancol hai chức có cùng số nguyên tử cacbon với X; T là este được tạo bởi X, Y và Z. Đốt cháy hoàn toàn m gam hỗn hợp E gồm X, Y, Z và T cần vừa đủ 28,56 lít O2 (đktc), thu được 45,1 gam CO2 và 19,8 gam H2O. Mặt khác, m gam E tác dụng với tối đa 16 gam Br2 trong dung dịch. Nếu cho m gam E tác dụng hết với dung dịch NaOH (dư, đun nóng) thì thu được bao nhiêu gam muối?
Đáp án : B Phương pháp giải :
Ta thấy nH2O > nCO2 => Ancol là ancol no, hai chức, mạch hở Quy đổi hỗn hợp E thành: CnH2n-2O2 (= nBr2) CmH2m+2O2 H2O (với n este = -nH2O mol) Lời giải chi tiết :
nO2 = 1,275 mol; nCO2 = 1,025 mol; nH2O = 1,1 mol BTNT “O”: nO(E) = 2nCO2 + nH2O – 2nO2 = 0,6 mol Ta thấy nH2O > nCO2 => Ancol là ancol no, hai chức, mạch hở Quy đổi hỗn hợp E thành: CnH2n-2O2: 0,1 mol (= nBr2) CmH2m+2O2: a mol H2O: -b mol (=> n este = b mol) BTNT “O”: nO = 2.0,1 + 2a – b = 0,6 (1) BTNT “C”: 0,1n + am = 1,025 (2) BTNT “H”: (n-1)0,1 + (m+1)a – b = 1,1 (3) Giải (1) (2) (3) được: a = 0,225 và b = 0,05 Vậy E gồm Este: 0,05/2 = 0,025 Ancol: 0,225 – 0,025 = 0,2 Axit: 0,1 – 0,025.2 = 0,05 Mặt khác ta có: 0,1n + 0,225m = 1,025 => 0,225m < 1,025 => m < 4,46 Mà ancol có số C bằng X nên suy ra: m ≥ 3 => 3 ≤ m < 4 + m = 4 => n = 1,25 (loại) + m = 3 => n = 3,5 (nhận) => X là C3H4O2 và Z là C3H8O2 Gọi số C của Y là k, BTNT “C”: 0,025(3+k+3) + 0,2.3 + 0,05.3,5 = 1,025 => k = 4 => Y là C4H6O2 => nC3H4O2 = nC4H6O2 = 0,025 mol \(E\left\{ \begin{gathered} => m muối = 0,05.94 + 0,05.108 = 10,1 gam
Câu 39 :
Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp Z gần nhất với giá trị nào sau đây?
Đáp án : C Phương pháp giải :
Bảo toàn khối lượng Bảo toàn nguyên tố Lời giải chi tiết :
MZ = 4.23/18 = 5,1 => khí còn lại là H2 Tính được nNO = 0,05 mol và nH2 = 0,4 mol \(66,2(g)X\left\{ \begin{gathered} BTKL: mH2O = 66,2 + 3,1.136 – 466,6 – 0,05.30 – 0,4.2 = 18,9 gam => nH2O = 1,05 mol BTNT “H”: nNH4+ = (nKHSO4 – 2nH2 – 2nH2O)/4 = (3,1 – 0,4.2 – 1,05.2)/4 = 0,05 mol BTNT “N”: nFe(NO3)2 = (nNH4+ + nNO)/2 = (0,05 + 0,05)/2 = 0,05 mol BTNT “O”: nFe3O4 = (4nSO42- + nNO + nH2O - 6nFe(NO3)2 - 4nKHSO4)/4 = 0,2 mol mAl = mX – mFe3O4 – mFe(NO3)2 = 66,2 – 0,2.232 – 0,05.180 = 10,8 gam => %mAl = 10,8/66,2.100% = 16,3% gần nhất với giá trị 15%
Câu 40 :
Cho hỗn hợp E gồm 0,1 mol X (C5H11O4N) và 0,15 mol Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được một ancol đơn chức, hai amin no (kế tiếp trong dãy đồng đẳng) và dung dịch T. Cô cạn T, thu được hỗn hợp G gồm ba muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có hai muối của hai axit cacboxylic và muối của một α-amino axit). Phần trăm khối lượng của muối có phân tử khối lớn nhất trong G là
Đáp án : B Phương pháp giải :
Do thu được 2 amin no kế tiếp nhau trong dãy đồng đẳng nên suy ra Y là C2H5NH3OOC-COONH3CH3 => Muối có 2C => ancol có 1C => CTCT của X Lời giải chi tiết :
Do thu được 2 amin no kế tiếp nhau trong dãy đồng đẳng nên suy ra Y là C2H5NH3OOC-COONH3CH3 => Muối có 2C => ancol có 1C => X là CH3COONH3-CH2-COOCH3 Vậy muối G gồm: KOOC-COOK (0,15 mol) H2N-CH2-COOK (0,1 mol) CH3-COOK (0,1 mol) %m KOOC-COOK = \(\frac{{0,15.166}}{{0,15.166 + 0,1.113 + 0,1.98}}.100\% \) = 54,13% |