Đề thi học kì 2 Hóa 12 - Đề số 1Đề bài
Câu 1 :
Loại thuốc nào sau đây gây nghiện cho con người ?
Câu 2 :
Cho các phương pháp: (1) đun nóng trước khi dùng; (2) dùng dung dịch Ca(OH)2 vừa đủ; (3) dùng dung dịch Na2CO3; (4) dùng dung dịch NaCl; (5) dùng dung dịch HCl. Người ta có thể làm mềm nước cứng tạm thời bằng phương pháp nào ?
Câu 3 :
Cấu hình electron lớp ngoài cùng: ns1 là cấu hình electron của các nguyên tố thuộc nhóm?
Câu 4 :
Cho các phát biểu sau a, Nhôm tan được trong dung dịch NaOH b, Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội. c, Nhôm là kim loại lưỡng tính. d, Nhôm tác dụng với các axit ở tất cả mọi điều kiện. Số phát biểu sai là?
Câu 5 :
Nước giếng ở đồng bằng Bắc bộ thường có nhiều ion Fe2+. Loại nước này dùng để sinh hoạt có nhiều bất tiện như làm quần áo bị ố vàng, ảnh hưởng không tốt đến sức khỏe con người. Biện pháp nào loại bỏ ion Fe2+ ra khỏi nước là đơn giản, rẻ tiền và hiệu quả hơn cả ?
Câu 6 :
Ion nào nào sau đây vừa có tính khử vừa có tính oxi hóa?
Câu 7 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Câu 8 :
Không thể dùng KOH làm khô khí nào sau đây ?
Câu 9 :
Công thức của phèn chua là :
Câu 10 :
Gang là hợp kim của sắt – cacbon và một số nguyên tố khác. Trong đó cacbon chiếm
Câu 11 :
Nguyên tử của nguyên tố sắt có
Câu 12 :
Những kim loại nào có thể điều chế bằng phương pháp nhiệt luyện ?
Câu 13 :
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
Câu 14 :
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
Câu 15 :
Cho 6,8 gam hỗn hợp X gồm Zn và Fe vào 325ml dung dịch CuSO4 0,2M, sau khi phản ứng hoàn toàn, thu được dung dịch và 6,96 gam hỗn hợp kim loại Y. Khối lượng Fe bị oxi khử bởi ion Cu2+ là:
Câu 16 :
Thực hiện các thí nghiệm sau : (1) Thả một viên Fe vào dung dịch HCl. (2) Thả một viên Fe vào dung dịch Cu(NO3)2. (3) Thả một viên Fe vào dung dịch FeCl3. (4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm. (5) Đốt một dây Fe trong bình kín chứa đầy khí O2. (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng. Trong các thí nghiệm trên thì thí nghiệm mà Fe không bị ăn mòn điện hóa là
Câu 17 :
NaCl có lẫn tạp chất NaHCO3. Cách nào sau đây có thể dùng để thu được NaCl tinh khiết ?
Câu 18 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + H2O Hai muối X và Y tương ướng là
Câu 19 :
Cho 3,9 gam Kali tác dụng với 101,8 gam nước. C% của dung dịch thu được là
Câu 20 :
Sục 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M. Sau phản ứng thu được m1 gam kết tủa và dung dịch X. Cho dung dịch X tác dụng với 200 ml dung dịch BaCl2 1,2M; KOH 1,5M thu được m2 gam kết tủa. Giá trị của m2 là:
Câu 21 :
Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là :
Câu 22 :
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
Câu 23 :
Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe2O3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
Câu 24 :
Bằng phương pháp hóa học. Hãy chọn một hóa chất thích hợp để nhận biết các chất rắn (dạng bột) sau: Fe, FeO, Fe3O4, CuO.
Câu 25 :
Hoà tan hết m gam hỗn hợp X gồm Fe, Fe2O3, Fe3O4 trong dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan, giá trị m là:
Câu 26 :
Cho 0,6 mol KI tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được một đơn chất. Tính số mol của đơn chất này.
Câu 27 :
Có 4 chất bột: CaCO3, Na2CO3, BaSO4, Na2SO4. Có thể dùng cặp chất nào sau đây để nhận biết các chất bột đó?
Câu 28 :
Hòa tan hoàn toàn 7,98g hỗn hợp gồm Mg và Al trong dung dịch chứa a mol H2SO4, sau khi kết thúc phản ứng thu được 8,96 lit khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, sự phụ thuộc số mol kết tủa và thể tích dung dịch NaOH 1M được cho như trong đồ thị sau :
Giá trị của a là
Câu 29 :
Nhỏ từ từ từng giọt cho đến hết dung dịch X chứa 0,03 mol KHCO3 và 0,06 mol Na2CO3 vào 200 ml dung dịch hỗn hợp gồm HCl 0,1M và KHSO4 0,3M được dung dịch Y và thấy thoát ra x mol CO2. Thêm dung dịch chứa 0,06 mol NaOH và 0,15 mol BaCl2 vào dung dịch Y thu được m gam kết tủa. Giá trị của x và m lần lượt là
Câu 30 :
Điện phân dung dịch chứa hỗn hợp hai muối CuCl2 và Cu(NO3)2 một thời gian, ở anot của bình điện phân thoát ra 448 ml hồn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot (biết trên catot không có khí thoát ra). Giá trị của m là:
Lời giải và đáp án
Câu 1 :
Loại thuốc nào sau đây gây nghiện cho con người ?
Đáp án : C Phương pháp giải :
xem lại lí thuyết hóa học với các vấn đề về kinh tế, xã hội, môi trường Lời giải chi tiết :
Loại thuốc gây nghiện cho người là moocphin
Câu 2 :
Cho các phương pháp: (1) đun nóng trước khi dùng; (2) dùng dung dịch Ca(OH)2 vừa đủ; (3) dùng dung dịch Na2CO3; (4) dùng dung dịch NaCl; (5) dùng dung dịch HCl. Người ta có thể làm mềm nước cứng tạm thời bằng phương pháp nào ?
Đáp án : D Lời giải chi tiết :
Nước cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2. => đun nóng hoặc dùng dung dịch Ca(OH)2 vừa đủ hoặc Na2CO3 để làm mềm nước cứng tạm thời
Câu 3 :
Cấu hình electron lớp ngoài cùng: ns1 là cấu hình electron của các nguyên tố thuộc nhóm?
Đáp án : A Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là ns1.
Câu 4 :
Cho các phát biểu sau a, Nhôm tan được trong dung dịch NaOH b, Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội. c, Nhôm là kim loại lưỡng tính. d, Nhôm tác dụng với các axit ở tất cả mọi điều kiện. Số phát biểu sai là?
Đáp án : A Phương pháp giải :
xem lại lí thuyết nhôm Lời giải chi tiết :
Nhôm là không phải kim loại lưỡng tính => c sai Nhôm tác dụng với các axit ở tất cả mọi điều kiện. => d sai
Câu 5 :
Nước giếng ở đồng bằng Bắc bộ thường có nhiều ion Fe2+. Loại nước này dùng để sinh hoạt có nhiều bất tiện như làm quần áo bị ố vàng, ảnh hưởng không tốt đến sức khỏe con người. Biện pháp nào loại bỏ ion Fe2+ ra khỏi nước là đơn giản, rẻ tiền và hiệu quả hơn cả ?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết Phân biệt một số chất vô cơ Lời giải chi tiết :
Phương pháp cần dùng ở đây là dùng giàn mưa, tăng diện tích tiếp xúc của nước với O2 không khí để oxi hóa Fe2+ dễ tan thành Fe3+ ít tan kết tủa dạng Fe(OH)3.
Câu 6 :
Ion nào nào sau đây vừa có tính khử vừa có tính oxi hóa?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết crom và hợp chất Lời giải chi tiết :
Ion vửa có tính khử, vừa có tính oxi hóa là Cr3+
Câu 7 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Đáp án : A Lời giải chi tiết :
Dãy gồm các chất đều là kim loại kiềm thổ là Be, Ca, Sr, Ba
Câu 8 :
Không thể dùng KOH làm khô khí nào sau đây ?
Đáp án : C Lời giải chi tiết :
Khí không dùng KOH làm khô được là khí có phản ứng với KOH => khí đó là CO2
Câu 9 :
Công thức của phèn chua là :
Đáp án : A Lời giải chi tiết :
Công thức của phèn chua là : K2SO4.Al2(SO4)3.24H2O
Câu 10 :
Gang là hợp kim của sắt – cacbon và một số nguyên tố khác. Trong đó cacbon chiếm
Đáp án : B Phương pháp giải :
xem lại lí thuyết hợp kim sắt Lời giải chi tiết :
Gang là hợp kim của sắt – cacbon và một số nguyên tố khác. Trong đó cacbon chiếm từ 2 – 5%.
Câu 11 :
Nguyên tử của nguyên tố sắt có
Đáp án : B Lời giải chi tiết :
- Cấu hình electron: 1s22s22p63s23p63d64s2 => sắt có 6 electron d
Câu 12 :
Những kim loại nào có thể điều chế bằng phương pháp nhiệt luyện ?
Đáp án : B Lời giải chi tiết :
Những kim loại có thể điều chế bằng phương pháp nhiệt luyện là kim loại có tính khử trung bình như Zn, Fe, Sn...
Câu 13 :
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
Đáp án : D Phương pháp giải :
Mg + 2HCl → MgCl2 + H2 ̣(1) a → 2a → a → a Fe + 2HCl → FeCl2 + H2 (2) 1 → 2 → 1 → 1 +) Từ (1) , (2) => mdung dịch HCl => mdung dịch Y = mX + mdung dịch HCl – mH2 Lời giải chi tiết :
Giả sử nMg = a mol và nFe = 1 mol Mg + 2HCl → MgCl2 + H2 a → 2a → a → a Fe + 2HCl → FeCl2 + H2 1 → 2 → 1 → 1 => mHCl = (2a + 2).36,5 => mdung dịch HCl = (2a + 2).36,5 / 20% = 365a + 365 => mdung dịch Y = mX + mdung dịch HCl – mH2 = 24a + 56 + 365a + 365 – (a + 1).2 = 387a + 419 $ \to \,\,C{\% _{FeC{l_2}}} = \dfrac{{127}}{{387a + 419}}.100\% = 15,76\% \,\,\, \to \,\,a\, = 1$ $ \to \,\,C{\% _{MgC{l_2}}} = \dfrac{{95}}{{387 + 419}}.100\% = 11,79\% $
Câu 14 :
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án : C Phương pháp giải :
Sử dụng dãy điện hóa Lời giải chi tiết :
X là kim loại phản ứng được với dung dịch H2SO4 → X có tính khử mạnh hơn H+ trong dãy điện hóa → loại đáp án A và B Y là kim loại tác dụng được với dung dịch Fe(NO3)3 → Y có tính khử mạnh hơn Fe3+ trong dãy điện hóa → loại đáp án D Phương trình phản ứng : Fe + H2SO4 → FeSO4 + H2 Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Câu 15 :
Cho 6,8 gam hỗn hợp X gồm Zn và Fe vào 325ml dung dịch CuSO4 0,2M, sau khi phản ứng hoàn toàn, thu được dung dịch và 6,96 gam hỗn hợp kim loại Y. Khối lượng Fe bị oxi khử bởi ion Cu2+ là:
Đáp án : A Phương pháp giải :
Giả sử Zn phản ứng hết, Fe còn dư nCu sinh ra = nCuSO4 = 0,065 mol => mFe dư = 6,96 – 0,065.64 = 2,8 gam => mKL phản ứng = 65a + 56b = 6,8 – 2,8 (1) Bảo toàn e: ne cho = ne nhận => 2a + 2b = 0,065.2 (2) Lời giải chi tiết :
nCuSO4 = 0,065 mol Sau phản ứng thu được hỗn hợp kim loại Y => kim loại trong X còn dư Giả sử Zn phản ứng hết, Fe còn dư nCu sinh ra = nCuSO4 = 0,065 mol => mFe dư = 6,96 – 0,065.64 = 2,8 gam Giả sử nZn= a(mol); nFe(pư) = b(mol) => mKL phản ứng = 65a + 56b = 6,8 – 2,8 = 4 (1) Bảo toàn e: ne cho = ne nhận => 2a + 2b = 0,065.2 (2) Từ (1) và (2) suy ra a = 0,04; b = 0,025 Vậy lượng sắt bị oxi hóa bởi là: 0,025.56 = 1,4g
Câu 16 :
Thực hiện các thí nghiệm sau : (1) Thả một viên Fe vào dung dịch HCl. (2) Thả một viên Fe vào dung dịch Cu(NO3)2. (3) Thả một viên Fe vào dung dịch FeCl3. (4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm. (5) Đốt một dây Fe trong bình kín chứa đầy khí O2. (6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng. Trong các thí nghiệm trên thì thí nghiệm mà Fe không bị ăn mòn điện hóa là
Đáp án : D Lời giải chi tiết :
(1) Fe + 2HCl → FeCl2 + H2 không tạo ra 2 điện cực mới → ăn mòn hóa học (2) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu → Cu sinh ra bám vào viên Fe và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li → xảy ra ăn mòn điện hóa (3) Fe + 2FeCl3 → 3FeCl2 không tạo thành 2 điện cực mới → ăn mòn hóa học (4) Ni và Fe được nối với nhau và đặt trong không khí ẩm → ăn mòn điện hóa (5) 3Fe + 4O2 Fe3O4 (ăn mòn hóa học) (6) Fe + CuSO4 + H2SO4 : cả ăn mòn điện hóa và ăn mòn hóa học vì xảy ra các phản ứng sau Fe + H2SO4 → FeSO4 + H2 (ăn mòn hóa học vì không hình thành 2 điện cực mới) Fe + CuSO4 → FeSO4 + Cu → Cu sinh ra bám vào thanh sắt và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li → xảy ra ăn mòn điện hóa
Câu 17 :
NaCl có lẫn tạp chất NaHCO3. Cách nào sau đây có thể dùng để thu được NaCl tinh khiết ?
Đáp án : A Lời giải chi tiết :
Để thu được NaCl tinh khiết, ta cho hỗn hợp đó vào dung dịch HCl dư, sau đó cô cạn dung dịch. PTHH: NaHCO3 + HCl → NaCl + CO2 + H2O B sai vì nung hỗn hợp thì NaHCO3 chuyển thành Na2CO3 lẫn với NaCl => không thu được NaCl tinh khiết. C sai vì cả 2 chất đều tan trong nước và khi hạ nhiệt độ không sinh ra kết tủa.
Câu 18 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + H2O Hai muối X và Y tương ướng là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
X phân hủy tạo CO2 => X là CaCO3 hoặc BaCO3 => X1 là oxit bazơ : MO => X2 là bazơ M(OH)2 Ta thấy X2 + Y -> X => Y phải là hợp chất cacbonat ( CO3 hoặc HCO3) mà X2 tác dụng với Y theo 2 tỉ lệ tạo 2 chất khác nhau => Y là NaHCO3 => X là CaCO3 PTHH: Ca(OH)2 + NaHCO3 → CaCO3 + NaOH + H2O Ca(OH)2 + 2NaHCO3 → CaCO3 + Na2CO3 + H2O
Câu 19 :
Cho 3,9 gam Kali tác dụng với 101,8 gam nước. C% của dung dịch thu được là
Đáp án : B Phương pháp giải :
+) nKOH = nK = 0,1 mol; nH2 = 0,5.nK = 0,05 mol +) bảo toàn khối lượng mdd sau phản ứng = mK + mH2O – mH2 Lời giải chi tiết :
nK = 0,1 mol Ta có: nKOH = nK = 0,1 mol; nH2 = 0,5.nK = 0,05 mol Áp dụng định luật bảo toàn khối lượng ta có : ${m_{dd\,\,sau\,\,phản \,\,ứng}} = {m_K} + {m_{{H_2}O}} - {m_{{H_2}}} = 105,6\,\,gam.$ $ = > \,\,C{\% _{KOH}} = \dfrac{{0,1.56}}{{105,6}}.100\% = 5,3\% .$
Câu 20 :
Sục 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M. Sau phản ứng thu được m1 gam kết tủa và dung dịch X. Cho dung dịch X tác dụng với 200 ml dung dịch BaCl2 1,2M; KOH 1,5M thu được m2 gam kết tủa. Giá trị của m2 là:
Đáp án : D Phương pháp giải :
nCO2 < nOH- < 2.nCO2 => tạo 2 muối HCO3- (x mol) và CO32- (y mol) +) Bảo toàn điện tích: nOH- = nHCO3 + 2.nCO3 +) dung dịch X gồm: 0,1 mol Ba2+; 0,4 mol HCO3-; 0,2 mol Na+ Lời giải chi tiết :
nOH- = 0,8 Bảo toàn điện tích: nOH- = nHCO3 + 2.nCO3 => x + 2y = 0.8 => x = 0,4 và y = 0,2 => m2 = 0,3.197 = 59,1 gam
Câu 21 :
Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là :
Đáp án : A Phương pháp giải :
+) nNa = x mol => nAl phản ứng = x mol +) Bảo toàn e: nNa + 3nAl = 2nH2 => x + 3x = 0,1.2 => x = 0,05 mol +) mhỗn hợp đầu = mAl dư + mAl pứ + mNa = 2,35 + 0,05.27 + 0,05.23 = 4,85 gam Lời giải chi tiết :
Chất rắn không tan là Al Gọi nNa = x mol => nAl phản ứng = x mol Bảo toàn e: nNa + 3nAl = 2nH2 mhỗn hợp đầu = mAl dư + mAl pứ + mNa = 2,35 + 0,05.27 + 0,05.23 = 4,85 gam
Câu 22 :
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
Đáp án : B Phương pháp giải :
Bảo toàn Al Lời giải chi tiết :
nBa(AlO2)2 = 0,1 mol Bảo toàn nguyên tử Al: nAl(OH)3 = nAlO2- = 0,2 mol => m = 15,6 gam
Câu 23 :
Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe2O3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
Đáp án : B Phương pháp giải :
Xét tỉ lệ: $\frac{{{n_{Al}}}}{3} = \frac{{0,35}}{3} < \frac{{{n_{Fe2O3}}}}{1} = \frac{{0,3}}{1}$ Lời giải chi tiết :
2Al + Fe2O3 → Al2O3 + 2Fe 0,35 0,35 Xét tỉ lệ: $\frac{{{n_{Al}}}}{3} = \frac{{0,35}}{3} < \frac{{{n_{Fe2O3}}}}{1} = \frac{{0,3}}{1}$ => Fe2O3 dư, Al hết => phản ứng tính theo Al Theo phản ứng : nFe = nAl = 0,35 mol => H = 0,2.100% / 0,35 = 57,14%
Câu 24 :
Bằng phương pháp hóa học. Hãy chọn một hóa chất thích hợp để nhận biết các chất rắn (dạng bột) sau: Fe, FeO, Fe3O4, CuO.
Đáp án : A Phương pháp giải :
xem lại lí thuyết hợp chất sắt Lời giải chi tiết :
Câu 25 :
Hoà tan hết m gam hỗn hợp X gồm Fe, Fe2O3, Fe3O4 trong dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan, giá trị m là:
Đáp án : C Phương pháp giải :
Cách 1: Quy hỗn hợp X về 2 chất Fe và Fe2O3: Cách 2: Quy hỗn hợp X về hỗn hợp 2 chất FeO và Fe2O3 ta có: Cách 3: Quy hỗn hợp X về một chất là FexOy: Cách 4: áp dụng công thức giải nhanh. Lời giải chi tiết :
Cách 1: Quy hỗn hợp X về 2 chất Fe và Fe2O3: Hoà tan hỗn hợp X vào dung dịch HNO3 đặc nóng dư. Bảo toàn e: 3.nFe = nNO2 => nFe = 0,2 / 3 \({n_{muoi khan}} = {n_{Fe{{(N{O_3})}_3}}} = \frac{{145,2}}{{242}} = 0,6mol\) Bảo toàn Fe : nFe + 2.nFe2O3 = nFe(NO3)3 => 0,2 / 3 + 2.nFe2O3 = 0,6 => nFe2O3 = 0,8 / 3 => \({m_{{h^2}X}} = {m_{Fe}} + {n_{F{e_2}{O_3}}} = \frac{{0,2}}{3}.56 + \frac{{0,8}}{3}.160 = 46,4\,\,gam\)
Cách 2: Quy hỗn hợp X về hỗn hợp 2 chất FeO và Fe2O3 ta có: Bảo toàn e: nFeO = nNO2 = 0,2 mol Bảo toàn Fe: nFeO + 2.nFe2O3 = nFe(NO3)3 = 0,6 mol => nFe2O3 = 0,2 mol => mX = 0,2.72 + 0,2.160 = 46,4 gam Cách 3: Quy hỗn hợp X về một chất là FexOy: FexOy + (6x -2y) HNO3 → xFe(NO3)3 + (3x - 2y)NO2 + (3x - y) H2O 0,2 / (3x – 2y) 0,6 0,2 Bảo toàn nguyên tố Fe: \(\frac{{0,2}}{{3x - 2y}} = \frac{{0,6}}{x}\) => \(\frac{x}{y} = \frac{3}{4}\) → Fe3O4 => \({m_{{h^2}}} = \frac{{0,2}}{{3.3 - 4.2}}.232 = 46,4g\) Cách 4: áp dụng công thức giải nhanh. \({n_{Fe}} = {n_{Fe{{(N{O_3})}_3}}} = \frac{{145,2}}{{242}} = 0,6mol\) => mFe = 0,6.56=33,6 gam \({m_{hh}} = \frac{{10.{m_{Fe}} - 56.{n_e}}}{7} = \frac{{10.33,6 - 56.0,2}}{7} = 46,4gam\)
Câu 26 :
Cho 0,6 mol KI tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được một đơn chất. Tính số mol của đơn chất này.
Đáp án : A Phương pháp giải :
6KI + K2Cr2O7 + 7H2SO4 → Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O Nhận thấy nI2 = ½.nKI Lời giải chi tiết :
6KI + K2Cr2O7 + 7H2SO4 → Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O => ${n}_{{I}_{2}} = \frac{{n}_{KI}}{2} =0,3 (mol) $
Câu 27 :
Có 4 chất bột: CaCO3, Na2CO3, BaSO4, Na2SO4. Có thể dùng cặp chất nào sau đây để nhận biết các chất bột đó?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết Phân biệt một số chất vô cơ Lời giải chi tiết :
- dùng H2O và dung dịch HCl
Câu 28 :
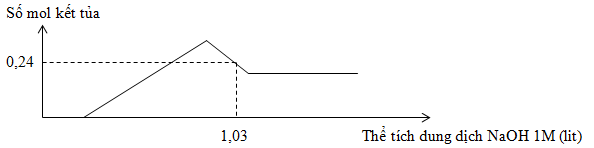
Hòa tan hoàn toàn 7,98g hỗn hợp gồm Mg và Al trong dung dịch chứa a mol H2SO4, sau khi kết thúc phản ứng thu được 8,96 lit khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, sự phụ thuộc số mol kết tủa và thể tích dung dịch NaOH 1M được cho như trong đồ thị sau :
Giá trị của a là
Đáp án : C Phương pháp giải :
+) Bảo toàn e : 2nMg + 3nAl = 2nH2 và : mMg + mAl => khối lượng Mg và Al Tại nkết tủa = 0,24 mol => nkết tủa = nMg(OH)2 + [4nAl3+ - (nOH - nH+ - 2nMg(OH)2)] => nH+ => a Lời giải chi tiết :
Sau 1 thời gian thêm NaOH thì mới có kết tủa => H+ dư Bảo toàn e : 2nMg + 3nAl = 2nH2 = 0,8 mol Và : mMg + mAl = 7,98g => nMg = 0,13 ; nAl = 0,18 mol Tại thời điểm nkết tủa = 0,24 mol thì kết tủa đang tan dần => nkết tủa = nMg(OH)2 + [4nAl3+ - (nOH - nH+ - 2nMg(OH)2) ] => 0,24 = 0,13 + [4.0,18 – (1,03 – nH+ - 2.0,13)] => nH+ = 0,16 mol => a = ½ . 0,16 + nH2 = 0,48
Câu 29 :
Nhỏ từ từ từng giọt cho đến hết dung dịch X chứa 0,03 mol KHCO3 và 0,06 mol Na2CO3 vào 200 ml dung dịch hỗn hợp gồm HCl 0,1M và KHSO4 0,3M được dung dịch Y và thấy thoát ra x mol CO2. Thêm dung dịch chứa 0,06 mol NaOH và 0,15 mol BaCl2 vào dung dịch Y thu được m gam kết tủa. Giá trị của x và m lần lượt là
Đáp án : A Phương pháp giải :
+) $\left\{ \begin{gathered}\frac{x}{y} = \frac{{{n_{HCO_3^ - }}}}{{{n_{CO_3^{2 - }}}}} = \frac{{0,03}}{{0,06}} = 0,5 \hfill \\x + 2y = 0,08 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}x = 0,016 \hfill \\y = 0,032 \hfill \\ \end{gathered} \right.$ => nCO2 = x + y = 0,048 mol +) Vì nOH- > 2.nHCO3- => HCO3- tạo hết thành CO32- +) Vì nBa2+ > nCO3 + nSO4 => nBaCO3 = nCO3 = 0,042 mol; nBaSO4 = nSO4 = 0,06 mol Lời giải chi tiết :
nH+ = 0,08 mol; nHCO3- = 0,03 mol; nCO32- = 0,06 mol Gọi x và y lần lượt là số mol của HCO3- và CO32- đã phản ứng ${HCO_3^ - {\text{ + }}{H^ + }\; \to C{O_2} + {\text{ }}{H_2}O}$ ${\;x\;\;\;\;\;\;\;\;\;\;\,\;x\;\;\;\;\,\,\,\,\,\,\,\,\,\,\,\,\,\;x}$ ${CO_3^{2 - } + 2{H^ + } \to \;C{O_2} + {\text{ }}{H_2}O}$ ${\;y\;\;\;\;\;\;\;\;\;\;2y\;\;\;\,\,\,\,\,\,\,\,\,\,\,\,\;\;y}$ Do mỗi dung dịch hỗn hợp nhỏ xuống đều chứa và với số mol ion trong từng giọt tỉ lệ tương ứng với số mol ban đầu của mỗi ion nên để tính số mol CO2 (x + y) ta giải hệ $\left\{ \begin{gathered}\dfrac{x}{y} = \dfrac{{{n_{HCO_3^ - }}}}{{{n_{CO_3^{2 - }}}}} = \dfrac{{0,03}}{{0,06}} = 0,5 \hfill \\x + 2y = 0,08 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}x = 0,016 \hfill \\y = 0,032 \hfill \\ \end{gathered} \right.$ => nCO2 = x + y = 0,048 mol Do đó dung dịch sau phản ứng có chứa $\left\{ \begin{gathered}HCO_3^ - :0,03 - x = 0,014 \hfill \\CO_3^{2 - }:0,06 - y = 0,028 \hfill \\SO_4^{2 - }:0,06\,\, \hfill \\ \end{gathered} \right.$ Khi thêm dung dịch chứa 0,06 mol OH- và 0,15 mol Ba2+ vào dung dịch Y Vì nOH- > 2.nHCO3- => HCO3- tạo hết thành CO32- => ∑nCO3 = 0,014 + 0,028 = 0,042 mol Vì nBa2+ > nCO3 + nSO4 => nBaCO3 = nCO3 = 0,042 mol; nBaSO4 = nSO4 = 0,06 mol => mkết tủa = 197.0,042 + 233.0,06 = 22,254 gam
Câu 30 :
Điện phân dung dịch chứa hỗn hợp hai muối CuCl2 và Cu(NO3)2 một thời gian, ở anot của bình điện phân thoát ra 448 ml hồn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot (biết trên catot không có khí thoát ra). Giá trị của m là:
Đáp án : C Phương pháp giải :
n khí = 0,02 (mol) Do có hỗn hợp khí nên ở Anot Cl- đã điện phân hết và đến H2O điện phân Tìm số mol 2 khí Tính netđ Tính khối lượng Cu Lời giải chi tiết :
n khí = 0,02 (mol) Do có hỗn hợp khí nên ở Anot Cl- đã điện phân hết và đến H2O điện phân Hỗn hợp khí là : Cl2 và O2 có số mol lần lượt là x, y. $ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ \frac{{71{\text{x}} + 32y}}{{2(x + y)}} = 25,75 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ 71{\text{x}} + 32y = 1,03 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x = 0,01 \hfill \\ y = 0,01 \hfill \\ \end{gathered} \right.$ 2Cl- - 2e → Cl2 0,02 0,01 2H2O - 4e → O2 + 4H+ 0,04 0,01 => ne = 0,06 (mol) ở Catot chưa có khí thoát ra tức là Cu2+ dư => mCu = 0,03.64 = 1,92 (gam) |