Đề thi học kì 1 Hóa 12 - Đề số 2Đề bài
Câu 1 :
Thủy phân este có dạng RCOO – R’COO – R’’ trong môi trường kiềm thu được
Câu 2 :
Capron thuộc loại
Câu 3 :
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
Câu 4 :
Sự kết hợp các phân tử nhỏ (monome) thành các phân tử lớn (polime), đồng thời có loại ra các phân tử nhỏ (như nước, amoniac, CO2…) được gọi là :
Câu 5 :
Đun nóng este CH3OOCCH=CH2 với một lượng vừa đủ dung dịch NaOH, sản phẩm thu được là
Câu 6 :
Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
Câu 7 :
Este nào sau đây làm mất mất màu dung dịch Br2 ở điều kiện thường?
Câu 8 :
Cho dãy kim loại sau : Li, Ag, Al, Cr. Kim loại mềm nhất trong các kim loại trên là :
Câu 9 :
Thủy phân hoàn toàn tinh bột thu được monosaccarit X. Hidro hóa X thu được chất hữu cơ Y. Hai chất X,Y lần lượt là
Câu 10 :
Trong các khẳng định sau, khẳng định không đúng là?
Câu 11 :
Số este có công thức phân tử C4H8O2 mà khi thủy phân trong môi trường axit thì thu được axit fomic là
Câu 12 :
Một este no, đơn chức, mạch hở khi cháy cho 3,6 g H2O và V lít CO2 (đktc). Giá trị của V là
Câu 13 :
Polime được điều chế bằng phản ứng trùng ngưng là :
Câu 14 :
Hoà tan hoàn toàn 8,48 gam hỗn hợp Mg và Fe trong dung dịch HCl dư thấy có 4,928 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan ?
Câu 15 :
Khi thủy phân mantozơ thì thu được
Câu 16 :
Thủy phân hoàn toàn peptit sau : 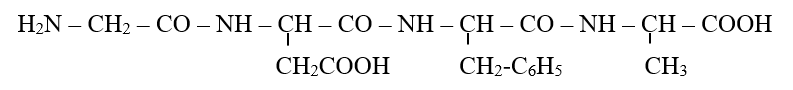 Số ∝-amino axit khác nhau thu được là
Câu 17 :
Đốt cháy hoàn toàn một este hữu cơ X thu được 6,72 lít CO2 đktc và 5,4 gam H2O. Công thức phân tử của este đó là
Câu 18 :
Thuỷ phân pentapeptit X thu được các đipeptit là Ala-Ala; Glu-Gly và tripeptit là Ala-Gly-Glu. Vậy cấu trúc của peptit X là:
Câu 19 :
Một este hữu cơ đơn chức X có thành phần khối lượng mC : mO = 9 : 8 .CTCT thu gọn của este?
Câu 20 :
Số đồng phân đơn chức ứng với công thức phân tử C3H6O2 là
Câu 21 :
Este X có công thức phân tử C2H4O2. Đun nóng m gam X trong dung dịch NaOH vừa đủ đến khi phản ứng xảy ra hoàn toàn thu được 4.08 gam muối khan. Giá trị của m là
Câu 22 :
Amino axit X trong phân tử có một nhóm –NH2 và một nhóm –COOH. Cho 3,75 gam X phản ứng với lượng dư dung dịch HCl, thu được dung dịch chứa 5,575 gam muối. Công thức của X là
Câu 23 :
C3H7NO2 có bao nhiêu đồng phân?
Câu 24 :
X là một tripeptit được tạo thành từ một amino axit no, mạch hở có một nhóm COOH và một nhóm NH2. Đốt cháy hoàn toàn 0,3 mol X cần 2,025 mol O2 thu được sản phẩm gồm CO2, H2O, N2. Công thức của amino axit tạo nên X là
Câu 25 :
Cho 2 phản ứng sau : Cu + 2FeCl3 CuCl2 + 2FeCl2 (1) Fe + CuCl2 FeCl2 + Cu (2) Kết luận nào dưới đây là sai?
Câu 26 :
Cho một thanh Zn vào dung dịch H2SO4 loãng, sau khoảng 1 phút lại cho tiếp vào hỗn hợp phản ứng vài giọt dung dịch CuSO4 thì thấy tốc độ khí thoát ra thay đổi so với ban đầu. Thanh Zn bị ăn mòn theo kiểu nào ?
Câu 27 :
Ngâm một thanh kẽm trong 200 ml dung dịch FeSO4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
Câu 28 :
Cho a gam Al vào 100 ml dung dịch FeSO4 0,2M và CuSO4 0,4M thu được 1,92 gam chất rắn. Giá trị của a là
Câu 29 :
Cho sơ đồ chuyển hoá sau: C3H4O2 + NaOH → X + Y X + H2SO4 loãng → Z + T Biết Y và Z đều có phản ứng tráng gương. Hai chất Y, Z tương ứng là:
Câu 30 :
Thủy phân hoàn toàn 27g este E bằng 1 lượng vừa đủ dung dịch NaOH, rồi ô cạn chỉ thu được hơi nước và hỗn hợp X gồm 2 muối (đều có khối lượng phân tử > 100). Đốt cháy hoàn toàn lượng muối trên cần dùng 1,75 mol O2 , thu được 0,2 mol Na2CO3 ; 1,4 mol CO2 và 0,7 molH2O. Công thức của este là
Lời giải và đáp án
Câu 1 :
Thủy phân este có dạng RCOO – R’COO – R’’ trong môi trường kiềm thu được
Đáp án : A Lời giải chi tiết :
$RCOO-{{R}^{'}}COO-{{R}^{''}}+NaOH\to RCOONa+HO-{{R}^{'}}COONa+HO-{{R}^{''}}$
Câu 2 :
Capron thuộc loại
Đáp án : A Lời giải chi tiết :
Capron là tơ nilon-6 => thuộc loại tơ amit
Câu 3 :
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
Đáp án : A Phương pháp giải :
Gọi công thức của amin no, đơn chức, mạch hở là: CnH2n+3N BTNT “N” : nCnH2n+3N = nN = 2nN2 = ? (mol) => n = nCO2/namin =? => công thức của amin Lời giải chi tiết :
Gọi công thức của amin no, đơn chức, mạch hở là: CnH2n+3N nCO2 = 8,96 : 22,4 = 0,4 (mol) ; nN2 = 0,1 (mol) BTNT “N” : nCnH2n+3N = nN = 2nN2 = 0,2 (mol) => n = nCO2/namin = 0,4/0,2 = 2 Vậy công thức của amin là: C2H7N
Câu 4 :
Sự kết hợp các phân tử nhỏ (monome) thành các phân tử lớn (polime), đồng thời có loại ra các phân tử nhỏ (như nước, amoniac, CO2…) được gọi là :
Đáp án : D Lời giải chi tiết :
Sự kết hợp các phân tử nhỏ (monome) thành các phân tử lớn (polime), đồng thời có loại ra các phân tử nhỏ (như nước, amoniac, CO2…) được gọi là sự trùng ngưng.
Câu 5 :
Đun nóng este CH3OOCCH=CH2 với một lượng vừa đủ dung dịch NaOH, sản phẩm thu được là
Đáp án : A Lời giải chi tiết :
PTHH : CH3OOCCH=CH2 + NaOH → CH2=CHCOONa + CH3OH
Câu 6 :
Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
Đáp án : A Phương pháp giải :
Điều chế kim loại bằng phương pháp thủy luyện là dùng kim loại mạnh hơn để đẩy kim loại yếu hơn ra khỏi muối của chúng (từ Mg trở về sau) Lời giải chi tiết :
Fe đứng trước Cu trong dãy điện hóa học nên đẩy được Cu2+ ra khỏi muối của chúng Fe + CuSO4 → FeSO4 + Cu↓
Câu 7 :
Este nào sau đây làm mất mất màu dung dịch Br2 ở điều kiện thường?
Đáp án : D Phương pháp giải :
Chất có liên kết bội C=C hoặc C≡C trong phân tử, hoặc nhóm -CHO thì làm mất màu dung dịch nước brom ở điều kiện thường Lời giải chi tiết :
metyl acrylat làm mất màu dd Br2 ở đk thường. CH2=CH-COOCH3 + Br2 → CH2Br - CHBr-COOCH3
Câu 8 :
Cho dãy kim loại sau : Li, Ag, Al, Cr. Kim loại mềm nhất trong các kim loại trên là :
Đáp án : C Lời giải chi tiết :
Kim loại mềm nhất là Li (Li là kim loại kiềm, có thể cắt bằng dao)
Câu 9 :
Thủy phân hoàn toàn tinh bột thu được monosaccarit X. Hidro hóa X thu được chất hữu cơ Y. Hai chất X,Y lần lượt là
Đáp án : A Lời giải chi tiết :
Ta có (C6H10O5)n + nH2O → nC6H12O6 ( glucozo – X ) C6H12O6 + H2 → C6H14O6 ( sorbitol – Y )
Câu 10 :
Trong các khẳng định sau, khẳng định không đúng là?
Đáp án : C Lời giải chi tiết :
Glucozơ là monnosaccarit có 5 nhóm -OH và 1 nhóm –CHO => Nó thể hiện tính chất của anđehit và poliancol chứ không thể hiện tính chất của axit và ete
Câu 11 :
Số este có công thức phân tử C4H8O2 mà khi thủy phân trong môi trường axit thì thu được axit fomic là
Đáp án : B Phương pháp giải :
- Xem lại lý thuyết phản ứng thủy phân trong môi trường axit RCOOR’ + H–OH \(\xrightarrow{{{t^o}}}\) RCOOH + R’OH - Este thủy phân thu được axit fomic => Este có dạng HCOOR’ - Viết các đồng phân của R’ => số đồng phân este Lời giải chi tiết :
- Este thủy phân thu được axit fomic => Este có dạng HCOOR’ - Các đồng phân thỏa mãn: HCOOCH2CH2CH3 và HCOOCH(CH3)2
Câu 12 :
Một este no, đơn chức, mạch hở khi cháy cho 3,6 g H2O và V lít CO2 (đktc). Giá trị của V là
Đáp án : D Phương pháp giải :
Đốt cháy este no đơn chức luôn có: ${n_{C{O_2}}} = {\text{ }}{n_{{H_2}O}}$ Lời giải chi tiết :
\(\begin{gathered}{n_{H2O}} = \dfrac{{3,6}}{{18}} = 0,2mol \hfill \\{n_{CO2}} = {n_{H2O}} = 0,2mol \hfill \\= > {n_{CO2}} = 0,2.22,4 = 4,48\,\,lit \hfill \\ \end{gathered} \)
Câu 13 :
Polime được điều chế bằng phản ứng trùng ngưng là :
Đáp án : A Lời giải chi tiết :
Polime được điều chế bằng phản ứng trùng ngưng là policaproamit (tơ nilon-6)
Câu 14 :
Hoà tan hoàn toàn 8,48 gam hỗn hợp Mg và Fe trong dung dịch HCl dư thấy có 4,928 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan ?
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tố: nCl = nHCl = 2nH2 Bảo toàn khối lượng: mmuối = mkim loại + mgốc Cl Lời giải chi tiết :
nH2 = 0,22 mol Bảo toàn nguyên tố: nCl =nHCl = 2nH2 = 2.0,22 = 0,44 mol Bảo toàn khối lượng: mmuối = mkim loại + mgốc Cl = 8,48 + 0,44.35,5 = 24,1 gam
Câu 15 :
Khi thủy phân mantozơ thì thu được
Đáp án : C Lời giải chi tiết :
Mantozơ được cấu tạo từ 2 gốc glucozơ do đó khi thủy phân sẽ thu được glucozo
Câu 16 :
Thủy phân hoàn toàn peptit sau : 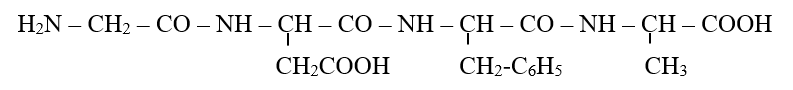 Số ∝-amino axit khác nhau thu được là
Đáp án : D Lời giải chi tiết :
Thủy phân peptit này thu được 4 ∝-amino axit là H2N-CH2-COOH, H2N-CH(CH2COOH)-COOH, H2N-CH(CH2-C6H5)-COOH, H2N-CH(CH3)COOH
Câu 17 :
Đốt cháy hoàn toàn một este hữu cơ X thu được 6,72 lít CO2 đktc và 5,4 gam H2O. Công thức phân tử của este đó là
Đáp án : C Phương pháp giải :
Xem lại phản ứng đốt cháy este thường gặp Lời giải chi tiết :
\({n_{C{O_2}}} = {\rm{ }}{n_{{H_2}O}} = 0,3\) => este no, đơn chức, mạch hở => Công thức este là CnH2nO2
Câu 18 :
Thuỷ phân pentapeptit X thu được các đipeptit là Ala-Ala; Glu-Gly và tripeptit là Ala-Gly-Glu. Vậy cấu trúc của peptit X là:
Đáp án : B Lời giải chi tiết :
Ta thấy X → Ala-Gly-Glu + Glu-Gly Mà X chỉ chứa 1 Glu → X chứa Ala-Gly-Glu -Gly Mặt khác, X tạo Ala-Ala mà X là pentapeptit → X là Ala- Ala-Gly-Glu-Gly.
Câu 19 :
Một este hữu cơ đơn chức X có thành phần khối lượng mC : mO = 9 : 8 .CTCT thu gọn của este?
Đáp án : D Lời giải chi tiết :
$\dfrac{{{m_C}}}{{{m_O}}} = \dfrac{9}{8} = > \dfrac{{{n_C}}}{{{n_O}}} = \dfrac{3}{2}$ Nhận thấy cả 3 phương án A, B, C đều thỏa mãn.
Câu 20 :
Số đồng phân đơn chức ứng với công thức phân tử C3H6O2 là
Đáp án : D Phương pháp giải :
Lời giải chi tiết :
C3H6O2 có các đồng phân là HCOOC2H5 ; CH3COOCH3; CH3 – CH2 – COOH
Câu 21 :
Este X có công thức phân tử C2H4O2. Đun nóng m gam X trong dung dịch NaOH vừa đủ đến khi phản ứng xảy ra hoàn toàn thu được 4.08 gam muối khan. Giá trị của m là
Đáp án : B Phương pháp giải :
- Thủy phân este đơn chức luôn có : neste = n muối => mmuối Lời giải chi tiết :
Este X có CTPT là C2H4O2 chỉ có một CTCT là HCOOCH3. ${n_{HCOONa}} = {\text{ }}{n_{_{HCOOC{H_3}}}} = 0,06\,\,mol$ $ = {\rm{\;}} > {m_{HCOOC{H_3}}} = {\rm{ }}0,06.60 = {\rm{ }}3,6g$
Câu 22 :
Amino axit X trong phân tử có một nhóm –NH2 và một nhóm –COOH. Cho 3,75 gam X phản ứng với lượng dư dung dịch HCl, thu được dung dịch chứa 5,575 gam muối. Công thức của X là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng : maa + mHCl = mmuối X chứa 1 nhóm NH2→ nX = nHCl Lời giải chi tiết :
Bảo toàn khối lượng : maa + mHCl = mmuối → mHCl = 5,575 – 3,75 = 1,825 gam → nHCl = 0,05 mol Vì X chứa 1 nhóm NH2→ nX = nHCl = 0,05 mol → MX = 75
Câu 23 :
C3H7NO2 có bao nhiêu đồng phân?
Đáp án : A Lời giải chi tiết :
C3H7NO2 có CTTQ là CnH2n+1NO2 → có thể là các chất sau + Amino axit no, đơn, mạch hở có 1 nhóm COOH và 1 nhóm NH2 NH2 – CH2 – CH2 – COOH CH3 – CH(NH2) - COOH + Este của amino axit no, đơn, mạch hở có 1 nhóm COOH và 1 nhóm NH2 NH2 – CH2 COOCH3 + Muối amoni hoặc muối amin của axit không no có 1 nối đôi C2H3COONH4 (CH2 = CH – COOH ) HCOONH3CH = CH2 + Hợp chất nitro R-NO2 CH3 – CH2 – CH2 – NO2 (CH3)2CH – NO2 → có tất cả 7 đồng phân
Câu 24 :
X là một tripeptit được tạo thành từ một amino axit no, mạch hở có một nhóm COOH và một nhóm NH2. Đốt cháy hoàn toàn 0,3 mol X cần 2,025 mol O2 thu được sản phẩm gồm CO2, H2O, N2. Công thức của amino axit tạo nên X là
Đáp án : D Phương pháp giải :
Quy đổi X gồm CONH: 0,3.3 = 0,9 mol; CH2: y mol; H2O: 0,3 mol Bảo toàn C: nCO2 = nCONH + nCH2 = 0,9 + y Bảo toàn H: nH2O = 0,5nCONH + nCH2 + nH2O = 0,75 + y Bảo toàn O : nO trong peptit + 2.nO2 = 2.nCO2 + nH2O Lời giải chi tiết :
Quy đổi X gồm CONH: 0,3.3 = 0,9 mol; CH2: y mol; H2O: 0,3 mol Bảo toàn C: nCO2 = nCONH + nCH2 = 0,9 + y Bảo toàn H: nH2O = 0,5nCONH + nCH2 + nH2O = 0,75 + y Bảo toàn O : nO trong peptit + 2.nO2 = 2.nCO2 + nH2O => 0,9 + 0,3 + 2.2,025 = 2.(0,9 + y) + 0,75 + y => y = 0,9 => số C trong X = nCO2 / nX = (0,9 + 0,9) / 0,3 = 6 Vì X là tripeptit => X được tạo ra từ a.a có 2C => CTPT : C2H5O2N
Câu 25 :
Cho 2 phản ứng sau : Cu + 2FeCl3 CuCl2 + 2FeCl2 (1) Fe + CuCl2 FeCl2 + Cu (2) Kết luận nào dưới đây là sai?
Đáp án : A Phương pháp giải :
dựa vào phản ứng xác định ion nào có tính oxi hóa mạnh hơn rồi sắp xếp KL mạnh + chất oxi hóa mạnh => KL yếu + chất oxi hóa yếu Lời giải chi tiết :
Fe + CuCl2 →FeCl2 + Cu → tính oxi hóa của ion Cu2+ > Fe2+ Cu + 2FeCl3 →CuCl2 + 2FeCl2 → tính oxi hóa của ion Fe3+ > Cu2+ → Dãy sắp xếp tính oxi hóa giảm dần là Fe3+> Cu2+> Fe2+
Câu 26 :
Cho một thanh Zn vào dung dịch H2SO4 loãng, sau khoảng 1 phút lại cho tiếp vào hỗn hợp phản ứng vài giọt dung dịch CuSO4 thì thấy tốc độ khí thoát ra thay đổi so với ban đầu. Thanh Zn bị ăn mòn theo kiểu nào ?
Đáp án : D Lời giải chi tiết :
Các quá trình xảy ra như sau : Zn + H2SO4 → ZnSO4 + H2 là quá trình ăn mòn hóa học Zn + CuSO4 → ZnSO4 + Cu Cu tạo ra bám trên Zn → hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li → xảy ra quá trình ăn mòn điện hóa
Câu 27 :
Ngâm một thanh kẽm trong 200 ml dung dịch FeSO4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
Đáp án : A Phương pháp giải :
sử dụng tăng giảm khối lượng Zn + Fe2+ → Zn2+ + Fe 1 1 1 => mgiảm = 9 gam 0,2x ← 0,2x → 0,2x => mgiảm = 1,8 gam Lời giải chi tiết :
Zn + Fe2+ → Zn2+ + Fe 1 1 1 => mgiảm = 9 gam 0,2x ← 0,2x → 0,2x => mgiảm = 1,8 gam => 0,2x.9 = 1,8 => x = 1
Câu 28 :
Cho a gam Al vào 100 ml dung dịch FeSO4 0,2M và CuSO4 0,4M thu được 1,92 gam chất rắn. Giá trị của a là
Đáp án : B Phương pháp giải :
+) Mốc 1: Al phản ứng vừa đủ với Cu2+ => m1 = 0,4.64 = 2,56 gam > 1,92 gam => Al phản ứng hết với Cu2+ (Cu2+ còn dư và Fe2+ chưa phản ứng với Al) +) nAl = 2/3 nCu Lời giải chi tiết :
nFeSO4 = 0,02 mol; nCuSO4 = 0,04 mol → nFe2+ = 0,02 mol; nCu2+ = 0,04 mol Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,04.64 = 2,56 gam > 1,92 gam => Al phản ứng hết với Cu2+(Cu2+ còn dư và Fe2+ chưa phản ứng với Al) => nAl =2/3 nCu = 1,92 / 64 . 2/3 = 0,02 mol => m = 0,54 gam
Câu 29 :
Cho sơ đồ chuyển hoá sau: C3H4O2 + NaOH → X + Y X + H2SO4 loãng → Z + T Biết Y và Z đều có phản ứng tráng gương. Hai chất Y, Z tương ứng là:
Đáp án : C Phương pháp giải :
Xem lại điều chế, ứng dụng, nhận biết este Lời giải chi tiết :
C3H4O2 : HCOOCH = CH2 X : HCOONa Y : CH3CHO Z : HCOOH T : Na2SO4
Câu 30 :
Thủy phân hoàn toàn 27g este E bằng 1 lượng vừa đủ dung dịch NaOH, rồi ô cạn chỉ thu được hơi nước và hỗn hợp X gồm 2 muối (đều có khối lượng phân tử > 100). Đốt cháy hoàn toàn lượng muối trên cần dùng 1,75 mol O2 , thu được 0,2 mol Na2CO3 ; 1,4 mol CO2 và 0,7 molH2O. Công thức của este là
Đáp án : C Phương pháp giải :
bảo toàn khối lượng, Bảo toàn nguyên tố Lời giải chi tiết :
B1 : Xác định khối lượng muối Bảo toàn khối lượng : mmuối = mCO2 + mNa2CO3 + nH2O – nO2 = 39,4g B2 : Xác định dạng este của E Bảo toàn C : nC(sp cháy) = nC(muối) = nC(E) = nCO2 + nNa2CO3 = 1,6mol Bảo toàn Na : nNaOH = 2nNa2CO3 = 0,4 mol Bảo toàn O : nO(Muối) = 2nCO2 + 3nNa2CO3 + nH2O – 2nO2 = 0,6 mol Vì E + NaOH chỉ tạo 2 muối + H2O => E là este của phenol B3 : Xác định tỉ lệ mol C : H : O của E Bảo toàn khối lượng : mE + mNaOH = mmuối + mH2O => nH2O(thủy phân) = 0,2 mol => nH2O = ½ nNaOH = 0,2 mol Phản ứng tổng quát : E + 2xNaOH → Muối + xH2O Bảo toàn H : nH(E) = nH(muối) + 2nH2O – nNaOH = 2.0,7+ 2.0,2– 0,4= 1,4mol Bảo toàn O : nO(E) = nO(Muối) + nH2O – nNaOH = 0,4mol => nC : nH : nO = 1,6: 1,4 : 0,4 = 8 : 7 : 2 B4 : Biện luận CTCT và CTPT phù hợp. Từ đó tính %m Vì số H chẵn => Xét chất : C16H14O4 có CTCT (CH2COOC6H5)2 hoặc (COOC6H4CH3)2 thỏa mãn đề bài |












