Đề thi giữa kì 2 Hóa 9 - Đề số 3Tổng hợp đề thi học kì 2 lớp 9 tất cả các môn Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa - GDCD Đề bài
Câu 1 :
Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết:
Câu 2 :
Số nguyên tố trong chu kì 3 và 5 lần lượt là:
Câu 3 :
Những phát biểu nào sau đây không đúng? 1) Metan tác dụng với clo khi có ánh sáng. 2) Metan là chất khí, không màu, không mùi, nặng hơn không khí. 3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất. 4) Hỗn hợp giữa metan và clo là hỗn hợp nổ. 5) Trong phân tử metan có bốn liên kết đơn C-H. 6) Metan tác dụng với clo ở điều kiện thường.
Câu 4 :
Liên kết C≡C trong phân tử axetilen có
Câu 5 :
CH4 và C2H4 giống nhau ở phản ứng nào sau đây?
Câu 6 :
Chất nào sau đây vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp?
Câu 7 :
Trong phân tử hợp chất hữu cơ cacbon, hiđro, oxi có hoá trị lần lượt là:
Câu 8 :
Nguyên tố X có cấu tạo như sau: điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Tính chất hóa học cơ bản của X là
Câu 9 :
Trong phân tử axetilen, giữa hai nguyên tử cacbon có
Câu 10 :
Chọn câu đúng trong các câu sau:
Câu 11 :
Tính chất vật lí của etilen là
Câu 12 :
Phát biểu nào sau đây là không đúng:
Câu 13 :
Khí X có tỉ khối đối với oxi là 0,8125. Khí X là
Câu 14 :
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc :
Câu 15 :
Phản ứng của metan đặc trưng cho liên kết đơn là:
Câu 16 :
Chất hữu cơ là:
Câu 17 :
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần:
Câu 18 :
Số công thức cấu tạo của C4H10 là
Câu 19 :
Số công thức cấu tạo mạch hở có thể có của C4H8 là
Câu 20 :
Axit axetic có công thức là C2H4O2. Phần trăm nguyên tố C trong phân tử axit axetic là
Câu 21 :
Một hợp chất hữu cơ Y khi đốt cháy hoàn toàn thu được CO2 và H2O có số mol bằng nhau. Đồng thời số mol oxi tối thiểu cần dùng bằng 4 lần số mol của Y. Biết trong Y chỉ chứa 1 nguyên tử O. Công thức phân tử của Y là
Câu 22 :
Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. CTPT của A là
Câu 23 :
Đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Lấy sản phẩm thu được hấp thụ hoàn toàn vào nước vôi trong dư thấy xuất hiện m gam kết tủa. Giá trị của m là
Câu 24 :
Đốt cháy hoàn toàn 11,2 lít khí metan. Biết các thể tích khí đo ở điều kiện tiêu chuẩn.Thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành lần lượt là
Câu 25 :
Đốt cháy hết 36 gam hỗn hợp khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 (đktc). Thể tích khí C3H6 ở đktc là
Câu 26 :
Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibroetan. Phần trăm thể tích của khí metan là
Câu 27 :
Đốt cháy hoàn toàn 1 mol khí axetilen thì cần bao nhiêu lít không khí (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
Câu 28 :
Có 3 bình, mỗi bình chứa 1 trong các khí sau: metan, axetilen, khí cacbonic. Đánh số A, B, C vào các bình này và tiến hành các thí nghiệm với từng chất khí. Kết quả thí nghiệm được ghi ở bảng sau:
Hãy cho biết 3 bình A, B, C chứa lần lượt những khí nào?
Câu 29 :
Đốt hoàn toàn 24 ml hỗn hợp axetilen và metan phải dùng 54 ml oxi (các thể tích khí đo ở đktc). Thể tích khí CO2 sinh ra là
Câu 30 :
Đốt cháy hoàn toàn 2,24 lít anken A trong oxi dư thu được hỗn hợp khí B. Cho B lần lượt đi qua bình 1 đựng H2SO4 đặc và bình 2 đựng Ca(OH)2 dư. Thấy khối lượng bình 1 tăng 5,4 gam, bình 2 có 30 gam kết tủa. CTPT của A là
Lời giải và đáp án
Câu 1 :
Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết:
Đáp án : A Lời giải chi tiết :
Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết: Số electron lớp ngoài cùng
Câu 2 :
Số nguyên tố trong chu kì 3 và 5 lần lượt là:
Đáp án : A Lời giải chi tiết :
Chu kì 3 là chu kì nhỏ => có 8 nguyên tố Chu kì 5 là chu kì lớn => có 18 nguyên tố
Câu 3 :
Những phát biểu nào sau đây không đúng? 1) Metan tác dụng với clo khi có ánh sáng. 2) Metan là chất khí, không màu, không mùi, nặng hơn không khí. 3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất. 4) Hỗn hợp giữa metan và clo là hỗn hợp nổ. 5) Trong phân tử metan có bốn liên kết đơn C-H. 6) Metan tác dụng với clo ở điều kiện thường.
Đáp án : C Lời giải chi tiết :
Các phát biểu không đúng: 2, 4, 6 2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí. 4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai. 6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Câu 4 :
Liên kết C≡C trong phân tử axetilen có
Đáp án : C Lời giải chi tiết :
Liên kết C≡C trong phân tử axetilen có hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 5 :
CH4 và C2H4 giống nhau ở phản ứng nào sau đây?
Đáp án : D Lời giải chi tiết :
CH4 và C2H4 có tính chất hóa học giống nhau là tham gia phản ứng cháy với oxi.
Câu 6 :
Chất nào sau đây vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp?
Đáp án : D Lời giải chi tiết :
Chất vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp là chất có liên kết đôi (giống etilen) => CH2=CH-CH3
Câu 7 :
Trong phân tử hợp chất hữu cơ cacbon, hiđro, oxi có hoá trị lần lượt là:
Đáp án : B Phương pháp giải :
Xem lại đặc điểm cấu tạo hợp chất hữu cơ Lời giải chi tiết :
Trong phân tử hợp chất hữu cơ cacbon, hiđro, oxi có hoá trị lần lượt là: 4,1,2
Câu 8 :
Nguyên tố X có cấu tạo như sau: điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Tính chất hóa học cơ bản của X là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết sự biến đổi tính chất trong một chu kì Lời giải chi tiết :
Từ vị trí này ta biết: + Nguyên tố X có số hiệu nguyên tử là 11, đó là Na. + Nguyên tố X ở chu kì 3, do đó có 3 lớp electron. + Nguyên tố X ở nhóm I có 1e lớp vỏ ngoài cùng, nguyên tố A ở đầu chu kì nên có tính kim loại mạnh.
Câu 9 :
Trong phân tử axetilen, giữa hai nguyên tử cacbon có
Đáp án : C Lời giải chi tiết :
- Công thức cấu tạo của axetilen: => Trong phân tử axetilen, giữa hai nguyên tử cacbon có một liên kết ba
Câu 10 :
Chọn câu đúng trong các câu sau:
Đáp án : C Lời giải chi tiết :
Câu đúng là: Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ
Câu 11 :
Tính chất vật lí của etilen là
Đáp án : B Lời giải chi tiết :
Tính chất vật lí của etilen là: Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
Câu 12 :
Phát biểu nào sau đây là không đúng:
Đáp án : C Lời giải chi tiết :
Phát biểu không đúng là: Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử
Câu 13 :
Khí X có tỉ khối đối với oxi là 0,8125. Khí X là
Đáp án : A Phương pháp giải :
Tính ${{M}_{X}}=0,8125.{{M}_{{{O}_{2}}}}$=> xét các đáp án Lời giải chi tiết :
${{M}_{X}}=0,8125.{{M}_{{{O}_{2}}}}=0,8125.32=26$ Ta có: ${{M}_{{{C}_{2}}{{H}_{2}}}}=26;\,\,{{M}_{{{C}_{2}}{{H}_{4}}}}=28;\,\,{{M}_{{{C}_{2}}{{H}_{6}}}}=30;\,\,{{M}_{C{{H}_{4}}}}=16$ => khí X là C2H2
Câu 14 :
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc :
Đáp án : B Lời giải chi tiết :
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Câu 15 :
Phản ứng của metan đặc trưng cho liên kết đơn là:
Đáp án : C Lời giải chi tiết :
Phản ứng của metan đặc trưng cho liên kết đơn là: phản ứng thế
Câu 16 :
Chất hữu cơ là:
Đáp án : C Lời giải chi tiết :
Chất hữu cơ là: hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat, muối cacbua và xianua.
Câu 17 :
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần:
Đáp án : C Phương pháp giải :
Dựa vào bảng tuần hoàn và quy luật biến đổi : - Khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần điện tích hạt nhân, ta có: + Tính kim loại của nguyên tố giảm dần, tính phi kim tăng dần. - Khi đi từ trên xuống theo chiều tăng điện tích hạt nhân trong nhóm, ta có: + Tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
Lời giải chi tiết :
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần: C, N, O, F vì 4 nguyên tố này cùng thuộc 1 chu kì và cùng sắp xếp theo chiều tăng điện tích hạt nhân.
Câu 18 :
Số công thức cấu tạo của C4H10 là
Đáp án : C Lời giải chi tiết :
có ∆ = 0 => HCHC no, mạch hở
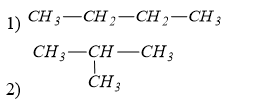
Câu 19 :
Số công thức cấu tạo mạch hở có thể có của C4H8 là
Đáp án : A Lời giải chi tiết :
có ∆ = 1 => π = 1 (vì v = 0) => trong phân tử có 1 liên kết đôi
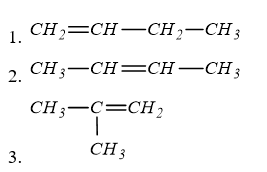
Câu 20 :
Axit axetic có công thức là C2H4O2. Phần trăm nguyên tố C trong phân tử axit axetic là
Đáp án : B Phương pháp giải :
\(\% {m_C} = \frac{{2.{M_C}}}{{{M_{{C_2}{H_4}{O_2}}}}}.100\% \) Lời giải chi tiết :
Khối lượng mol của C2H4O2 là: \({M_{{C_2}{H_4}{O_2}}}\)= 12.2 + 4 + 16.2 = 60 \( = > \% {m_C} = \frac{{12.2}}{{60}}.100\% = 40\% \)
Câu 21 :
Một hợp chất hữu cơ Y khi đốt cháy hoàn toàn thu được CO2 và H2O có số mol bằng nhau. Đồng thời số mol oxi tối thiểu cần dùng bằng 4 lần số mol của Y. Biết trong Y chỉ chứa 1 nguyên tử O. Công thức phân tử của Y là
Đáp án : C Phương pháp giải :
CxHyO + \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)O2 $\xrightarrow{{{t}^{o}}}$ xCO2 + \(\frac{y}{2}\)H2O 1 mol → \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)mol → x mol → \(\frac{y}{2}\) mol Phản ứng thu được số mol CO2 và H2O bằng nhau => x = \(\frac{y}{2}\) (1) Số mol oxi cần dùng bằng 4 lần số mol của Y => \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)= 4 (2) Từ (1) vào (2) => x và y Lời giải chi tiết :
Gọi CTPT của Y có dạng CxHyO Vì đầu bài chỉ cho các tỉ lệ, không cho số mol cụ thể => giả sử đốt cháy 1 mol Y CxHyO + \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)O2 $\xrightarrow{{{t}^{o}}}$ xCO2 + \(\frac{y}{2}\)H2O 1 mol → \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)mol → x mol → \(\frac{y}{2}\) mol Phản ứng thu được số mol CO2 và H2O bằng nhau => x = \(\frac{y}{2}\) (1) Số mol oxi cần dùng bằng 4 lần số mol của Y => \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)= 4 (2) Thay (1) vào (2) ta có: \(\frac{{2.\frac{y}{2}{\rm{ + 0,5y - 1}}}}{2}\)= 4 => 1,5y – 1 = 8 => y = 6 Thay y = 6 vào (1) => x = 3 => CTPT của Y là C3H6O
Câu 22 :
Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. CTPT của A là
Đáp án : B Phương pháp giải :
+) CTĐGN là CH2Cl => CTPT: (CH2Cl)n +) MA = 99 => n Lời giải chi tiết :
+) CTĐGN là CH2Cl => CTPT: (CH2Cl)n +) Vì MA = 99 => (12 + 2 + 35,5).n = 99 => n = 2 => CTPT: C2H4Cl2
Câu 23 :
Đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Lấy sản phẩm thu được hấp thụ hoàn toàn vào nước vôi trong dư thấy xuất hiện m gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
+) tính số mol CO2 theo PT: CH4 + 2O2 $\xrightarrow{{{t}^{o}}}$ CO2 + 2H2O +) tính số mol CaCO3 theo số mol CO2: CO2 + Ca(OH)2 → CaCO3↓ + H2O Lời giải chi tiết :
\({n_{C{H_4}}} = \frac{{3,36}}{{22,4}} = 0,15\,mol\) CH4 + 2O2 $\xrightarrow{{{t}^{o}}}$ CO2 + 2H2O 0,15 → 0,15 mol CO2 + Ca(OH)2 → CaCO3↓ + H2O 0,15 mol → 0,15 mol => ${{m}_{CaC{{\text{O}}_{3}}}}=0,15.100=15\,gam$
Câu 24 :
Đốt cháy hoàn toàn 11,2 lít khí metan. Biết các thể tích khí đo ở điều kiện tiêu chuẩn.Thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành lần lượt là
Đáp án : C Phương pháp giải :
+) Tính số mol CO2 và số mol O2 theo PT: CH4 + 2O2 $\xrightarrow{{{t}^{o}}}$ CO2 + 2H2O Lời giải chi tiết :
\({n_{C{H_4}}} = \frac{{11,2}}{{22,4}} = 0,5\,mol\) CH4 + 2O2 $\xrightarrow{{{t}^{o}}}$ CO2 + 2H2O 0,5 → 1 → 0,5 mol $=>{{V}_{{{O}_{2}}}}=1.22,4=22,4$ lít ${{V}_{C{{O}_{2}}}}=0,5.22,4=11,2$ lít
Câu 25 :
Đốt cháy hết 36 gam hỗn hợp khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 (đktc). Thể tích khí C3H6 ở đktc là
Đáp án : A Phương pháp giải :
Gọi số mol của C3H6 và C2H4 lần lượt là x và y mol => mhỗn hợp = PT(1) C3H6 + $\frac{9}{2}$O2 $\xrightarrow{{{t}^{o}}}$ 3CO2 + 3H2O x mol → 3x mol C2H6 + $\frac{7}{2}$O2 $\xrightarrow{{{t}^{o}}}$ 2CO2 + 3H2O y mol → 2y mol => ${{n}_{C{{O}_{2}}}} = PT(2)$ Lời giải chi tiết :
Gọi số mol của C3H6 và C2H4 lần lượt là x và y mol => mhỗn hợp = 42x + 28y = 36 (1) C3H6 + $\frac{9}{2}$O2 $\xrightarrow{{{t}^{o}}}$ 3CO2 + 3H2O x mol → 3x mol C2H6 + $\frac{7}{2}$O2 $\xrightarrow{{{t}^{o}}}$ 2CO2 + 3H2O y mol → 2y mol => ${{n}_{C{{O}_{2}}}}=3\text{x}+2y=2,5\,mol\,\,\,\,(2)$ Từ (1) và (2) ta có hệ: \(\left\{ \begin{array}{l}42{\rm{x}} + 30y = 36\\3{\rm{x}} + 2y = 2,5\end{array} \right. = > \left\{ \begin{array}{l}x = 0,5\\y = 0,5\end{array} \right.\) \( = > {V_{{C_3}{H_6}}} = {V_{{C_2}{H_4}}} = 0,5.22,4 = 11,2\) lít
Câu 26 :
Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibroetan. Phần trăm thể tích của khí metan là
Đáp án : C Phương pháp giải :
PTHH: C2H4 + Br2 → C2H4Br2 0,025 ← 0,025 \( = > {V_{{C_2}{H_4}}} = > {V_{C{H_4}}}\)\( = > \% {V_{C{H_4}}}\) Lời giải chi tiết :
\({m_{{C_2}{H_4}B{{\rm{r}}_2}}} = 4,7\,gam\, = > {n_{{C_2}{H_4}B{{\rm{r}}_2}}} = \frac{{4,7}}{{188}} = 0,025\,mol\) PTHH: C2H4 + Br2 → C2H4Br2 0,025 ← 0,025 \( = > {V_{{C_2}{H_4}}} = 0,025.22,4 = 0,56\,lit\, = > {V_{C{H_4}}} = 2,8 - 0,56 = 2,24\,lit\) \( = > \% {V_{C{H_4}}} = \frac{{2,24}}{{2,8}}.100\% = 80\% \)
Câu 27 :
Đốt cháy hoàn toàn 1 mol khí axetilen thì cần bao nhiêu lít không khí (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
Đáp án : B Phương pháp giải :
+) Tính số mol oxi theo PT: 2C2H2 + 5O2 $\xrightarrow{{{t}^{o}}}$ 4CO2 + 2H2O +) Vì khí oxi chiếm 20% thể tích không khí => Vkhông khí = $\frac{{{V}_{{{O}_{2}}}}}{20\%}$ Lời giải chi tiết :
Phương trình đốt cháy khí axetilen: 2C2H2 + 5O2 $\xrightarrow{{{t}^{o}}}$ 4CO2 + 2H2O 1 mol → 2,5 mol $=>{{V}_{{{O}_{2}}}}=2,5.22,4=56$ lít Vì khí oxi chiếm 20% thể tích không khí => Vkhông khí = $\frac{56}{20\%}=280$lít
Câu 28 :
Có 3 bình, mỗi bình chứa 1 trong các khí sau: metan, axetilen, khí cacbonic. Đánh số A, B, C vào các bình này và tiến hành các thí nghiệm với từng chất khí. Kết quả thí nghiệm được ghi ở bảng sau:
Hãy cho biết 3 bình A, B, C chứa lần lượt những khí nào?
Đáp án : B Phương pháp giải :
Cần nắm được tính chất hóa học đặc trưng của khí metan, khí cacbonic và khí axetilen Lời giải chi tiết :
Khí làm mất màu dung dịch brom là axetilen => Bình B chứa axetilen Khí làm vẩn đục nước vôi trong là cacbonic => Bình C chứa cacbonic Khí không phản ứng với cả 2 chất là metan => Bình A chứa metan
Câu 29 :
Đốt hoàn toàn 24 ml hỗn hợp axetilen và metan phải dùng 54 ml oxi (các thể tích khí đo ở đktc). Thể tích khí CO2 sinh ra là
Đáp án : C Phương pháp giải :
Gọi thể tích của CH4 và C2H2 lần lượt là x và y ml => Vhỗn hợp =PT(1) CH4 + 2O2 → CO2 + 2H2O x → 2x → x 2C2H2 + 5O2 → 4CO2 + 2H2O y → 2,5y → 2y Từ \( \sum {{V_{{O_2}}} => PT(2)} \) Lời giải chi tiết :
Gọi thể tích của CH4 và C2H2 lần lượt là x và y ml => Vhỗn hợp = x + y = 24 ml (1) CH4 + 2O2 → CO2 + 2H2O x → 2x → x 2C2H2 + 5O2 → 4CO2 + 2H2O y → 2,5y → 2y \( = > \sum {{V_{{O_2}}} = 2{\rm{x}} + 2,5y = 54\,ml\,\,\,(2)} \) Từ (1), (2) ta có hệ phương trình: \(\left\{ \begin{array}{l}x + y = 24\\2{\rm{x}} + 2,5y = 54\end{array} \right. = > \left\{ \begin{array}{l}x = 12\\y = 12\end{array} \right.\) \( = > {V_{C{O_2}}} = x + 2y = 36\,ml\)
Câu 30 :
Đốt cháy hoàn toàn 2,24 lít anken A trong oxi dư thu được hỗn hợp khí B. Cho B lần lượt đi qua bình 1 đựng H2SO4 đặc và bình 2 đựng Ca(OH)2 dư. Thấy khối lượng bình 1 tăng 5,4 gam, bình 2 có 30 gam kết tủa. CTPT của A là
Đáp án : B Phương pháp giải :
+) Từ khối lượng bình 1 tăng và khối lượng kết tủa bình 2 => số mol CO2 và H2O => CTTQ của A +) Viết pthh: ${C_n}{H_{2n}} + \frac{{3n}}{2}{O_2} \to nC{O_2} + n{H_2}O$ => tính n theo PT Lời giải chi tiết :
Gọi CTPT của $A$ là ${{C}_{n}}{{H}_{2n}}$$(n\ge 2)$ ${{m}_{{{H}_{2}}O}}=5,4(g)\Rightarrow {{n}_{{{H}_{2}}O}}=\frac{5,4}{18}=0,3(mol)$ ${{n}_{CaC{{O}_{3}}}}=\frac{30}{100}=0,3(mol)={{n}_{C{{O}_{2}}}}$ ${{n}_{A}}=\frac{2,24}{22,4}=0,1(mol)$ pthh: ${{C}_{n}}{{H}_{2n}}+\frac{3n}{2}{{O}_{2}}\to nC{{O}_{2}}+n{{H}_{2}}O$ theo pt: 1 $n$ $n$ theo đb: 0,1 0,3 0,3 (mol) Ta có: $0,1\cdot n=0,3\cdot 1\Leftrightarrow n=3$ Vậy CTPT của $A$ là: ${{C}_{3}}{{H}_{6}}$ |












