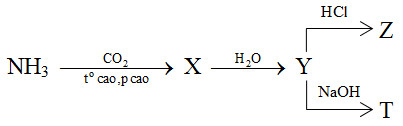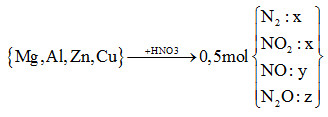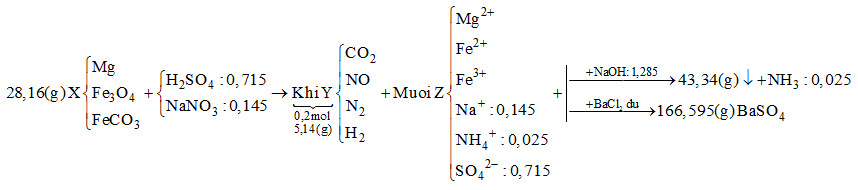Đề thi giữa kì 1 Hóa 11 - Đề số 3Đề bài
Câu 1 :
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
Câu 2 :
Phát biểu không đúng là
Câu 3 :
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
Câu 4 :
Dung dịch X có chứa a mol Ba2+, b mol Mg2+, c mol NO3- và d mol Cl-. Biểu thức quan hệ giữa a, b, c, d là:
Câu 5 :
Nhận xét đúng về muối amoni trong các nhận xét dưới đây là:
Câu 6 :
Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
Câu 7 :
NH3 thể hiện tính bazơ trong phản ứng
Câu 8 :
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Câu 9 :
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
Câu 10 :
Phương trình ion rút gọn của phản ứng cho biết
Câu 11 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Câu 12 :
Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
Câu 13 :
Dãy chất nào sau đây là các chất điện li mạnh?
Câu 14 :
Cho các phản ứng sau: (a) NH4Cl + NaOH → NaCl + NH3 + H2O (b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O (c) NaHCO3 + NaOH → Na2CO3 + H2O (d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O (e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
Câu 15 :
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Câu 16 :
Chất điện li yếu có độ điện li
Câu 17 :
Chất nào sau đây là chất điện li?
Câu 18 :
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính axit là :
Câu 19 :
Câu nào sau đây nói không đúng về độ điện li $\alpha $ (anpha)?
Câu 20 :
Phản ứng nitơ thể hiện tính khử là
Câu 21 :
Dung dịch CH3COOH 0,1M có pH = a và dung dịch HCl 0,1M có pH = b. Phát biểu đúng là
Câu 22 :
Muối amoni là chất điện li thuộc loại:
Câu 23 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Câu 24 :
Dung dịch có giá trị pH = 7 sẽ làm quỳ tím
Câu 25 :
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
Câu 26 :
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
Câu 27 :
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
Câu 28 :
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau - Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc). - Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa. Tổng khối lượng các chất tan trong dung dịch X là
Câu 29 :
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
Câu 30 :
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
Câu 31 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Câu 32 :
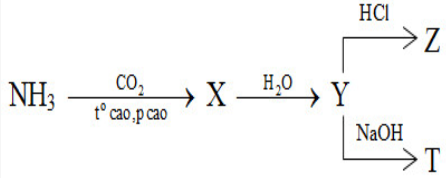
Cho sơ đồ phản ứng sau:
X, Y, Z, T tương ứng là
Câu 33 :
Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
Câu 34 :
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
Câu 35 :
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
Câu 36 :
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Câu 37 :
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Câu 38 :
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Câu 39 :
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
Câu 40 :
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
Đáp án : A Phương pháp giải :
Chọn axit X và bazo Y tác dụng với nhau tạo ra kết tủa Lời giải chi tiết :
Dung dịch chất X làm quỳ tím chuyển sang màu đỏ => dd X có môi trường axit Dung dich chất Y làm quỳ tím hóa xanh => dd Y có môi trường bazo Trộn X với Y có kết tủa => X là H2SO4 và Y là Ba(OH)2 H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
Câu 2 :
Phát biểu không đúng là
Đáp án : A Lời giải chi tiết :
Phát biểu không đúng là: Môi trường kiềm có pH < 7. Do môi trường kiềm có pH > 7
Câu 3 :
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
Đáp án : A Phương pháp giải :
Tính số mol Na2SO4 sau đó dựa vào phương trình điện ly tính được số mol \(SO_4^{2 - }\) Lời giải chi tiết :
\({n_{N{a_2}S{O_4}}} = \dfrac{{14,2}}{{142}} = 0,1\,\,mol\) \(N{a_2}S{O_4} \to 2N{a^ + } + SO_4^{2 - }\) Theo phương trình điện ly\( \to {n_{SO_4^{2 - }}} = {n_{N{a_2}S{O_4}}} = 0,1\,\,mol\)
Câu 4 :
Dung dịch X có chứa a mol Ba2+, b mol Mg2+, c mol NO3- và d mol Cl-. Biểu thức quan hệ giữa a, b, c, d là:
Đáp án : C Phương pháp giải :
Bảo toàn điện tích. Lời giải chi tiết :
Bảo toàn điện tích: n(+) = n(-) => 2nBa2+ + 2nMg2+ = nNO3- + nCl- => 2a + 2b = c + d
Câu 5 :
Nhận xét đúng về muối amoni trong các nhận xét dưới đây là:
Đáp án : B Phương pháp giải :
Lý thuyết về muối amoni. Lời giải chi tiết :
A sai muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion gốc axit. B đúng. C sai, chất khí thoát là NH3 làm quỳ tím hóa xanh. D sai, tùy từng trường hợp mà thu được khí N2, NH3 hoặc N2O.
Câu 6 :
Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
Đáp án : C Lời giải chi tiết :
Kết luận đúng là: Một hợp chất khi tan trong nước phân li ra cation H+ là axit.
Câu 7 :
NH3 thể hiện tính bazơ trong phản ứng
Đáp án : A Lời giải chi tiết :
NH3 thể hiện tính bazơ trong phản ứng: 2NH3 + H2SO4 → (NH4)2SO4.
Câu 8 :
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Đáp án : C Phương pháp giải :
Do Fe dư nên tạo thành muối Fe2+ Sử dụng định luật bảo toàn e: 2nFe = 3nNO => nNO = ? Lời giải chi tiết :
Do Fe dư nên tạo thành muối Fe2+ nFe = (20 – 3,2)/56 = 0,3 mol BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol => V = 4,48 lít
Câu 9 :
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
Đáp án : C Lời giải chi tiết :
2AgNO3 + Fe → 2Ag + Fe(NO3)2 AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Câu 10 :
Phương trình ion rút gọn của phản ứng cho biết
Đáp án : C Lời giải chi tiết :
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly
Câu 11 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Đáp án : D Phương pháp giải :
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc. Lời giải chi tiết :
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm. 2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 12 :
Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
Đáp án : B Lời giải chi tiết :
Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3
Câu 13 :
Dãy chất nào sau đây là các chất điện li mạnh?
Đáp án : C Phương pháp giải :
Chất điên li mạnh gồm có các axit mạnh, bazo mạnh và hầu hết các muối. Lời giải chi tiết :
A loại Fe(OH)3 (bazơ yếu) và HBr (axit yếu) B loại Loại CH3COOH (axit yếu) D loại C2H5OH (không phải chất điện ly)
Câu 14 :
Cho các phản ứng sau: (a) NH4Cl + NaOH → NaCl + NH3 + H2O (b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O (c) NaHCO3 + NaOH → Na2CO3 + H2O (d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O (e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
Đáp án : B Phương pháp giải :
Viết các phương trình ion rút gọn của các phản ứng ra, chọn các phản ứng có phương trình ion rút gọn như đề bào cho. Lời giải chi tiết :
(a) NH4+ + OH- → NH3 + H2O (b) NH4+ + HCO3 - → NH3 + CO32- + 2H2O (c) HCO3- + OH- → CO32- + H2O (d) Ba2+ + HCO3- + OH- → BaCO3↓ + CO32- + 2H2O (d) Ba2+ + CO32- → BaCO3↓ Vậy chỉ có 1 phương trình (c) có có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O
Câu 15 :
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Đáp án : A Phương pháp giải :
HNO3 thể hiện tính oxi hóa khi phản ứng với các chất khử (chất có khả năng tăng số oxi hóa) Lời giải chi tiết :
A đúng B loại CuO, CaCO3 C loại CaO D loại Fe2O3
Câu 16 :
Chất điện li yếu có độ điện li
Đáp án : C Lời giải chi tiết :
Chất điện li yếu có độ điện li: 0 < $\alpha $< 1
Câu 17 :
Chất nào sau đây là chất điện li?
Đáp án : C Phương pháp giải :
- Chất điện li: Những chất tan trong nước phân li thành các ion => axit, bazơ, muối là các chất điện li. Lời giải chi tiết :
Chỉ có axit, bazơ, muối là chất điện li
Câu 18 :
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính axit là :
Đáp án : C Lời giải chi tiết :
HNO3 chỉ thể hiện tính axit là không có phản ứng oxi hóa – khử => các chất đều đã đạt số oxi hóa tối đa
Câu 19 :
Câu nào sau đây nói không đúng về độ điện li $\alpha $ (anpha)?
Đáp án : B Phương pháp giải :
xem lại lí thuyết độ điện li $\alpha $ Lời giải chi tiết :
Câu không đúng là: Độ điện li của các chất khác nhau là giống nhau
Câu 20 :
Phản ứng nitơ thể hiện tính khử là
Đáp án : C Phương pháp giải :
Chất nhường electron thể hiện tính khử khi đó số oxi hóa của nguyên tố đó tăng. Lời giải chi tiết :
A. \(N_2^0 + 6Li \to 2L{i_3}\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa. B. \(N_2^0 + 2Al \to 2Al\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa. C. \(N_2^0 + O_2 \to 2\mathop N\limits^{ +2}O \Rightarrow {N_2}\) thể hiện tính khử. D. \(N_2^0 + 3H_2 \to 2\mathop N\limits^{ - 3} H_3 \Rightarrow {N_2}\) thể hiện tính oxi hóa.
Câu 21 :
Dung dịch CH3COOH 0,1M có pH = a và dung dịch HCl 0,1M có pH = b. Phát biểu đúng là
Đáp án : B Phương pháp giải :
Dễ thấy HCl là axit mạnh nên phân li hoàn toàn CH3COOH là axit yếu nên phân li 1 phần +) Sử dụng công thức: pH = -log[H+] Lời giải chi tiết :
Dễ thấy HCl là axit mạnh nên phân li hoàn toàn => ${{\text{[}}{{\text{H}}^ + }{\text{]}}_{HCl}} = 0,1 = > b = - \log ({\text{[}}{{\text{H}}^ + }{\text{]) = 1}}$ CH3COOH là axit yếu nên phân li 1 phần => ${{\text{[}}{{\text{H}}^ + }{\text{]}}_{C{H_3}COOH}}{\text{ < }}0,1 = > a = - \log {\text{ }}({\text{[}}{{\text{H}}^ + }{\text{]) > 1}}$
Câu 22 :
Muối amoni là chất điện li thuộc loại:
Đáp án : A Lời giải chi tiết :
Tất cả các muối amoni đều tan nhiều tronng nước và phân li hoàn toàn thành các ion.
Câu 23 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Đáp án : B Phương pháp giải :
- Xác định các chất điện li - Viết phương trình điện li, so sánh độ dẫn điện của các chất điện li Các dung dịch có cùng nồng độ, dung dịch nào phân li ra nhiều ion sẽ dẫn điện tốt hơn Lời giải chi tiết :
- C2H5OH tan trong nước nhưng không phân li ra ion=>không có khả năng dẫn điện. - CH3COOH là chất điện li yếu =>dẫn điện yếu hơn so với 2 muối Cùng nồng độ 0,1 mol/l thì: NaCl →Na+ +Cl− ; K2SO4 →2K+ + SO42− K2SO4 phân li ra nhiều ion hơn nên dẫn điện mạnh hơn NaCl. => C2H5OH < CH3COOH < NaCl < K2SO4
Câu 24 :
Dung dịch có giá trị pH = 7 sẽ làm quỳ tím
Đáp án : C Lời giải chi tiết :
Dung dịch pH = 7 không làm đổi màu quỳ tím.
Câu 25 :
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
Đáp án : A Phương pháp giải :
+) Từ pH => pOH = 14 - pH => [OH−] +) Tính số mol NaOH từ [OH−] Lời giải chi tiết :
pH=10 => pOH = 14 – pH => [OH−] = 10−4 M => nNaOH = 0,3. 10−4 = 3. 10−5 ( mol) => mNaOH = 3. 10−5 . 40 = 1,2.10−3 (g)
Câu 26 :
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
Đáp án : B Phương pháp giải :
- Áp dụng bảo toàn nguyên tố → dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol - Áp dụng định luật bảo toàn điện tích : \(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\) => Mối liên hệ giữa x và y Lời giải chi tiết :
- Áp dụng bảo toàn nguyên tố → dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol - Áp dụng định luật bảo toàn điện tích : \(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\) => 3x + 2.2y = 2.(2x + y) → x = 2y
Câu 27 :
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
Đáp án : A Lời giải chi tiết :
H+ và CO32- không thể cùng tồn tại trong cùng một dung dịch Tương tự với Fe2+ ; H+ ; NO3- cũng không thể cùng tồn tại trong một dung dịch H+ + CO32- → HCO3- 3Fe2+ + 4H+ + NO3- → 3Fe3+ NO + 2H2O
Câu 28 :
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau - Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc). - Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa. Tổng khối lượng các chất tan trong dung dịch X là
Đáp án : B Phương pháp giải :
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}\Rightarrow {{n}_{F{{e}^{3+}}}}$ ${{n}_{N{{H}_{3}}}}\Rightarrow {{n}_{NH_{4}^{+}}}$ P2: ${{n}_{BaS{{O}_{4}}}}\Rightarrow {{n}_{SO_{4}^{2-}}}$ BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}$ Lời giải chi tiết :
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}={{n}_{F{{e}^{3+}}}}=\frac{1,07}{107}=0,01\text{ }mol$ ${{n}_{N{{H}_{3}}}}={{n}_{NH_{4}^{+}}}=\frac{0,672}{22,4}=0,03\text{ }mol$ P2: ${{n}_{BaS{{O}_{4}}}}={{n}_{SO_{4}^{2-}}}=\frac{4,66}{233}=0,02\text{ }mol$ BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}=3{{n}_{F{{e}^{3+}}}}+{{n}_{NH_{4}^{+}}}-2{{n}_{SO_{4}^{2-}}}=0,02\text{ }mol$ => m chất tan (1 phần) = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.62 = 4,26 gam => m chất tan trong X = 8,52 gam
Câu 29 :
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
Đáp án : A Lời giải chi tiết :
A sai vì HCOOH là axit yếu, phân li không hoàn toàn nên nồng độ $[{H^ + }{\text{]}}$ giảm, pH thay đổi tuy nhiên còn phụ thuộc cả vào độ điện li nên không tuân theo đúng tỉ lệ pha loãng. B đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+. Khi thêm dung dịch HCl, nghĩa là thêm H+, như vậy cân bằng hóa học chuyển dịch sang trái → độ điện li của axit giảm. C đúng (SGK 11NC – trang 9) D đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+. pH = 3 → $[{H^ + }{\text{]}}$ = 0,001M $\alpha = \dfrac{{{C_{HCOOH\,phân\,li}}}}{{{C_{HCOOH\,b\,\,{\text{đ}}ầu}}}}.100\% = \dfrac{{0,001}}{{0,007}}.100\% = 14,29\% $
Câu 30 :
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
Đáp án : D Phương pháp giải :
Trong phòng thí nghiệm người ta điều chế N2 bằng phản ứng: NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O - Tính toán theo PTHH. Lời giải chi tiết :
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol => mNaNO2 = 0,3.69 = 20,7 gam
Câu 31 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Đáp án : B Phương pháp giải :
+) Xét hiệu suất tính theo chất phản ứng thiếu +) Tính thể tích các chất phản ứng => thể tích các chất sau phản ứng +) Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}}\) Lời giải chi tiết :
Theo phương trình phản ứng tổng hợp NH3 ta thấy N2 và H2 phản ứng theo tỉ lệ là \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{3}{1}\). Theo đề bài ta thấy \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{{{V_{{H_2}}}}}{{{V_{{N_2}}}}} = \frac{1}{1}\). Vậy H2 thiếu nên hiệu suất phản ứng tính theo H2. Thể tích H2 phản ứng là 10.60% = 6 lít VH2 phản ứng = 6 lít => VN2 phản ứng = 2 lít N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 ban đầu: 10 10 phản ứng: 2 → 6 → 4 dư: 8 4 4 => Vsau = 8 + 4 + 4 = 16 Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}} \Rightarrow \frac{{20}}{{16}} = \frac{{10}}{{{p_2}}} \Rightarrow {p_2} = 8\,\,atm.\)
Câu 32 :
Cho sơ đồ phản ứng sau:
X, Y, Z, T tương ứng là
Đáp án : B Phương pháp giải :
Viết các PTHH từ đó xác định được các chất X, Y, Z, T tương ứng. Lời giải chi tiết :
2NH3 + CO2 \(\xrightarrow{{{t^o}\,cao,\,p\,\,cao}}\) (NH2)2CO (X) + H2O (NH2)2CO (X) + 2H2O → (NH4)2CO3 (Y) (NH4)2CO3 (Y) + 2HCl → 2NH4Cl + H2O + CO2 (Z) (NH4)2CO3 (Y) + 2NaOH → Na2CO3 + 2NH3 (T) + 2H2O
Câu 33 :
Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
Đáp án : D Phương pháp giải :
Viết và tính toán theo PTHH. Lời giải chi tiết :
\(NH_4^ + + {\text{ }}O{H^ - } \to {\text{ }}N{H_3} + {\text{ }}{H_2}O\) Theo PTHH: \({{\text{n}}_{{\text{O}}{{\text{H}}^{\text{ - }}}}}{\text{ = }}{{\text{n}}_{{\text{N}}{{\text{H}}_{\text{3}}}}}\)= 5,6 : 22,4 = 0,25 mol => CM = n : V = 0,25 : 0,1 = 2,5M
Câu 34 :
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
Đáp án : B Lời giải chi tiết :
Ta dùng NaOH vì
Câu 35 :
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
Đáp án : B Phương pháp giải :
TH1: Nếu muối nitrat của M là Fe(NO3)2 Xét số mol Fe(NO3)2 và số mol Fe2O3 có phù hợp không => loại TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân 2M(NO3)n → M2On + 2nNO2 + n/2O2 $=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}$ Lời giải chi tiết :
TH1: Nếu muối nitrat của M là Fe(NO3)2 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 47/900 mol 0,025 mol => loại TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân 2M(NO3)n → M2On + 2nNO2 + n/2O2 $\frac{9,4}{M+62n}$ → $\frac{4,7}{M+62n}$ $=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}=>M=32n$ Với n = 2 => M = 64 => M là Cu
Câu 36 :
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Đáp án : C Phương pháp giải :
HS ghi nhớ công thức tính nhanh số mol HNO3 đã phản ứng: nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) Lời giải chi tiết :
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) *nZ = 2x + y + z = 0,5 mol (1) *mZ = nZ.MZ => 28x + 44x + 30y + 44z = 0,5.8,9.4 => 74x + 30y + 44z = 17,8 (2) \(\xrightarrow{{\dfrac{3}{7}(2) - \dfrac{{62}}{7}(1)}}14x + 4y + 10z = 3,2\)(**) (*) và (**) => nHNO3 = 3,2 mol
Câu 37 :
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Đáp án : A Phương pháp giải :
Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích. Lời giải chi tiết :
Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4 \( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\) Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\) Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3 \({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\) Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\) Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\) \( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\) Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\) \( \to {m_{Fe}} + {m_{Mg}} = 21,92g\) Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\) Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\) \( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\) \( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\) Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\) \( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\) Đặt số mol của CO2, NO và N2 lần lượt là x, y, z \( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*) Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\) \( \to 44x + 30y + 28z = 5,04\) (**) Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\) \( \to y + 2z = 0,12\) (***) Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04 \( \to {n_{FeC{O_3}}} = 0,04\,\,mol\) Gọi số mol của Mg và Fe3O4 lần lượt là a và b \( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1) Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g \( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2) Từ (1) và (2) \( \to \) a = 0,4; b = 0,06 \( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \)
Câu 38 :
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Đáp án : C Phương pháp giải :
- Tính CM + Tính mdd: ${m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}}$ + Tính CM - Thể tích dd A cần lấy NaOH → Na+ + OH− Theo pt: nNaOH = nOH- => V = n: CM Lời giải chi tiết :
$ - {m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)$ $ = > {\text{ }}{V_{dd}} = {\text{ }}m{\text{ }}:{\text{ }}d{\text{ }} = {\text{ }}50{\text{ }}:{\text{ }}1,12{\text{ }} = \frac{{625}}{{14}}ml$ ${n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)$ $ = > {C_{MNaOH}}{\text{ }} = {\text{ }}n{\text{ }}:{\text{ }}{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)$ - NaOH → Na+ + OH− Theo pt: nNaOH = nOH- = 2.10-3 (mol) => Thể tích dd A cần lấy là: V = n: CM = 2.10-3 : 3,36 = 6.10-4 lít = 0,6 ml
Câu 39 :
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết sự điện ly ta có: \(\begin{gathered} Lời giải chi tiết :
- nH2SO4 = 0,2(mol) H2SO4 → 2H+ + SO42- \({n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 2.0,2 = 0,4(mol)\) - Ba(OH)2 → Ba2+ + 2OH− \({n_{Ba{{(OH)}_2}}} = \dfrac{1}{2}{n_{O{H^ - }}} = \dfrac{1}{2}.0,4 = 0,2(mol)\) \( = > {V_{Ba{{(OH)}_2}}} = n:{C_M} = 0,2:0,5 = 0,4(l)\)
Câu 40 :
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
Đáp án : A Phương pháp giải :
X + HNO3 → Muối + NO + H2O BTKL: mH2O = mX + mHNO3 - m muối - mNO = ? => nH2O BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => nNH4+ BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => nNO3- BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X) => m = mKL = mX - mO(X) Lời giải chi tiết :
X + HNO3 → Muối + NO + H2O BTKL: mH2O = mX + mHNO3 - m muối - mNO = 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam => nH2O = 0,47 mol BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => 0,98 = 4nNH4+ + 2.0,47 => nNH4+ = 0,01 mol BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => 0,98 = nNO3- + 0,01 + 0,1 => nNO3- = 0,87 mol BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 => nO(X) = 0,24 mol => m = mKL = mX - mO(X) = 18,6 - 0,24.16 = 14,76 gam |