40 câu hỏi lý thuyết về điện phân có lời giảiLàm bàiCâu hỏi 1 : Điện phân dung dịch hỗn hợp gồm NaCl và KCl có chứa vài giọt phenolphatalein, hiện tượng quan sát được là?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Tại catot: 2H2O + 2e → 2OH- + H2 Đáp án A Câu hỏi 2 : Khi điện phân dung dịch CuSO4 người ta thấy khối lượng catot tăng đúng bằng khối lượng anot giảm, điều đó chứng tỏ
Đáp án: C Phương pháp giải: Hiện tượng "dương cực tan": Khi kim loại làm cực dương (anot) trùng với kim loại của muối trong dung dịch chất điện phân thì xảy ra hiện tượng cực dương tan. VD: Điện phân dung dịch CuSO4 với anot làm bằng Cu thì các bán phản ứng xảy ra tại mỗi điện cực như sau: Catot (-): Cu2+ + 2e → Cu Anot (+): Cu → Cu2+ + 2e Ta thấy anot bị tan nên người ta gọi là hiện tượng "dương cực tan". Lời giải chi tiết: Hiện tượng "dương cực tan": Khi kim loại làm cực dương (anot) trùng với kim loại của muối trong dung dịch chất điện phân thì xảy ra hiện tượng cực dương tan. VD: Điện phân dung dịch CuSO4 với anot làm bằng Cu thì các bán phản ứng xảy ra tại mỗi điện cực như sau: Catot (-): Cu2+ + 2e → Cu Anot (+): Cu → Cu2+ + 2e Ta thấy anot bị tan nên người ta gọi là hiện tượng "dương cực tan". Khi đó khối lượng catot tăng đúng bằng khối lượng của anot giảm. Đáp án C Câu hỏi 3 : Dung dịch X chứa hỗn hợp các muối: NaCl, CuCl2, FeCl3 và ZnCl2. Kim loại cuối cùng thoát ra ở catot khi điện phân dung dịch X là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Các ion H+ (axit) và cation kim loại khác bị khử theo thứ tự trong dãy thế điện cực chuẩn (ion có tính oxi hóa mạnh hơn bị khử trước): Mn+ + ne → M Fe3+ > Cu2+ > Fe2+ > Zn2+ Đáp án B Câu hỏi 4 : Khi điện phân dung dịch chứa hỗn hợp Fe2(SO4)3, CuSO4 và HCl thì tại catot quá trình đầu tiên xảy ra là:
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Câu hỏi 5 : Điện phân (điện cực trơ, màng ngăn xốp) dung dịch X thấy pH tăng, dung dịch Y thấy pH giảm. Dung dịch X và dung dịch Y lần lượt có thể là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Quá trình điện phân làm pH dung dịch: - X tăng → điện phân dung dịch X tạo ion OH- → anion bên catot không bị điện phân Mặt khác để pH tăng thì nếu bên catot sinh ra OH- thì nên anot không sinh ra H+ để trung hòa H+ và OH- ví dụ như KNO3 điện phân → chất thỏa mãn là MgCl2. - pH Y giảm → quá trình điện phân bên anot sinh ra H+ → điện phân FeSO4. Đáp án B Câu hỏi 6 : Trong quá trình điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), ở cực âm (catot) xảy ra :
Đáp án: A Phương pháp giải: Lời giải chi tiết: - Các phản ứng xảy ra ở điện cực : Ở catot(-) xảy ra sư khử H2O Ở anot(+) xảy ra sự oxi hóa Cl- thành Cl2 Đáp án A Câu hỏi 7 : Phát biểu nào dưới đây không đúng về bản chất quá trình hóa học ở điện cực trong quá trình điện phân ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: ở catot xảy ra sự khử Đáp án C Câu hỏi 8 : Tiến hành điện phân dung dịch chứa CuSO4 và NaCl bằng điện cực trơ màng ngăn xốp đến khi khí bắt đầu thoát ra ở cả 2 điện cực thì ngừng. Dung dịch sau điện phân hòa tan được Al2O3. Nhận định nào sau đây đúng :
Đáp án: A Phương pháp giải: Lời giải chi tiết: Catot (-) : Cu2+ + 2e -> Cu
Anot (+) : 2Cl- - 2e -> Cl2 2H2O – 4e -> O2 + 4H+ Đáp án A Câu hỏi 9 : Trong quá trình điện phân dung dịch CuSO4 có điện cực bằng Cu, nhận thấy :
Đáp án: A Phương pháp giải: Lời giải chi tiết: Hiện tượng dương cực tan Cu + Cu2+ → Cu2+ + Cu Đáp án A Câu hỏi 10 : Hai kim loại nào sau đây chỉ có thể điều chế bằng phương pháp điện phân nóng chảy?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Điện phân nóng chảy dùng để điều chế kim loại trước Al trong dãy điện hóa Đáp án C Câu hỏi 11 : Có 4 dung dịch muối: AgNO3, KNO3, CuCl2, ZnCl2. Khi điện phân (với điện cực trơ) dung dịch muối nào thì có khí thoát ra ở cả anot và catot ngay từ lúc bắt đầu điện phân ?
Đáp án: B Phương pháp giải: - Tại catot + Các cation kim loại nhóm IA, IIA, Al không bao giờ bị khử trong dd (2H2O + e→ H2 + 2OH-) + Khi điện phân hỗn hợp nhiều cation thì các cation bị điện phân theo thứ tự ngược với dãy điện hóa + Nếu điện phân dd có chứa Fe3+ thì nó bị khử về Fe2+ sau đó mới bị khử về Fe - Tại anot + Các ion F-, NO3-. SO42-, PO43-, SO32-, CO32- không bao giờ bị oxi hóa trong dung dịch (2H2O → 4H+ + O2 + 4e) + Khi điện phân dd hỗn hợp nhiều anion thì các anion bị oxi hóa theo thứ tự I- > Br- > Cl- > OH- > H2O Lời giải chi tiết: Do đó khi bắt đầu điện phân AgNO3 thu được khí O2 ở anot KNO3 thu được khí ở cả 2 điện cực CuCl2 và ZnCl2 thu được khí Cl2 ở anot Đáp án B Câu hỏi 12 : Điện phân dung dịch HCl với điện cực trơ, màng ngăn xốp. Trong quá trình điện phân, pH của dung dịch thay đổi như thế nào ?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 13 : Điện phân dung dịch hỗn hợp: Fe(NO3)3, Cu(NO3)2, HNO3, AgNO3. Chất điện phân sau cùng là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: - Tại catot (-): xảy ra phản ứng nhận e theo thứ tự lực oxi hóa
Đáp án A Câu hỏi 14 : Trong quá trình điện phân dung dịch KCl, ở cực dương ( anot) xảy ra
Đáp án: D Phương pháp giải: + Ghi nhớ anot luôn xảy ra quá trình oxi hóa, catot luôn xảy ra quá trình khử. Lời giải chi tiết: 2KCl \(\xrightarrow{{đpnc}}\) 2K (catot) + Cl2 ( anot) Anot: xảy ra quá trình oxi hóa ion Cl- 2Cl- → Cl2 + 2e Đáp án D Câu hỏi 15 : Điện phân dung dịch chứa NaCl và HCl có thêm vài giọt quỳ. Màu của dung dịch sẽ biến đổi như thế nào trong quá trình điện phân?
Đáp án: B Phương pháp giải: NaCl, HCl (-) (+) 2H+ +2e H2 Cl- -2eCl2 Lời giải chi tiết: NaCl, HCl (-) (+) 2H+ +2e H2 Cl- -2eCl2 => Ban đầu quỳ đổi đỏ, sau khi H+ hết quỳ chuyển tím, sau đó quỳ chuyển sang xanh do bên catot sinh ra NaOH Đáp án B Câu hỏi 16 : Khi điện phân CuCl2 dung dịch (điện cực trơ) tại catot xảy ra
Đáp án: A Phương pháp giải: Viết các bán phản ứng điện phân tại các điện cực, từ đó suy ra quá trình tại catot Lời giải chi tiết: Catot(-): Cu2+, H2O Cu 2+ + 2e → Cu Anot(+): Cl-, H2O 2Cl‑ → Cl2 + 2e => sự khử ion Cu2+ Đáp án A Câu hỏi 17 : Khi điện phân NaCl nóng chảy (điện cực trơ), tại catot xảy ra
Đáp án: D Phương pháp giải: Bình điện phân: Catot (-): có mặt các ion dương Anot (+): có mặt các ion âm Viết các bán phản ứng tại mỗi điện cực từ đó xác định được quá trình ở mỗi điện cực. Lời giải chi tiết: Catot (-): Na+ + 1e → Na => quá trình nhận e => quá trình khử ion Na+ Anot (+): 2Cl- → Cl2 + 2e => quá trình nhường e => quá trình oxi hóa Cl- Đáp án D Câu hỏi 18 : Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là
Đáp án: A Phương pháp giải: Phương pháp điện phân nóng chảy thường được sử dụng để điều chế các kim loại có tính khử mạnh như: K, Na, Ba, Ca, Mg, Al. Lời giải chi tiết: A đúng B loại Zn vì Zn được điều chế bằng phương pháp thủy luyện hoặc nhiệt luyện. C loại Cu vì Cu được điều chế bằng phương pháp thủy luyện hoặc nhiệt luyện. D loại Fe vì Fe được điều chế bằng phương pháp thủy luyện hoặc nhiệt luyện. Đáp án A Câu hỏi 19 : Trong quá trình điện phân dung dịch AgNO3 (các điện cực trơ), ở anot xảy ra phản ứng nào sau đây?
Đáp án: C Phương pháp giải: Ở anot có anion NO3- đi về. Ion này không bị điện phân. Khi đó nước bị điện phân hộ. Lời giải chi tiết: Ở anot có anion NO3- đi về. Ion này không bị điện phân. Khi đó nước bị điện phân: 2H2O→ 4H+ + O2 + 4e Đáp án C Câu hỏi 20 : Có các bán phản ứng sau: (1) Cu2++ 2e → Cu (2) Cu → Cu2++ 2e (3) 2H2O + 2e → H2+ 2OH- (4) 2H2O→ 4H+ + O2 + 4e (5) 2Br- → Br2+ 2e (6) 2H++ 2e → H2 Những bán phản ứng xảy ra ở catot trong quá trình điện phân là:
Đáp án: B Phương pháp giải: Tại catot xảy ra quá trình nhận e (quá trình khử). Lời giải chi tiết: Tại catot xảy ra quá trình nhận e (quá trình khử). Vậy các bán phản ứng xảy ra tại catot là (1), (3), (6) Đáp án B Câu hỏi 21 : Điện phân các dung dịch sau đây với điện cực trơ có màng ngăn xốp: X1: KCl; X2: CuSO4; X3: KNO3;X4: AgNO3; X5: Na2SO4; X6: ZnSO4; X7: NaCl; X8: H2SO4; X9 : NaOH; X10: CaCl2 Sau khi điện phân dung dịch nào sau đây có môi trường axit?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Điện phân muối tạo bởi kim loại trung bình yếu và gốc axit có oxi sẽ thu được môi trường axit. Đó là khi điện phân CuSO4 (X2), AgNO3 (X4), ZnSO4 (X6). Còn khi điện phân H2SO4 vẫn thu được H2SO4 nên sau phản ứng vẫn có môi trường axit. CuSO4 + H2O -> Cu ↓+ H2SO4 + ½ O2↑ AgNO3+ H2O -> Ag + HNO3+ ½ O2 ZnSO4 + H2O -> Zn ↓+ H2SO4 + ½ O2↑ Đáp án B Câu hỏi 22 : Cho các dung dịch sau: NaCl (1), Na2SO4 (2), KBr (3), CuCl2 (4), AgNO3 (5). Các dung dịch bị điện phân tạo môi trường bazơ là:
Đáp án: A Phương pháp giải: Điện phân muối tạo bởi kim loại mạnh và gốc axit không có oxi sẽ thu được bazo. Lời giải chi tiết: Điện phân muối tạo bởi kim loại mạnh và gốc axit không có oxi sẽ thu được bazo. Đó là khi điện phân NaCl; KBr (Chất 1 và 3) 2NaCl + 2H2O → 2NaOH + Cl2+ H2 2KBr+ 2H2O → 2KOH + Br2+ H2 Đáp án A Câu hỏi 23 : Điện phân dung dịch MgCl2 với điện cực trơ, có màng ngăn xốp đến khi H2O bị điện phân ở cả 2 điện cực thì dừng. Sản phẩm thu được của quá trình điện phân là:
Đáp án: B Phương pháp giải: Phân tích sự điện phân ở mỗi điện cực để từ đó viết được phương trình điện phân đầy đủ: Catot: Mg2+ không bị điện phân, H2O điện phân hộ Anot: Cl- bị điện phân Lời giải chi tiết: Điện phân dung dịch MgCl2 Cl- (cực dương)← MgCl2, H2O → Mg2+ (cực âm) 2Cl- → Cl2 + 2e 2H2O + 2e →H2+ 2OH- Mg2++ 2OH- → Mg(OH)2 PT điện phân: MgCl2 + 2H2O → Mg(OH)2 + Cl2+ H2 Đáp án B Câu hỏi 24 : Cho 2 phản ứng sau : NaCl + H2O \(\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{mang\,ngan}^{dien\,phan}} \) X + Y↑ + Z↑ (1) (anot) (catot) X + CO2 (dư) → T (2) Chọn phát biểu đúng :
Đáp án: C Phương pháp giải: Dựa vào kiến thức về lý thuyết điện phân Lời giải chi tiết: Phản ứng: NaCl + H2O → NaOH + 0,5H2↑ + 0,5Cl2↑ (X) (Z) (Y) NaOH + CO2 dư → NaHCO3 (T) A sai vì CaO không phản ứng với H2 B sai vì nước Giaven là NaClO,NaCl D sai vì khí Clo có màu vàng. Đáp án C Câu hỏi 25 : Điện phân dung dịch chứa H2SO4 trong một thời gian ngắn. pH của dung dịch biến đổi như thế nào trong quá trình điện phân?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Ở anot nước bị điện phân. Vì thế một phần nước sẽ chuyển hóa thành H2 và O2 bay lên → thể tích dung dịch giảm đi nên nồng độ H+ tăng lên → pH giảm nhẹ lên (vì chỉ điện phân trong thời gian ngắn) Đáp án B Câu hỏi 26 : Điện phân dung dịch KCl bão hòa, có màng ngăn giữa hai điện cực. Sau một thời gian điện phân, dung dịch thu được có môi trường
Đáp án: D Phương pháp giải: Viết phương trình điện phân. Từ đó suy ra môi trường của dung dịch thu được sau điện phân. Lời giải chi tiết: Phương trình điện phân: KCl + H2O \(\xrightarrow{dpmn}\) KOH + H2 + Cl2 Vậy sau một thời gian dung dịch thu được có môi trường kiềm (do điện phân tạo KOH) Đáp án D Câu hỏi 27 : Điện phân dung dịch chứa hỗn hợp gồm HCl, FeCl3, CuCl2. Thứ tự điện phân ở catot là
Đáp án: A Phương pháp giải: Trong quá trình điện phân , ở catot những ion nào có tính oxi hóa mạnh hơn bị khử trước. Lời giải chi tiết: Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O (Fe2+ do Fe3+ bị điện phân sinh ra) => Thứ tự điện phân ở catot là: Fe3+ > Cu2+ > H+ > Fe2+ > H2O Đáp án A Câu hỏi 28 : Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy
Đáp án: D Phương pháp giải: Dựa vào kiến thức về điều chế kim loại học trong bài đại cương về kim loại sgk hóa 12 Lời giải chi tiết: Mg chỉ điều chế bằng phương pháp điện phân nóng chảy Đáp án D Câu hỏi 29 : Điện phân (điện cực trơ) dung dịch NaCl và CuSO4 (tỉ lệ mol tương ứng là 3 : 1) đến khi catot xuất hiện bọt khí thì dừng lại. Sản phẩm khí thu được ở anot là
Đáp án: D Phương pháp giải: Khi catot xuất hiện bọt khí thì dừng lại tức là Cu2+ điện phân vừa hết. Viết các phản ứng điện phân tại các điện cực và suy ra sản phẩm khí thu được ở anot. Lời giải chi tiết: Giả sử nCl- = 3 mol và nCu2+ = 1 mol Khi catot xuất hiện bọt khí thì dừng lại tức là Cu2+ điện phân vừa hết. Khi đó các phản ứng điện phân tại các điện cực là:
Vậy sản phẩm khí thu được ở anot là Cl2. Đáp án D Câu hỏi 30 : Kim loại nào sau đây được điều chế bằng cả ba phương pháp (thủy luyện, nhiệt luyện, điện phân)?
Đáp án: D Phương pháp giải: Phương pháp thủy luyện: - Nguyên tắc: Dùng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-…) hòa tan nguyên liệu sau đó lấy kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi dung dịch của nó. - Phạm vi sử dụng: Thường dùng trong phòng thí nghiệm để điều chế các kim loại sau Mg (thường là kim loại yếu). Phương pháp nhiệt luyện: - Nguyên tắc: Dùng chất khử CO, C, Al, H2 khử oxit kim loại ở nhiệt độ cao. - Phạm vi sử dụng: Thường dùng trong công nghiệp với kim loại sau Al. Phương pháp điện phân: - Nguyên tắc: Dùng dòng điện một chiều để khử các ion kim loại. - Phạm vi sử dụng: Điều chế được hầu hết các kim loại. Lời giải chi tiết: - Loại Na vì Na chỉ được điều chế bằng phương pháp điện phân - Loại Al vì Al2O3 không bị khử bởi C, CO, H2… nên không thể được điều chế bằng phương pháp nhiệt luyện - Loại Mg vì MgO không bị khử bởi C, CO, H2… nên không thể được điều chế bằng phương pháp nhiệt luyện - Cu thỏa mãn Đáp án D Câu hỏi 31 : Khi điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước thì xảy ra hiện tượng nào trong số các hiện tượng cho dưới đây ?
Đáp án: B Phương pháp giải: Lý thuyết về điện phân. Lời giải chi tiết: Catot: \(Na^+\), \(H_2O\) nước điện phân trước thu được khí hiđro \(2H_2O +2 e\to 2OH^- + H_2\) Anot: \(Cl^-\), \(H_2O\), ion \(Cl^-\) điện phân trước thu được khí Clo \(2Cl^- \to Cl_2 +2e\) Đáp án B Câu hỏi 32 : Trong số những công việc sau, công việc nào không được thực hiện trong công nghiệp bằng phương pháp điện phân ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Điều chế kim loại Fe không được thực hiện trong công nghiệp bằng phương pháp điện phân Đáp án C Câu hỏi 33 : Có thể thu được kim loại nào trong số các kim loại sau : Cu, Na, Ca, Al bằng cả 3 phương pháp điều chế kim loại phổ biến (nhiệt luyện, thuỷ luyện, điện phân) ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Cu được điều chế bằng ba phương pháp nhiệt luyện, thuỷ luyện, điện phân. Đáp án C Câu hỏi 34 : Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ:
Đáp án: B Phương pháp giải: Lý thuyết về điện phân. Lời giải chi tiết: Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ: Catot (-): Cu2+ + 2e → Cu Anot (+): 2Cl- → Cl2 + 2e Vậy phát biểu đúng là: Ion Cu2+ nhận electron ở catot. Đáp án B Câu hỏi 35 : Trả lời các câu hỏi dưới đây. Câu 1: Cho các phương trình điều chế Cu từ CuSO4 sau: (1) \(2CuS{O_4} + 2{H_2}O\xrightarrow{{dpdd}}2Cu + 2{H_2}S{O_4} + {O_2}\) (2) \(CuS{O_4} + Ba \to BaS{O_4} + Cu\) (3) \(CuS{O_4} + Fe \to FeS{O_4} + Cu\) (4) \(CuS{O_4}\xrightarrow{{dpnc}}Cu + S{O_2} + {O_2}\) Số phương trình đúng là
Đáp án: B Phương pháp giải: Lý thuyết điều chế kim loại. Lời giải chi tiết: Phương trình đúng là: (1) \(2CuS{O_4} + 2{H_2}O\xrightarrow{{dpdd}}2Cu + 2{H_2}S{O_4} + {O_2}\) (3) \(CuS{O_4} + Fe \to FeS{O_4} + Cu\) Vậy có 2 phương trình đúng. Đáp án B Câu 2: Sơ đồ điều chế Fe từ FeS nào sau đây không đúng ?
Đáp án: C Phương pháp giải: Lý thuyết điều chế kim loại. Lời giải chi tiết: Sơ đồ không đúng là: \(FeS\xrightarrow{{ + HCl}}F{\text{e}}C{l_2}\xrightarrow{{ + Cu}}F{\text{e}}\) Vì Cu yếu hơn Fe nên không thể đẩy Fe ra khỏi dung dịch muối FeCl2. Đáp án C Câu hỏi 36 : Khi điện phân dung dịch X với điện cực trơ thì pH của dung dịch tăng. Dung dịch X là:
Đáp án: B Phương pháp giải: Điện phân X thì pH dung dịch tăng có 2 khả năng: +) Giảm H+(điện phân H+) +) Tăng tạo OH- (khi điện phân muối halogen của KLK, KLKT) Lời giải chi tiết: Xét các phản ứng điện phân: A. Na+ và SO42- không bị điện phân nên nước điện phân hộ: H2O → H2 + O2 → pH không đổi B. 2H+ + 2Cl- → H2 + Cl2 → Nồng độ H+ giảm → pH tăng C. 2H+ + H2O → H2 + 0,5 O2 + 2H+ hay H2O → H2 + O2 → Nồng độ H+ không đổi → pH không đổi D. Cu2+ + H2O → Cu + 0,5 O2 + 2H+ → Nồng độ H+ tăng → pH giảm Đáp án B Câu hỏi 37 : Nhận định nào đúng về quá trình xảy ra ở cực âm và cực dương khi điện phân dung dịch NaCl và điện phân NaCl nóng chảy?
Đáp án: C Phương pháp giải: Viết các quá trình xảy ra ở các cực khi điện phân dung dịch NaCl và điện phân nóng chảy NaCl và kết luận. Lời giải chi tiết: Điện phân dung dịch NaCl: 2NaCl + 2H2O → 2NaOH + Cl2 + H2 Điện phân NaCl nóng chảy: 2NaCl → 2Na + Cl2 → ở catot, điện phân dung dịch NaCl là quá trình khử nước, điện phân NaCl nỏng chảy là quá trình khử ion Na+, ở anot đều có quá trình oxi hóa ion Cl- Đáp án C Câu hỏi 38 : Điện phân dung dịch hỗn hợp AgNO3, Cu(NO3)2, Fe(NO3)3. Các chất lần lượt xuất hiện tại catot theo thứ tự
Đáp án: C Phương pháp giải: Khi điện phân, ở catot, ion có tính oxi hóa mạnh hơn bị điện phân trước. Lời giải chi tiết: Khi điện phân, ở catot, ion có tính oxi hóa mạnh hơn bị điện phân trước. Do đó thứ tự điện phân ở catot như sau: Ag+ + 1e → Ag Fe3+ + 1e → Fe2+ Cu2+ + 2e → Cu Fe2+ + 2e → Fe Các chất lần lượt xuất hiện tại catot theo thứ tự Ag, Cu, Fe. Đáp án C Câu hỏi 39 : Điện phân dung dịch CuSO4 với anot bằng đồng (anot tan) và điện phân dung dịch CuSO4 với anot bằng graphit (điện cực trơ) đều có đặc điểm chung là:
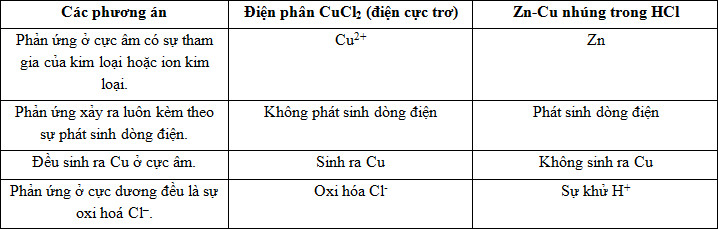
Đáp án: D Phương pháp giải: Phân tích sự điện phân ở mỗi điện cực của từng thí nghiệm và rút ra đặc điểm chung của 2 thí nghiệm. Lời giải chi tiết: - Điện phân dung dịch CuSO4 với anot bằng đồng thì: + Ở anot xảy ra quá trình oxi hóa nước: 2H2O→ 4H+ + O2 + 4e + Ở catot xảy ra quá trình khử ion Cu2++ 2e →Cu - Điện phân dung dịch CuSO4 với điện cực anot bằng than chì thì: + Ở anot xảy ra quá trình oxi hóa Cu → Cu2++ 2e + Ở catot xảy ra quá trình khử Cu2++ 2e →Cu Do đó đặc điểm chung là: Ở catot xảy ra quá trình khử Cu2++ 2e →Cu Đáp án D Câu hỏi 40 : Phản ứng điện phân dung dịch CuCl2 (với điện cực trơ) và phản ứng ăn mòn điện hoá xảy ra khi nhúng hợp kim Zn - Cu vào dung dịch HCl có đặc điểm là:
Đáp án: A Phương pháp giải: Phân tích các quá trình khử và oxi hóa tại các điện cực của sự điện phân và ăn mòn điện hóa. Từ đó xác định đặc điểm chung ở 2 quá trình. Lời giải chi tiết: - Điện phân dung dịch CuCl2: Cực âm (catot): Cu2+ + 2e → Cu Cực dương (anot): 2Cl- -2e → Cl2 => Phản ứng không phát sinh ra dòng điện mà chỉ diễn ra nhờ tác dụng của dòng điện. - Ăn mòn điện hóa Zn - Cu trong dung dịch HCl: Cực âm: Zn -2e → Zn2+ Cực dương: 2H+ + 2e → H2 Bảng so sánh:
Đáp án A
|