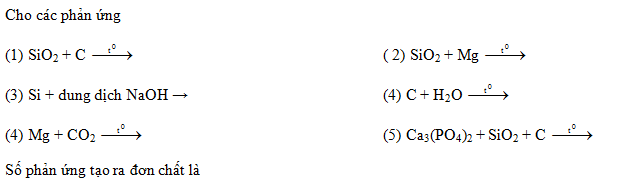30 câu hỏi lý thuyết về silic và hợp chất của silic có lời giảiLàm bàiCâu hỏi 1 : Phản ứng nào sau đây không đúng
Đáp án: B Phương pháp giải: Lời giải chi tiết: B sai do không có phản ứng xảy ra Đáp án B Câu hỏi 2 : Silic đioxit (SiO2) tan được trong:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của SiO2. Lời giải chi tiết: SiO2 có thể tan được trong dung dịch HF: SiO2 + 4HF → SiF4 + 2H2O Đáp án C Câu hỏi 3 : Si có nhiều ứng dụng trong thực tế là do tính chất bán dẫn, các ứng dụng sau đây đều sử dụng tính bán dẫn. Câu nhận xét nào sau đây không đúng
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 4 : Chọn câu nhận xét sai:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 5 : Số Oxi hóa cao nhất của silic thể hiện ở hợp chất nào sau đây :
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 6 : Để khắc chữ lên thủy tinh người ta dựa vào phản ứng nào sau đây:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 7 : Thành phần chính của cát là:
Đáp án: D Phương pháp giải: Lý thuyết về hợp chất của silic. Lời giải chi tiết: Thành phần chính của cát là SiO2. Đáp án D Câu hỏi 8 : Silic và nhôm cùng phản ứng với dãy chất nào sau đây?
Đáp án: A Phương pháp giải: Lời giải chi tiết: - A đúng PTHH: Si + O2 \(\overset{t^o}{\rightarrow}\) SiO2 4Al + 3O2 \(\overset{t^o}{\rightarrow}\) 2Al2O3 Si + 2NaOH + H2O → Na2SiO3 + 2H2 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 - B loại Mg vì Al không phản ứng - C loại Na vì Al không phản ứng - D loại MgO vì Al không phản ứng Đáp án A Câu hỏi 9 : Cho sơ đồ sau: Si \(\xrightarrow[?]{(1)}\) SiO2 \(\xrightarrow[?]{(2)}\) Na2SiO3 \(\xrightarrow[?]{(3)}\) H2SiO3. Các chất cần lấy trong phản ứng (1), (2), (3) là:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của silic và hợp chất của silic. Lời giải chi tiết: Si \(\xrightarrow[O_2]{(1)}\) SiO2 \(\xrightarrow[NaOH]{(2)}\) Na2SiO3 \(\xrightarrow[HCl]{(3)}\) H2SiO3. PTHH: (1) Si + O2 \(\overset{t^o}{\rightarrow}\) SiO2 (2) SiO2 + 2NaOH → Na2SiO3 + H2O (3) Na2SiO3 + 2HCl → NaCl + H2SiO3 Đáp án C Câu hỏi 10 : Silic đioxit và nhôm oxit cùng phản ứng với chất nào sau đây?
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của silic đioxit và nhôm oxit. Lời giải chi tiết: - A loại vì SiO2 và Al2O3 đều không phản ứng với O2 - B loại vì Mg không phản ứng với Al2O3 - C loại vì SiO2 không phản ứng với Ba(OH)2 đặc ở nhiệt độ thường - D đúng PTHH: SiO2 + 2KOH \(\overset{t^o}{\rightarrow}\) K2SiO3 + H2O Al2O3 + 2KOH → 2KAlO2 + H2O Đáp án D Câu hỏi 11 : Silic và kẽm cùng phản ứng với dãy chất nào sau đây?
Đáp án: A Phương pháp giải: Lời giải chi tiết: - A đúng PTHH: Si + O2 \(\overset{t^o}{\rightarrow}\) SiO2 2Zn + O2 \(\overset{t^o}{\rightarrow}\) 2ZnO Si + 2NaOH + H2O → Na2SiO3 + 2H2 Zn + 2NaOH → Na2ZnO2 + H2 - B loại vì Zn không phản ứng với Mg - C loại vì Zn không phản ứng với Na - D loại vì Zn không phản ứng với MgO Đáp án A Câu hỏi 12 : Dung dịch chất nào sau đây không thể chứa trong bình thủy tinh? .
Đáp án: D Phương pháp giải: Lời giải chi tiết: HF là một axit yếu nhưng có khả năng hòa tan thủy tinh nên người ta thường dung HF để taoh hình trên bề mặt thủy tinh Do đó không đựng HF trong bình thủy tinh Đáp án D Câu hỏi 13 : Sục khí HCl vào dung dịch Na2SiO3 thu được kết tủa là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ta có 2HCl + Na2SiO3 → 2NaCl + H2SiO3 Đáp án C Câu hỏi 14 : Silic có những dạng thù hình nào?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: Silic có 2 dạng thù hình là silic tinh thể và silic vô định hình Đáp án D Câu hỏi 15 : Tại sao silic tinh thể được sử dụng để làm các chất bán dẫn trong các thiết bị điện tử, pin mặt trời?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: Silic tinh thể có tính bán dẫn: ở nhiệt độ thường dẫn điện thấp, nhưng khi tăng nhiệt độ thì độ dẫn điện tăng lên nên được sử dụng rộng rãi để làm các chất bán dẫn trong các thiết bị điện tử, pin mặt trời => chọn D Đáp án D Câu hỏi 16 : Trong các phản ứng hoá học sau đây,phản ứng nào dùng để khắc thủy tinh?
Đáp án: A Phương pháp giải: Phương pháp: Thành phần chính của thủy tinh là SiO2 còn HF là axit yếu nhưng lại có thể ăn mòn thủy tinh do phản ứng: SiO2 + 4HF -> SiF4 + 2H2O Lưu ý: Không nên sử dụng vật chứa bằng thủy tinh để đựng axit HF Lời giải chi tiết:
Hướng dẫn giải: HF ăn mòn thủy tinh do phản ứng SiO2 + 4HF -> SiF4 + 2H2O Đáp án A Câu hỏi 17 : Si phản ứng với tất cả các chất trong dãy nào sau đây
Đáp án: B Phương pháp giải: Phương pháp: Tính chất hóa học của Si * Tính khử - Tác dụng với phi kim (O2, F2...) - Tác dụng với hợp chất (vd: NaOH) * Tính oxi hóa: - Tác dụng với kim loại (Ca, Mg, Fe..) Lời giải chi tiết:
Hướng dẫn giải: - Si không tác dụng với axit => Loại A,C - Si không tác dụng với muối => Loại D - Si có tác dụng với F2, Mg, NaOH Si + 2F2 -> SiF4 Si + 2NaOH + H2O -> Na2SiO3 + H2 Mg + Si -> Mg2Si Đáp án B Câu hỏi 18 : Phương trình hóa học nào sau đây không đúng?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 19 : Phản ứng nào sau đây không chính xác: (coi điều kiện có đủ)
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 20 : Khẳng định nào sau đây không đúng?
Đáp án: A Phương pháp giải: Lời giải chi tiết: A. đúng SiO2 + 4HF → SiF4 + 2H2O ( phương trình này ứng dụng dùng để khác thủy tinh) B. Sai: Si + 2Mg \(\xrightarrow{{{t^0}}}\) Mg2Si C. Sai vì thành phần chính của thạch cao nung là CaSO4.H2O hoặc CaSO4.0,5H2O. D. Sai Si + 2NaOH + H2O → Na2SiO3 + 2H2↑ Đáp án A Câu hỏi 21 : Chọn phát biểu đúng.
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 22 : Phương trình hóa học nào sau đây không đúng?
Đáp án: A Phương pháp giải: Tính chất hóa học của SiO2 Lời giải chi tiết: SiO2 không phản ứng được với axit HCl nên phản ứng ở câu A không xảy ra. Đáp án A Câu hỏi 23 : Cho nhận xét sau: 1) Silic vừa thể hiện tính khử vừa thể hiện tính oxi hóa. 2) Trong công nghiệp, silic được điều chế bằng cách đốt cháy hỗn hợp gồm bột Mg và cát nghiền mịn. 3) SiO2 là một oxit axit, tan được trong nước tạo ra axit silixic. 4) Silic siêu tinh khiết là chất bán dẫn trong kĩ thuật vô tuyến và điện tử. 5) Axit silixic có tính axit yếu hơn axit cacbonic. Số nhận xét đúng là:
Đáp án: C Phương pháp giải: Dựa vào tính chất vật lí, tính chất hóa học của silic và hợp chất của silic để xác định các nhận xét đúng. Lời giải chi tiết: 1) Đúng: Silic có các số oxi hóa là -4; 0; +2; +4. Tuy nhiên số oxi hóa +2 ít phổ biến. 2) Sai: Trong công nghiệp, silic được điều chế bằng cách dùng than cốc khử SiO2 trong lò điện ở nhiệt độ cao. 3) Sai: SiO2 là oxit axit nhưng không tan trong nước 4) Đúng 5) Đúng. Ví dụ: Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 Vậy có 3 nhận xét đúng. Đáp án C Câu hỏi 24 : Số oxi hóa cao nhất của Silic thể hiện ở hợp chất nào trong các chất sau đây?
Đáp án: B Phương pháp giải: Quy tắc xác định số oxi hóa: 1. Trong các đơn chất, số oxi hóa của nguyên tố bằng 0 2. Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0. 3. Trong các ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion. 4. Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 (trừ hiđrua kim loại). Số oxi hóa của O bằng -2 (trừ OF2 và peoxit). Lời giải chi tiết: \(\mathop {Si}\limits^{ + 2} \mathop O\limits^{ - 2} ;\,\,\,\,\,\,\,\,\mathop {Si}\limits^{ + 4} {\mathop O\limits^{ - 2} _2};\,\,\,\,\,\,\,\mathop {Si}\limits^{ - 4} {\mathop H\limits^{ + 1} _4};\,\,\,\,\,\,\,{\mathop {Mg}\limits^{ + 2} _2}\mathop {Si}\limits^{ - 4} \) Vậy trong SiO2 thì Si có số oxi hóa cao nhất. Đáp án B Câu hỏi 25 : Cấu hình electron nguyên tử của Si (Z=14) là
Đáp án: B Phương pháp giải: Dựa vào kiến thức về Silic trong sgk hóa 11 - trang 76 Lời giải chi tiết: Si (Z = 14): 1s22s22p63s23p2 Đáp án B Câu hỏi 26 : Trong các phản ứng hoá học sau đây: 1- C + H2 2-C + H2O 3-C + Ca 4-Si + Mg 5- Si + dd NaOH 6-C + O2 7-Si + Cl2 thì phản ứng nào mà C, Si thể hiện tính oxi hoá:
Đáp án: B Phương pháp giải: Một chất thể hiện tính oxi hóa khi số oxi hóa của nó giảm Lời giải chi tiết: 1. Tạo thành CH4 => số oxi hóa giảm xuống -4 => tính oxi hóa 2. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử 3. Tạo thành CaC2 => số oxi hóa giảm xuống -1 => tính oxi hóa 4. Tạo thành Mg2Si => số oxi hóa giảm xuống -4 => tính oxi hóa 5. Tạo thành Na2SiO3 => số oxi hóa tăng lên +4 => tính khử 6. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử 7. Tạo thành SiCl4 => số oxi hóa tăng lên +4 => tính khử Đáp án B Câu hỏi 27 : Các bon và silic đều có tính chất nào sau đây giống nhau :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 28 : Phát biểu nào sau đây không đúng : a) Dung dịch đậm đặc của Na2SiO3 và K2SiO3 là thủy tinh lỏng b) Đám cháy Magie có thể được dập tắt bởi cát khô c) Thủy tinh có cấu trúc vô định hình, khi nung nóng nó mềm dần rồi mới chảy d) Than chì là tinh thể có ánh kim, dẫn điện tốt , có cấy trúc lớp e) Kim cương là cấu trúc tinh thể phân tử, Tinh thể kim cương cứng nhất trong số các chất f) Silic tinh thể có tính bán dẫn, ở nhiệt độ thường thì độ dẫn điện cao nhưng ở nhiệt độ cao thì độ dẫn điện giảm
Đáp án: D Phương pháp giải: Lời giải chi tiết: b) Đám cháy Magie có thể được dập tắt bởi cát khô => Sai. Vì có phản ứng : 2Mg + SiO2(cát) ® 2MgO + Si e) Kim cương là cấu trúc tinh thể phân tử, Tinh thể kim cương cứng nhất trong số các chất => Sai. Vì Kim cương có cấu trúc nguyên tử f) Silic tinh thể có tính bán dẫn, ở nhiệt độ thường thì độ dẫn điện cao nhưng ở nhiệt độ cao thì độ dẫn điện giảm => Sai. Vì Silic càng tăng nhiệt thì tính dẫn điện sẽ tăng Đáp án D Câu hỏi 29 :
Đáp án: D Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} => Tất cả 6 phản ứng đều tạo ra đơn chất Đáp án D Câu hỏi 30 : Trong các thí nghiệm sau (1) Cho SiO2 tác dụng với dung dịch HF (2) Cho khí SO2 tác dụng với khí H2S (3) Cho khí NH3 tác dụng với CuO đun nóng (4) Cho KMnO4 tác dụng với dung dịch HCl đặc (5) Cho Si đơn chất tác dụng với dung dịch NaOH (6) Cho khí O3 tác dụng với Ag Số thí nghiệm tạo ra đơn chất là
Đáp án: D Phương pháp giải: Viết PTHH Lời giải chi tiết: (1) Không tạo ra đơn chất vì SiO2 + 4HF → SiF4 +2H2O (2) Tạo ra đơn chất SO2 + 2H2S → 3S↓ + 2H2O (3) Tạo ra đơn chất 2NH3 + 3CuO → 3Cu↓ + N2↑ + 3H2O (4) Tạo ra đơn chất KMnO4 + 8HCl → KCl + MnCl2 + H2O + 5/2Cl2↑ (5) Tạo ra đơn chất Si + 2NaOH + H2O → Na2SiO3 + 2H2↑ (6) Tạo ra đơn chất O3 + 2Ag → Ag2O + O2↑ Số thí nghiệm tạo ra đơn chất là 5 Đáp án D |