30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giảiLàm bàiCâu hỏi 1 : Cho 0,5 gam hỗn hợp X gồm Li, Na, K vào nước thu được 2 lít dung dịch Y. Trộn 8 gam hỗn hợp X và 5,4 gam bột Al rồi cho vào nước đến khi kim loại tan hết thấy có 10,304 lít khí thoát ra (đktc). Dung dịch Y có pH bằng:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 2 : Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có chứa 20,52 gam Ba(OH)2. Để tác dụng tối đa với dung dịch Y cần dùng hết V lít CO2 ở đktc. Giá trị của V là:
Đáp án: C Phương pháp giải: Quy đổi hỗn hợp ban đầu thành Na, Ba, O. + mX => (1) + Bte => (2) Lời giải chi tiết: \(\begin{gathered} Đáp án C Câu hỏi 3 : Hòa tan hết m gam hỗn hợp X gồm Na2O, K, K2O, Ba, BaO (trong đó oxi chiếm 8% khối lượng hỗn hợp) vào lượng nước dư thu được dung dịch Y và 1,792 lít H2 (đktc). Dung dịch Y hòa tan tối đa 8,64 gam Al. Giá trị của m là
Đáp án: D Phương pháp giải: => nOH- (dd Y) = nAl = ? (mol) => nOH- ( do oxit tạo) = ? (mol) => nO (trong oxit) = ½ nOH- ( do oxit tạo ra) = ? (mol) Lời giải chi tiết: \({n_{{H_2}}} = \frac{{1,792}}{{22,4}} = 0,08\,(mol);\,{n_{Al}} = \frac{{8,64}}{{27}} = 0,32\,(mol)\) => nOH- ( do kim loại tạo)= 2nH2 = 0,16 (mol) Al + OH- + H2O → AlO2- + 3/2H2↑ => nOH- (dd Y) = nAl = 0,32 (mol) => nOH- ( do oxit tạo) = 0,32 – 0,16 = 0,16 (mol) => nO (trong oxit) = ½ nOH- ( do oxit tạo ra) = 0,08 (mol) Vì O chiếm 8% => \({m_{hh}} = \frac{{{m_O}.100\% }}{{8\% }} = \frac{{0,08.16.100\% }}{{8\% }} = 16(g)\) Đáp án D Câu hỏi 4 : Cho 84 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 20% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M và dung dịch Y, thu được m gam kết tủa. Giá trị của m là:
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố Lời giải chi tiết: $\begin{gathered} Vậy OH- dư. ${n_{Al{O_2}^ - }} = 0,35.2 = 0,7\,mol$ , nOH- dư = 1,2- 0,35.2=0,5 mol. ${n_{{H^ + }}} = 3,2.0,75 = 2,4mol;\,{H^ + } + O{H^ - }\xrightarrow{{}}{H_2}O$ => nH+dư = 2,4-0,5=1,9mol. $\begin{gathered} Đáp án A Câu hỏi 5 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Na và BaO vào nước dư, thu được dung dịch Y và 0,085 mol khí H2. Cho từ từ đến hết dung dịch chứa 0,03 mol H2SO4 và 0,1 mol HCl vào Y, thu được 3,11 gam hỗn hợp kết tủa và dung dịch Z chỉ chứa 7,43 gam hỗn hợp các muối clorua và muối sunfat trung hòa. Giá trị của m là
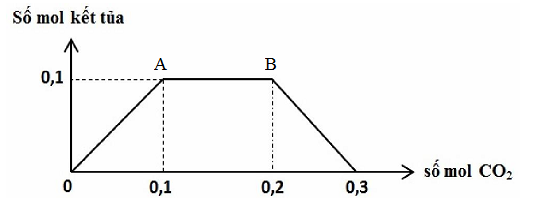
Đáp án: B Phương pháp giải: Phương pháp: Quy đổi hỗn hợp thành Al, Na, BaO. Lời giải chi tiết: \(\begin{gathered} Đáp án B Câu hỏi 6 : Cho hỗn hợp kim loại gồm x mol Na và y mol Ba vào nước dư được V lít H2 (đo ở điều kiện tiêu chuẩn) và dung dịch X. Khi cho CO2 hấp thụ từ từ đến dư vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ lệ x : y là
Đáp án: C Phương pháp giải: Tại điểm A: Kết tủa vừa đạt giá trị lớn nhất: nBaCO3 = nBa2+ → nBa(OH)2 → y Tại điểm B: kết tủa tan dần ra: nCO3(2-) = nOH-- nCO2 → nOH-→ nNaOH = x Từ đó tìm được tỉ lệ x : y Lời giải chi tiết: Tại điểm A: Kết tủa vừa đạt giá trị lớn nhất: nBaCO3 = nBa2+ = 0,1 mol→ nBa(OH)2 = 0,1 mol → y = 0,1 mol Tại điểm B: kết tủa tan dần ra: nCO3(2-) = nOH-- nCO2 →0,1 = nOH- - 0,2 → nOH- = 0,3 mol → nNaOH = 0,3- 0,1.2 = 0,1 mol = x Vậy x : y = 0,1 : 0,1 = 1:1 Đáp án C Câu hỏi 7 : Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Ba + H2O → Ba(OH)2 + H2↑ Al + Ba(OH)2 + H2O → Ba(AlO2)2 + H2↑ Dd Y gồm Ba(OH)2 dư: 0,5a (mol); Ba(AlO2)2 : 0,5a (mol) H+ + OH- → H2O a → a (mol) H+ + AlO2- + H2O → Al(OH)3↓ a → a → a (mol) Ba2+ + SO42- → BaSO4 a → a → a (mol) Vậy rắn T gồm Al(OH)3 và BaSO4 => nung thu được rắn G là: Al2O3 và BaSO4 Đáp án A Câu hỏi 8 : Hoà tan hỗn hợp X gồm Na và Al vào nước dư thu được V lít khí. Cũng hoà tan m gam hỗn hợp X trên vào dung dịch NaOH dư thì thu được 1,5V lít khí. Tính % khối lượng của Al trong hỗn hợp ban đầu?
Đáp án: A Phương pháp giải: Đặt nNa = 1 mol Thí nghiệm 1 Al dư thì thể tích khí H2 thu được mới ít hơn H2 ở thí nghiệm 2: Viết các phương trình hóa học xẩy ra: Na + H2O → NaOH + ½ H2 NaOH + Al + H2O → NaAlO2 + 3/2 H2 Từ số mol Na và số mol khí ta tính được số mol Al. Từ đó tính được % khối lượng Al trong hỗn hợp ban đầu. Lời giải chi tiết: Đặt nNa = 1 mol Thí nghiệm 1 Al dư thì thể tích khí H2 thu được mới ít hơn H2 ở thí nghiệm 2: Thí nghiệm 1: Na + H2O → NaOH + ½ H2 1 → 1 0,5 mol NaOH + Al + H2O → NaAlO2 + 3/2 H2 1 → 1,5 mol Vậy V = 0,5 + 1,5 = 2 mol Thí nghiệm 2: cả Na và Al đều hết ta thu được 1,5V = 3,0 mol H2 Na + H2O → NaOH + ½ H2 1 → 1 0,5 mol NaOH + Al + H2O → NaAlO2 + 3/2 H2 5/3 ← 2,5 mol Vậy %mAl = 27.5/3.100%/(27.5/3 + 23.1) = 66,18% Đáp án A Câu hỏi 9 : Một hỗn hợp gồm Na, Al có tỷ lệ số mol là 1 : 2. Cho hỗn hợp này vào nước. Sau khi kết thúc phản ứng thu được 8,96 lít H2 (đktc) và chất rắn không tan. Khối lượng chất rắn là:
Đáp án: C Phương pháp giải: Đặt nNa = x mol; nAl = 2x mol Na + H2O → NaOH + ½ H2 NaOH + Al + H2O → NaAlO2 + 3/2 H2 Chất rắn không tan là Al dư Từ phương trình tìm được giá trị x, từ đó tính được khối lượng Al dư. Lời giải chi tiết: Đặt nNa = x mol; nAl = 2x mol Na + H2O → NaOH + ½ H2 X → x x/2 mol NaOH + Al + H2O → NaAlO2 + 3/2 H2 x 2x Pứ x → x 3/2x mol Sau pứ 0 x mol Ta có: nH2 = x/2+ 3x/2 = 0,4 mol → x = 0,2 mol → Khối lượng chất rắn sau phản ứng là x.27 = 5,4 gam Đáp án C Câu hỏi 10 : Cho m gam hỗn hợp X gồm Na và Al vào nước dư được V lít H2. Mặt khác, cho m gam hỗn hợp X vào dung dịch NaOH dư thu được 2V lít H2 (đktc). Vậy % số mol của Al trong hỗn hợp X là:
Đáp án: D Phương pháp giải: Đặt nNa = 1 mol Thí nghiệm 1 Al dư thì thể tích khí H2 thu được mới ít hơn H2 ở thí nghiệm 2: Na + H2O → NaOH + ½ H2 NaOH + Al + H2O → NaAlO2 + 3/2 H2 Dựa vào phương trình và đề bài để tìm số mol Al. Từ đó tính % số mol Al trong hỗn hợp X. Lời giải chi tiết: Đặt nNa = 1 mol Thí nghiệm 1 Al dư thì thể tích khí H2 thu được mới ít hơn H2 ở thí nghiệm 2: Thí nghiệm 1: Na + H2O → NaOH + ½ H2 1→ 1 0,5 mol NaOH + Al + H2O → NaAlO2+ 3/2 H2 1 → 1,5 mol Vậy V = 0,5 + 1,5 = 2 mol Thí nghiệm 2: Na và Al đều hết ta thu được 2V = 4 mol H2 Na + H2O → NaOH + ½ H2 1 → 1 0,5 mol NaOH + Al + H2O → NaAlO2 + 3/2 H2 7/3 ← 3,5 mol Vậy %nAl = 7/3.100%/(1+7/3) = 70% Đáp án D Câu hỏi 11 : Cho m gam hỗn hợp A gồm K và Al tác dụng với nước dư, thu được 4,48 lít khí H2 (đktc). Nếu cho m gam A tác dụng với dung dịch NaOH dư thì thu được 7,84 lít khí H2 (đktc). Phần trăm khối lượng của K trong A là:
Đáp án: C Phương pháp giải: Thí nghiệm 1: Do tác dụng với H2O dư nên kim loại kiềm phản ứng hết K + H2O → KOH + ½ H2 KOH + Al + H2O → KAlO2 + 3/2 H2 Thí nghiệm 2: Do tác dụng với NaOH dư nên kim loại kiềm và Al đều phản ứng hết K + H2O → KOH + ½ H2 Al chắc chắn tan hết vì NaOH dư: NaOH + Al + H2O → NaAlO2 + 3/2 H2 Từ số mol H2 trong 2 thí nghiệm ta tìm được số mol của K và Al trong hỗn hợp. Từ đó tính được %mK trong hỗn hợp. Lời giải chi tiết: Thí nghiệm 1: Do tác dụng với H2O dư nên kim loại kiềm phản ứng hết K + H2O → KOH + ½ H2 x→ x x/2 mol KOH + Al + H2O → KAlO2+ 3/2 H2 x → 3/2x mol Ta có: nH2 = x/2 + 3x/2 = 0,2 mol → x = 0,1 mol Thí nghiệm 2: Do tác dụng với NaOH dư nên kim loại kiềm và Al đều phản ứng hết K + H2O → KOH + ½ H2 0,1 → 0,05 mol Al chắc chắn tan hết vì NaOH dư: NaOH + Al + H2O → NaAlO2 + 3/2 H2 0,2 ← 0,3 mol Rõ ràng trong thí nghiệm 1 phải có Al chưa tan hết Nếu thí nghiệm với nước có số mol H2 nhỏ hơn thì chắc chắn Al dư. Ta có %mK = 0,1.39.100%/(0,1.39 + 0,2.27) = 41,94% Đáp án C Câu hỏi 12 : Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
Đáp án: A Phương pháp giải: Quy đổi hỗn hợp ban đầu thành: Na (x mol), K (y mol), Ba (z mol) và O (t mol) +) BT e: nNa + nK + 2nBa = 2nO + 2nH2 => (1) +) %mO => (2) +) BTĐT: nOH- (Y) = nNa+ + nK+ + 2nBa2+ = x + y + 2z Khi cho dung dịch sau phản ứng tác dụng với axit thu được dung dịch pH = 13 > 7 => OH- dư nOH- dư = nOH-(Y) – nH+ = x + y + 2z – 0,1 Từ [OH-] => (3) Giải (1) (2) và (3) => t => mO => m hỗn hợp Lời giải chi tiết: Quy đổi hỗn hợp ban đầu thành: Na (x mol), K (y mol), Ba (z mol) và O (t mol) +) BT e: nNa + nK + 2nBa = 2nO + 2nH2 => x + y + 2z = 2t + 0,015.2 (1) +) \(\% {m_O} = {{16t} \over {23x + 39y + 137z + 16t}} = 0,1\) (2) +) BTĐT: nOH- (Y) = nNa+ + nK+ + 2nBa2+ = x + y + 2z Khi cho dung dịch sau phản ứng tác dụng với axit thu được dung dịch pH = 13 > 7 => OH- dư nOH- dư = nOH-(Y) – nH+ = x + y + 2z – 0,1 \( \to {\rm{[}}O{H^ - }{\rm{]}} = {{x + y + 2z - 0,1} \over {0,5}} = {10^{ - 1}}\) (3) Từ (3) => x + y + 2z = 0,15 thế vào (1) => t = 0,06 => mO = 0,06.16 = 0,96 gam => m hỗn hợp = mO.100/10 = 9,6 gam Đáp án A Câu hỏi 13 : Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 22,63 gam X vào nước, thu được 2,24 lít khí H2 (đktc) và dung dịch Y. Nếu cho Y tác dụng với CO2 thu được tối đa 25,61 gam kết tủa. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m gần với giá trị
Đáp án: A Phương pháp giải: Lời giải chi tiết: Tổng quát : X + O2 => Z (oxit) thì lượng ion kim loại trong X vẫn không đổi Bảo toàn e : nKL = 2nH2 = nO = 0,1 mol => mZ = 24,23g Z + H2O => dung dịch Y Có : nBaCO3 = nBa(OH)2 = 0,13 mol => nNa2O = 0,07 mol => nOH = 0,4 mol Khi phản ứng với 0,05 mol Al2(SO4)3 thì : nAl(OH)3 = 4nAl3+ - nOH- = 0 Kết tủa chỉ gồm : 0,13 mol BaSO4 => m = 30,29g Đáp án A Câu hỏi 14 : Hỗn hợp X gồm Ba, Na và Al, trong đó số mol của Al bằng 6 lần số mol của Ba. Cho m gam X vào nước dư đến phản ứng hoàn toàn, thu được 1,792 lít khí H2 (đktc) và 0,54 gam chất rắn. Giá trị của m là
Đáp án: C Phương pháp giải: Ba + 2H2O ® Ba(OH)2 + H2 Na + H2O → NaOH + ½ H2 Al + OH- + H2O → AlO2- + 3/2 H2 Sau phản ứng có Al dư Lập hệ phương trình dựa vào số mol H2 và khối lượng Al dư ta tìm được số mol mỗi kim loại trong hỗn hợp ban đầu. Từ đó tính được giá trị của m. Lời giải chi tiết: Đặt số mol Ba là x mol; số mol Al là 6x mol; số mol Na là y mol Ba + 2H2O ® Ba(OH)2 + H2 x x x mol Na + H2O → NaOH + ½ H2 y y y/2 mol Ta có: nOH- = 2x + y mol Al + OH- + H2O → AlO2- + 3/2 H2 2x+y 2x+y 1,5. (2x+y) mol Sau phản ứng có Al dư → nAl dư = 6x – (2x+y) = 4x – y = 0,54/27 = 0,02 mol Ta có: nH2 = x + y/2+ 1,5 (2x+y) = 4x+ 2y = 1,792/22,4 = 0,08 mol Giải hệ ta có: x = 0,01 mol và y = 0,02 mol → m = 137x + 27.6x + 23y = 3,45 gam Đáp án C Câu hỏi 15 : Cho m gam hỗn hợp X gồm Ba và Al (trong đó Al chiếm 37,156% về khối lượng) tác dụng với H2O dư thu được V lít khí H2 (ở đktc). Mặt khác, nếu cho m gam hỗn hợp X trên tác dụng với dung dịch NaOH dư thì thu được 12,32 lít H2 (ở đktc). Giá trị của m và V lần lượt là
Đáp án: A Phương pháp giải: Đặt nBa = x mol; nAl = y mol Ta có Al chiếm 37,156% khối lượng hỗn hợp X \( \to {{27y} \over {137x + 27y}}.100\% = 37,156\% \) (1) - Khi cho m gam X tác dụng với dung dịch NaOH dư: Ba + 2H2O → Ba(OH)2 + H2 Al + OH- + H2O → AlO2- + 3/2 H2 Từ số mol H2 và phương trình 1 ta tìm được số mol của Ba, Al. Từ đó tính được giá trị m. Từ số mol Ba, Al tính được số mol H2 sinh ra khi cho hỗn hợp tác dụng với nước dư. Từ đó tính được V. Lời giải chi tiết: Đặt nBa = x mol; nAl = y mol Ta có Al chiếm 37,156% khối lượng hỗn hợp X \( \to {{27y} \over {137x + 27y}}.100\% = 37,156\% \) (1) - Khi cho m gam X tác dụng với dung dịch NaOH dư: Ba + 2H2O ® Ba(OH)2 + H2 x → x mol Al + OH- + H2O → AlO2- + 3/2 H2 y → 1,5 y mol Ta có: nH2 = x + 1,5y = 12,32 : 22,4 = 0,55 mol (2) Giải hệ (1) và (2) ta có x = 0,1 mol và y = 0,3 mol → m = 137x + 27y = 21,8 gam - Khi cho m gam X tác dụng với nước dư: Ba + 2H2O → Ba(OH)2 + H2 0,1 → 0,1 0,1 mol Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2 0,1 → 0,2 0,3 mol Vậy VH2 = (0,1+ 0,3).22,4 = 8,96 lít Đáp án A Câu hỏi 16 : Hòa tan hết 4,35 gam hỗn hợp gồm Al và hai kim loại kiềm ở 2 chu kì liên tiếp vào nước dư thu được dung dịch X và 3,92 lít H2 (đktc). Cho từ từ dung dịch HCl vào dung dịch X đến khi khối lượng kết tủa lớn nhất thì thu được 3,9 gam kết tủa. Hai kim loại kiềm trong hỗn hợp ban đầu là
Đáp án: C Phương pháp giải: Khối lượng kết tủa lớn nhất thu được chính là khi khối lượng Al(OH)3 lớn nhất. → nAl = nAl(OH)3 max → m2 kim loại kiềm Gọi 2 kim loại kiềm là R R + H2O → ROH + ½ H2 Al + ROH + H2O → RAlO2+ 3/2 H2 Từ số mol H2 tính được số mol R, từ đó tính được khối lượng mol trung bình của 2 kim loại kiềm. Lời giải chi tiết: Khối lượng kết tủa lớn nhất thu được chính là khi khối lượng Al(OH)3 lớn nhất. Suy ra mAl(OH)3 max = 3,9 gam → nAl = nAl(OH)3 max = 3,9 : 78 = 0,05 mol → m2 kim loại kiềm = 4,35 - mAl = 3 gam Gọi 2 kim loại kiềm là R R + H2O → ROH + ½ H2 Al + ROH + H2O → RAlO2 + 3/2 H2 Đặt nR = x mol → nH2 = x/2 + 1,5.nAl = 3,92: 22,4 → x = 0,2 mol → MR = mR/x = 3 : 0,2 = 15 g/mol Vì hai kim loại kiềm ở 2 chu kì liên tiếp nên 2 kim loại đó là Li và Na. Đáp án C Câu hỏi 17 : Hòa tan hoàn toàn 1,94 gam hỗn hợp X chứa Na, K, Ca và Al trong nước dư thu được 1,12 lít khí (đktc) và dung dịch Y có chứa 2,92 gam chất tan. Phần trăm khối lượng của Al có trong X là?
Đáp án: B Phương pháp giải: Đặt số mol OH- do các kim loại Na, K, Ca tạo ra khi hòa tan vào nước là x (mol); số mol Al là y (mol) - Ta có: nH2 (do K, Na, Ca) = 0,5nOH- = 0,5x (mol) (HS viết PTHH sẽ thấy được tỉ lệ) nH2 (do Al) = 1,5nAl = 1,5y (mol) (HS tự viết PTHH để suy ra tỉ lệ) Từ nH2 => (1) - Mặt khác: nOH- pư = nAl = nAlO2- = y (mol) Vậy chất tan gồm: nOH- dư = x – y (mol) AlO2-: y (mol) Na+ K+ Ca2+ => m chất tan = mOH- dư + mNa, K, Ca + mO(trong AlO2-) => (2) Giải (1) và (2) được x; y => %mAl Lời giải chi tiết: Đặt số mol OH- do các kim loại Na, K, Ca tạo ra khi hòa tan vào nước là x (mol); số mol Al là y (mol) - Ta có: nH2 (do K, Na, Ca) = 0,5nOH- = 0,5x (mol) (HS viết PTHH sẽ thấy được tỉ lệ) nH2 (do Al) = 1,5nAl = 1,5y (mol) (HS tự viết PTHH để suy ra tỉ lệ) => nH2 = 0,5x + 1,5y = 0,05 (1) - Mặt khác: nOH- pư = nAl = nAlO2- = y (mol) Vậy chất tan gồm: nOH- dư = x – y (mol) AlO2-: y (mol) Na+ K+ Ca2+ => m chất tan = mOH- dư + mNa, K, Ca + mO(trong AlO2-) => 17(x-y) + 1,94 + 32y = 2,92 (2) Giải (1) và (2) được x = 0,04 mol và y = 0,02 mol => %mAl = (0,02.27/1,94).100% = 27,84% Đáp án B Câu hỏi 18 : Hòa tan hết m gam hỗn hợp X gồm Na2O, K, K2O, Ba, BaO (trong đó oxi chiếm 8% khối lượng hỗn hợp) vào nước dư thu được dung dịch Y và 1,792 lít H2 (đktc). Dung dịch Y hòa tan tối đa 6,48 gam Al. giá trị của m là
Đáp án: B Phương pháp giải: Từ dd Y phản ứng với Al suy ra được mol OH- có trong dd Y Ta có: nOH- = 2nO(oxit) + 2nH2 Lời giải chi tiết: nH2(đktc) = 1,792 :22,4 = 0,08 (mol) nAl = 6,48 : 27 = 0,24 (mol) Xét hỗn hợp X phản ứng với H2O có: O-2 + H2O → 2OH- a → 2a (mol) H2O +2e → 2OH- + H2↑ 0,16 ← 0,08 (mol) Xét dd Y phản ứng với Al 2Al + 2OH- + 2H2O → 2AlO2- + 3H2↑ 0,24 → 0,24 (mol) => nOH- = nAl = 0,24 (mol) Ta có: nOH- = 2nO(oxit) + 2nH2 => 0,24 = 2a + 0,16 => a = 0,04 (mol) = nO(oxit) => mO(oxit) = 0,04.16= 0,64 (g) Vì %O = 8%mX => mX = mO(oxit).100%:8% = 0,64.100%:8% = 8 (g) Đáp án B Câu hỏi 19 : Cho một mẫu hợp kim Na-Ba tác dụng với nước dư thu được dung dịch X và 3,36 lít khí (đktc). Cho dung dịch X tác dụng với 100 ml dung dịch hỗn hợp HCl 1M và AlCl3 0,6M. Khối lượng kết tủa thu được là
Đáp án: B Phương pháp giải: 2Na + 2H2O → 2NaOH + H2 Ba + 2H2O → Ba(OH)2 + H2 Dựa vào PTHH ta thấy: nOH- = 2nH2 = ? X{OH-} + {H+: 0,1 mol; Al3+: 0,06 mol} thì thứ tự các phản ứng xảy ra là: H+ + OH- → H2O Al3+ + 3OH- → Al(OH)3 Al(OH)3 + OH- → AlO2- + 2H2O Đặt số mol vào các PTHH suy ra số mol kết tủa thu được. Lời giải chi tiết: nH2 = 0,15 mol; nH+ = nHCl = 0,1 mol; nAl3+ = nAlCl3 = 0,06 mol 2Na + 2H2O → 2NaOH + H2 Ba + 2H2O → Ba(OH)2 + H2 Dựa vào PTHH ta thấy: nOH- = 2nH2 = 0,3 mol X{OH-: 0,3 mol} + {H+: 0,1 mol; Al3+: 0,06 mol} thì thứ tự các phản ứng xảy ra là: H+ + OH- → H2O 0,1 → 0,1dư 0,2 Al3+ + 3OH- → Al(OH)3 0,06 → 0,18 dư 0,02 → 0,06 Al(OH)3 + OH- → AlO2- + 2H2O 0,02 ← 0,02 => nAl(OH)3 thu được = 0,06 - 0,02 = 0,04 mol => m kết tủa = 0,04.78 = 3,12 gam Đáp án B Câu hỏi 20 : Hòa tan hoàn toàn m am hỗn hợp X gồm Na, Na2O, Ba và BaO (trong đó oxi chiếm 10,435% về khối lượng hỗn hợp) vào nước , thu được 500 ml dung dịch Y có pH = 13 và 0,224 lít khí đktc. Sục từ từ đến hết 1,008 lít khí đktc CO2 vào Y thu được khối lượng kết tủa là
Đáp án: A Phương pháp giải: Quy đổi X thành Na: x mol; Ba : y mol và O : z mol %OX → pt (1) X + NaOH : Na → Na+ + 1e Ba → Ba+2 + 2e O + 2e → O-2 2H+1 + 2e → H2 Bảo toàn e có pt (2) Vì pH + pOH = 14 → pOH = 1 → [OH-] → pt (3) Giải (1) (2) và (3) có x ; y và z → thành phần các ion trong Y Y + 0,045 mol CO2 : 2OH- + CO2 → CO32- + H2O OH- + CO2 → HCO3- Ba2+ + CO32- → BaCO3 Lời giải chi tiết: Quy đổi X thành Na: x mol; Ba : y mol và O : z mol %OX = \(\frac{{16z}}{{23x + 137y + 16z}}.100\% = 10,435\% \) (1) nH2 = 0,01 mol X + NaOH : Na → Na+ + 1e Ba → Ba+2 + 2e O + 2e → O-2 2H+1 + 2e → H2 Bảo toàn e có x + 2y = 2z + 0,01.2 (2) Vì pH + pOH = 14 → pOH = 1 → [OH-] = 10-1 = 0,1 = \(\frac{{x + 2y}}{{0,5}}\) → x + 2y = 0,05 (3) Giải (1) (2) và (3) có x = 0,03 mol; y = 0,01 mol và z = 0,015 mol → Y có Na+ : 0,03 mol; Ba+2 : 0,01 mol; OH- : 0,05 mol Y + 0,045 mol CO2 : vì \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = 1,11\) → phản ứng tạo ra cả HCO3- và CO32- 2OH- + CO2 → CO32- + H2O 2a a a OH- + CO2 → HCO3- b b Ta có nOH- = 2a + b = 0,05 mol và nCO2 = a + b = 0,045 mol nên a = 0,005 mol và b =0,04 mol Ba2+ + CO32- → BaCO3 → Phản ứng hết CO32- → nBaCO3 = 0,005 mol → mkết tủa = 0,985 gam Đáp án A Câu hỏi 21 : Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 và dung dịch Y có chứa 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 vào Y thu được m gam kết tủa. Biết thể tích các khí đo ở đktc. Giá trị gần nhất của m là
Đáp án: B Phương pháp giải: Quy đổi hỗn hợp thành: Na (x mol); Ba (0,12 mol) và O (y mol) + mX => (1) + BT electron: nNa + 2nBa = 2nO + 2nH2 => (2) Giải hệ (1) và (2) được x và y Xác định thành phần dung dịch Y. Áp dụng bảo toàn điện tích để tính số mol của OH- *Hấp thụ 0,3 mol CO2 vào dung dịch Y: Tính tỉ lệ nOH-/nCO2 => Xác định các muối tạo thành. Lời giải chi tiết: nBa(OH)2 = 20,52 : 171 = 0,12 mol; nH2 = 1,12 : 22,4 = 0,05 mol Quy đổi hỗn hợp thành: Na (x mol); Ba (0,12 mol) và O (y mol) + mX = 23x + 137.0,12 + 16y = 21,9 (1) + BT electron: nNa + 2nBa = 2nO + 2nH2 => x + 2.0,12 = 2y + 2.0,05 (2) Giải hệ (1) và (2) được x = y = 0,14 mol Dung dịch Y gồm: Na+ (0,14 mol); Ba2+ (0,12 mol) và OH- BTĐT => nOH- = nNa+ + 2nBa2+ = 0,14 + 2.0,12 = 0,38 mol *Hấp thụ 0,3 mol CO2 vào dung dịch Y: Tỉ lệ: 1 < nOH- : nCO2 = 0,38 : 0,3 = 1,27 < 2 => Tạo CO32- và HCO3- CO2 + 2OH- → CO32- + H2O a 2a a CO2 + OH- → HCO3- b b b + nCO2 = a + b = 0,3 + nOH- = 2a + b = 0,38 Giải hệ được a = 0,08 và b = 0,22 So sánh thấy: nBa2+ > nCO3 2- nên Ba2+ dư so với CO32- => nBaCO3 = nCO3 2- = 0,08 mol => m kết tủa = 0,08.197 = 15,76 gam gần nhất với 15,5 gam Đáp án B Câu hỏi 22 : Cho hỗn hợp gồm Na, K, Ba và Al vào lượng nước dư, thấy thoát ra V lít khí H2 (đktc); đồng thời thu được dung dịch X và rắn không tan Y. Sục khí CO2 dư vào X, thu được 12,48 gam kết tủa. Giá trị của V là
Đáp án: A Phương pháp giải: Cho hh kim loại kiềm, kiềm thổ , Al tan trong nước thì chất rắn không tan là Al dư. Đặt công thức chung của 3 kim loại Na, K, Ba là M, hóa trị chung là x, có số mol là a (mol) PTHH: 2M + xH2O → 2M(OH)x + xH2↑ (1) 2Al + 2M(OH)x + xH2O → 2M(AlO2)x + 3H2↑ (2) Vì Al dư sau phản ứng nên phản ứng (2) M(OH)x phản ứng hết. Vậy dd X thu được là M(AlO2)x: a(mol). Cho CO2 vào dd X thu được nAl(OH)3 = 12,48:78 = 0,16 (mol) xCO2 + 2xH2O + M(AlO2)x → xAl(OH)3↓ + M(HCO3)x (3) Tính toán theo PTHH (1), (2), (3) Lời giải chi tiết: Chất rắn không tan Y là Al dư Đặt công thức chung của 3 kim loại Na, K, Ba là M, hóa trị chung là x, có số mol là a (mol) PTHH: 2M + xH2O → 2M(OH)x + xH2↑ (1) a → a → 0,5ax (mol) 2Al + 2M(OH)x + xH2O → 2M(AlO2)x + 3H2↑ (2) a → a → 1,5ax (mol) Vì Al dư sau phản ứng nên phản ứng (2) M(OH)x phản ứng hết. Vậy dd X thu được là M(AlO2)x: a(mol). Cho CO2 vào dd X thu được nAl(OH)3 = 12,48:78 = 0,16 (mol) xCO2 + 2xH2O + M(AlO2)x → xAl(OH)3↓ + M(HCO3)x a → ax (mol) Ta có: nAl(OH)3 = ax = 0,16 (mol) Mà: ∑ nH2 = 0,5ax + 1,5ax = 2ax => nH2 = 2.0,16 = 0,32 (mol) → VH2(đktc) = 0,32.22,4 = 7,168 lít. Đáp án A Câu hỏi 23 : Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 8,75% về khối lương) vào nước thu được 400ml dung dịch Y và 1,568 lít H2(đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch có pH= 13. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án: C Phương pháp giải: nH+ = nHCl + 2nH2SO4 pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M OH- + H+ → H2O →[OH−] → y = ? *Hòa tan m gam hỗn hợp X {Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: } + H2: 0,07 BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => pt (1) BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => pt (2) Từ (1) và (2) => x => mO => mX Lời giải chi tiết: *Trộn 200 ml dung dịch Y (chứa y mol OH-) với 200 ml HCl 0,2M và H2SO4 0,15M nH+ = nHCl + 2nH2SO4 = 0,2.0,2 + 2.0,2.0,15 = 0,1 mol pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M OH- + H+ → H2O Bđ: y 0,1 Pư: 0,1 ← 0,1 Sau: y – 0,1 0 →[OH−] = y − 0,1.0,4=0,1→ y = 0,14 => 400 ml dung dịch Y chứa 0,28 mol OH- *Hòa tan m gam hỗn hợp X {Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: 0,28 mol} + H2: 0,07 BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => nNa + nK + 2nBa = 2x + 2.0,07 (1) BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => nNa + nK + 2nBa = 0,28 (2) Từ (1) và (2) => 2x + 2.0,07 = 0,28 => x = 0,07 mol => mO = 0,07.16 = 1,12 gam => mX = 1,12 : 8,75 .100 = 12,8 gam Đáp án C Câu hỏi 24 : Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, BaO và Ba (trong đó oxi chiếm 8,75% về khối lượng) vào nước thì thu được 400 ml dung dịch Y và 1,568 lít khí H2 (ở đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M thu được 400 ml dung dịch có pH = 13. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần giá trị nào nhất sau đây?
Đáp án: B Phương pháp giải: nH+ = nHCl + 2nH2SO4 pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M OH- + H+ → H2O →[OH−] → y = ? *Hòa tan m gam hỗn hợp X {Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: } + H2: 0,07 BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => pt (1) BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => pt (2) Từ (1) và (2) => x => mO => mX Lời giải chi tiết: *Trộn 200 ml dung dịch Y (chứa y mol OH-) với 200 ml HCl 0,2M và H2SO4 0,15M nH+ = nHCl + 2nH2SO4 = 0,2.0,2 + 2.0,2.0,15 = 0,1 mol pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M OH- + H+ → H2O Bđ: y 0,1 Pư: 0,1 ← 0,1 Sau: y – 0,1 0 →[OH−] = y − 0,1.0,4=0,1→ y = 0,14 => 400 ml dung dịch Y chứa 0,28 mol OH- *Hòa tan m gam hỗn hợp X {Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: 0,28 mol} + H2: 0,07 BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => nNa + nK + 2nBa = 2x + 2.0,07 (1) BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => nNa + nK + 2nBa = 0,28 (2) Từ (1) và (2) => 2x + 2.0,07 = 0,28 => x = 0,07 mol => mO = 0,07.16 = 1,12 gam => mX = 1,12 : 8,75 .100 = 12,8 gam gần nhất với 13 gam Đáp án B Câu hỏi 25 : Cho m gam hỗn hợp X gồm Al và Na tác dụng với H2O dư thu được 8,96 lít khí H2 (đktc) còn lại một lượng chất rắn không tan. Khối lượng của Na trong m gam X là:
Đáp án: D Phương pháp giải: Biện luận chất còn dư sau phản ứng sau đó tính theo PTHH. Lời giải chi tiết: Sau phản ứng còn chất rắn => Al còn dư, NaOH phản ứng hết Đặt nNa = x (mol) PTHH: Na + H2O → NaOH + 0,5H2 x → x → 0,5x (mol) NaOH + Al + H2O → NaAlO2 + 1,5H2 x → 1,5x (mol) nH2 = 0,5x + 1,5x = 8,96/22,4 => x = 0,2 mol => mNa = 0,2.23 = 4,6g Đáp án D Câu hỏi 26 : Hòa tan hết 9,334 gam hỗn hợp X gồm: Na, Ba, Ca và ZnO (trong đó oxi chiếm 5,14% về khối lượng) vào nước dư, thu được dung dịch Y và 0,064 mol H2. Cho 88 ml dung dịch HCl 2M vào dung dịch Y, sau phản ứng thu được m gam kết tủa. Giá trị của m là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Câu hỏi 27 : Cho hỗn hợp gồm 0,5 mol K; 0,2 mol Na; 1,2 mol Al vào 2 lít dung dịch Ba(OH)2 0,1M đến khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
Đáp án: D Phương pháp giải: Tính toán theo PTHH sau: 2K + 2H2O → 2KOH + H2 (1) 2Na + 2H2O → 2NaOH + H2 (2) Có: ∑ nOH- = nK + nNa + 2nBa(OH)2 = ?mol) Al + OH- + H2O → AlO2- + 1,5H2↑ (3) →∑ nH2(1+2+3) = ? (mol Lời giải chi tiết: nBa(OH)2 = 2.0,1 = 0,2 (mol) 2K + 2H2O → 2KOH + H2 (1) 0,5 → 0,5 → 0,25 (mol) 2Na + 2H2O → 2NaOH + H2 (2) 0,2 → 0,2 → 0,1 (mol) Có: ∑ nOH- = nK + nNa + 2nBa(OH)2 = 0,5 + 0,2 + 2.0,2 = 0,2 (mol) Al + OH- + H2O → AlO2- + 1,5H2↑ (3) 1,1dư 0,1 ←1,1 → 1,65 (mol) →∑ nH2(1+2+3) = 0,25 + 0,1 + 1,65 = 2 (mol) → VH2(đktc) = 2.22,4 = 44,8 (l) Đáp án D Câu hỏi 28 : Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào dung dịch X đến khi bắt đầu xuất hiện kết tủa thì hết 100 ml. Nếu thêm từ từ dung dịch HCl trên đến khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của m và a lần lượt là:
Đáp án: A Phương pháp giải: Bài toán cho từ từ H+ vào {OH-, AlO2-} Thứ tự phản ứng khi cho từ từ H+ vào OH-; AlO2- là: (1) H+ + OH- → H2O (2) H+ + AlO2- + H2O → Al(OH)3 (3) 3H+ + Al(OH)3 → Al3+ + 3H2O Như vậy, khi cho từ từ H+ vào OH-; AlO2- thì: - Đầu tiên, H+ trung hòa OH- nên chưa thấy xuất hiện kết tủa, khi đó chỉ xảy ra (1) → nH+ (1) = nOH- - Khi H+ bị trung hòa hết, kết tủa sẽ tăng từ từ cho đến khi cực đại khi đó xảy ra (2) → nH+ (2) = nAlO2- - Khi NaOH dư thì kết tủa sẽ bị tan dần cho đến hết khi đó xảy ra (3) → nH+(3) = 3nAl(OH)3 bị tan = 3.(nAlO2- - nAl(OH)3) Vậy ta có công thức tính nhanh trường hợp kết tủa tan: ∑nH+ = nOH- + nAlO2- + 3.(nAlO2- - nAl(OH)3) = nOH- + 4nAlO2- - 3nAl(OH)3 Lời giải chi tiết: Đặt số mol của Na2O và Al2O3 lần lượt là x, y. - Thêm từ từ dung dịch HCl 1M vào dung dịch X đến khi bắt đầu xuất hiện kết tủa có phản ứng: H+ + OH- → H2O 0,1 → 0,1 (mol) \( \to {n_{O{H^ - }}} = 0,1(mol)\) Bảo toàn nguyên tố Na, Al suy ra dung dịch X chứa: Na+ (2x mol); AlO2- (2y mol) và OH- (0,1 mol) - Nếu thêm từ từ dung dịch HCl trên đến khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa: + Khi nHCl = 0,3 mol thì AlO2- dư, kết tủa chưa bị tan. Các phản ứng xảy ra: H+ + OH- → H2O H+ + AlO2- + H2O → Al(OH)3 ↓ \( \to {n_{{H^ + }}} = {n_{O{H^ - }}} + {n_{Al{{(OH)}_3}}} \to 0,3 = 0,1 + {n_{Al{{(OH)}_3}}} \to {n_{Al{{(OH)}_3}}} = 0,2(mol)\) → a = 0,2.78 = 15,6 gam + Khi nHCl = 0,7 mol thì Al(OH)3 bị hòa tan một phần. Các phản ứng xảy ra: H+ + OH- → H2O H+ + AlO2- + H2O → Al(OH)3 ↓ 3H+ + Al(OH)3 → Al3+ + 3H2O Công thức tính nhanh (chứng minh ở phần phương pháp): \({n_{{H^ + }}} = {n_{O{H^ - }}} + 4{n_{Al{O_2}^ - }} - 3{n_{Al{{(OH)}_3}}} \to 0,7 = 0,1 + 4.2y - 3.0,2 \to y = 0,15\) Bảo toàn điện tích dung dịch X → \({n_{N{a^ + }}} = {n_{Al{O_2}^ - }} + {n_{O{H^ - }}} \to 2{\rm{x}} = 2.0,15 + 0,1 \to x = 0,2\) Vậy \(m = {m_{N{a_2}O}} + {m_{A{l_2}{O_3}}} = 0,2.62 + 0,15.102 = 27,7(g)\) Đáp án A Câu hỏi 29 : Hỗn hợp A gồm x mol Al và y mol Na. Hỗn hợp B gồm y mol Al và x mol Na. Dung dịch C chứa HCl 1M. Thực hiện 2 thí nghiệm sau: - Thí nghiệm 1: Hòa tan hỗn hợp A vào nước dư thu được 13,44 lít khí H2 đo ở đktc và dung dịch X. Cho từ từ dung dịch C vào dung dịch X thấy xuất hiện ngay kết tủa. - Thí nghiệm 2: Hòa tan hỗn hợp B vào nước dư thu được V lít khí H2 đo ở đktc và dung dịch Y. Cho từ từ dung dịch C vào dung dịch Y thấy hết 50 ml thì bắt đầu xuất hiện kết tủa. Tính V?
Đáp án: B Phương pháp giải: Hòa tan hh A, B vào H2O dư có pư PTHH: 2Na + 2H2O → 2NaOH + H2↑ (1) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (2) TN1: Nhỏ từ từ HCl vào dd X thấy thu được ngay kết tủa → dd X chỉ chứa NaAlO2. TN2: Nhỏ từ từ HCl thấy hết 0,05 mol mới thu được kết tủa → dd Y chứa NaAlO2 và NaOH dư. HCl phải trung hòa NaOH dư trước rồi mới phản ứng với NaAlO2 Lời giải chi tiết: TN1: nH2(đktc) = 13,44 :22,4 = 0,6 (mol) Hòa tan hh A vào H2O dư có pư PTHH: 2Na + 2H2O → 2NaOH + H2↑ (1) (mol) y → y → 0,5y 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (2) (mol) y → 1,5y Hòa tan A vào H2O dư, sau đỏ nhỏ từ từ HCl thấy thu được ngay kết tủa → dd X chỉ chứa NaAlO2. Do vậy Na, NaOH pư hết. ∑nH2 = nH2(1) + nH2(2) = \(\frac{1}{2}{n_{Na}} + \frac{3}{2}{n_{NaOH}} = 0,5y + 1,5y = 2y(mol)\) → 2y = 0,6 → y = 0,3 (mol) TN2: Hòa tan hh B vào H2O dư có pư PTHH: 2Na + 2H2O → 2NaOH + H2↑ (1) (mol) x → x → 0,5x 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (2) (mol) 0,3 → 0,3 → 0,45 Hòa tan A vào H2O dư, sau đỏ nhỏ từ từ HCl thấy hết 0,05 mol mới thu được kết tủa → dd Y chứa NaAlO2 và NaOH dư. HCl phải trung hòa NaOH dư trước rồi mới phản ứng với NaAlO2 Do vậy pư (2) Al pư hết, nNaOH pư = nAl = 0,3 (mol) → nNaOH dư = nNaOH (1) – nNaOH(2) = x – 0,3 (mol) Mặt khác: nNaOH dư = nHCl = 0,05 (mol) → x – 0,3 = 0,05 → x = 0,35 (mol) →∑nH2 = 0,5x + 0,45 = 0,5.0,35 + 0,45 = 0,625 (mol) → V = 0,625.22,4 = 14 (lít) Đáp án B Câu hỏi 30 : (mới cập nhật) Hỗn hợp X gồm: Na, K và Ba. Hòa tan hoàn toàn m gam X vào nước dư thu được 4,48 lít H2 (đktc) và dung dịch A. Để trung hòa một nửa dung dịch A cần vừa đủ V ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,25M. Giá trị của V là
Đáp án: B Phương pháp giải: Lời giải chi tiết:
|