10 bài tập vận dụng về H2SO4 đặc, HNO3 có lời giảiLàm bàiCâu hỏi 1 : 1. Hòa tan 3,38 gam oleum A vào lượng nước dư ta được dung dịch A. Để trung hòa 1/20 lượng dung dịch A cần dùng 40 ml dung dịch NaOH 0,1M. Tìm công thức của oleum. 2. Dẫn luồng hí CO dư đi qua 37,68 gam hỗn hợp X chứa CuO, Fe2O3, MgO, PbO, Fe3O4 nung nóng, đến khi các phản ứng xảy ra hoàn toàn thì thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Sục hỗn hợp khí Z vào dung dịch Ca(OH)2 dư, thu được 34,0 gam kết tủa trắng. a. Viết phương trình hóa học của các phản ứng xảy ra. b. Xác định khối lượng của hỗn hợp chất rắn Y. Phương pháp giải: 1. Viết phương trình, tính toán theo PT 2. Bảo toàn khối lượng Lời giải chi tiết: 1. CTPT oleum: H2SO4.nSO3 có x (mol) H2SO4.nSO3 + nH2O → (n + 1)H2SO4 x → x(n + 1) H2SO4 + 2NaOH → Na2SO4 + 2H2O x(n + 1)→ 2x(n + 1) => (98 + 80n)x = 3,38 và 2x (n + 1) = 0,08 => x = 0,01 và nx = 0,03 => n = 3 Suy ra CTPT oleum: H2SO4.3SO3. 2. CO2 + Ca(OH)2 → CaCO3↓ + H2O 0,34 ←0,34 CO + O(Oxit) → CO2 Nhận thấy: nO = nCO2 mX = mO (oxit) + mY => mY = 37,68 – 16 . 0,34 = 32,24g Câu hỏi 2 : 1. Cho hỗn hợp X (gồm Fe và FeCO3) tác dụng với H2SO4 đặc, nóng dư thu được hỗn hợp khí gồm CO2 và SO2 với tỉ lệ số mol lần lượt là 2017 : 2018. Viết phương trình hóa học xảy ra và tính thành phần % về khối lượng các chất trong hỗn hợp X. 2. Chia m gam kim loại M (có hóa trị không đổi) làm hai phần bằng nhau: Phần 1: Cho tác dụng hoàn toàn với O2 dư thu được 15,3 gam oxit. Phần 2: Cho tác dụng hoàn toàn với Cl2 dư thu được 40,05 gam muối. Viết phương trình hóa học và xác định kim loại M. Phương pháp giải: Lời giải chi tiết: Giả sử X có 1 mol Fe và x mol FeCO3 Ta có \(\eqalign{ 2. \(\eqalign{ Câu hỏi 3 : Hòa tan hết 17,4 gam hỗn hợp X gồm FeO, Fe(NO3)2 và Mg vào dung dịch chứa 0,39 mol H2SO4 loãng. Sau phản ứng thu dược dung dịch Y chỉ chứa 50,24 gam muối sunfat và 0,07 mol hỗn hợp khí Z gồm 2 khí không màu, trong đó có một khí màu nâu ngoài không khí có tỉ khối hơi so với H2 bằng 5. Tính phần trăm khối lượng của Mg trong hỗn hợp X. Phương pháp giải: Lời giải chi tiết:
Vì Mg có tính khử rất mạnh nên trong Y có thể có muối (NH4)2SO4 BTNT N: 2nFe(NO3)2 = nNO + nNH4 => 2y = 0,02 + nNH4 => nNH4 = 2y – 0,02 BTNT H: 2nH2SO4 = 2nH2 + 4nNH4 + 2nH2O => 2 . 0,39 = 2 . 0,05 + 4 (2y – 0,02) + 2nH2O => nH2O = 0,38 – 4y BTNT O: nFeO + 6nFe(NO3)2 = nNO + nH2O => x + 6y = 0,02 + 0,38 – 4y => x + 10y = 0,4 \(\eqalign{ Câu hỏi 4 : Hòa tan hết 29,6 gam hỗn hợp X gồm Fe, Mg, Cu theo tỉ lệ mol 1:2:3 bằng H2SO4 đặc nguội được dung dịch Y và 3,36 lít SO2 (đktc). Cô cạn dung dịch Y được khối lượng muối khan là:
Đáp án: A Phương pháp giải: nSO2= V/22,4= 0,15 mol Gọi x là số mol Fe trong hỗn hợp X, => nMg = 2x, nCu=3x. => 56x+24.2x+64.3x=29,6 => x= 0,1 mol. => nFe = 0,1 mol, nMg=0,2 mol, nCu=0,3 mol H2SO4 đặc nguội nên Fe không phản ứng. S+6+2e →S+4 0,3 0,15 => \({n_{S{O_4}^{2 - }}} = \frac{1}{2}\sum {{n_e}} \) (trao đổi)= 0,3/2=0,15 mol => mmuối=mCu +mMg + mSO42- Lời giải chi tiết: nSO2= V/22,4= 0,15 mol Gọi x là số mol Fe trong hỗn hợp X, Þ nMg = 2x, nCu=3x. => 56x+24.2x+64.3x=29,6 Þ x= 0,1 mol. => nFe = 0,1 mol, nMg=0,2 mol, nCu=0,3 mol H2SO4 đặc nguội nên Fe không phản ứng. S+6+2e →S+4 0,3 0,15 => \({n_{S{O_4}^{2 - }}} = \frac{1}{2}\sum {{n_e}} \)(trao đổi)= 0,3/2=0,15 mol => mmuối=mCu +mMg + mSO42- =64.0,3+24.0,2 +96.0,15= 38,4 gam. Đáp án A Câu hỏi 5 : Cho 3 kim loại Al, Fe, Cu vào 2 lít dung dịch HNO3 phản ứng vừa đủ thu được 1,792 lít khí X (đktc) gồm N2 và NO2 có tỉ khối hơi so với He bằng 9,25. Nồng độ mol/lít HNO3 trong dung dịch đầu là:
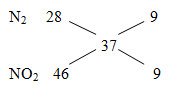
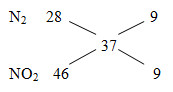
Đáp án: A Phương pháp giải: nX = V/22,4 = 0,08 mol MX= 9,25.4 = 37
=> \({n_{{N_2}}} = {n_{N{O_2}}} = \frac{{{n_X}}}{2} = 0,04\,\,mol\) nHNO3 = 12nNO + 2nNO2 = 12.0,04+2.0,04= 0,56 mol => CM (HNO3) Lời giải chi tiết: nX = V/22,4=0,08 mol MX= 9,25.4=37
=> \({n_{{N_2}}} = {n_{N{O_2}}} = \frac{{{n_X}}}{2} = 0,04\,\,mol\) nHNO3 = 12nNO + 2nNO2 = 12.0,04+2.0,04= 0,56 mol => CM (HNO3) = 0,56/2=0,28M Đáp án A Câu hỏi 6 : Đốt cháy 5,6 gam bột Fe trong bình đựng O2 thu được 7,36 gam hỗn hợp A gồm Fe2O3, Fe3O4 và Fe.Hòa tan hoàn toàn lượng hỗn hợp A bằng dung dịch HNO3 thu được V lít hỗn hợp khí B gồm NO và NO2. Tỉ khối của B so với H2 bằng 19. Thể tích V ở đktc là:
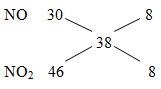
Đáp án: D Phương pháp giải: MX= 19.2=38
=> \({n_{{N_2}}} = {n_{N{O_2}}} = x\) mFe + mO = moxit => mO = moxit- mFe = 7,36-5,6=1,76 gam => nO = 0,11 mol Fe0 →Fe3+ + 3e 0,1 0,3 O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4 0,11 0,22 3x x x x Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x Lời giải chi tiết: MX= 19.2=38
=> \({n_{{N_2}}} = {n_{N{O_2}}} = x\) mFe + mO = moxit => mO = moxit- mFe = 7,36-5,6=1,76 gam => nO = 0,11 mol Fe0 →Fe3+ + 3e 0,1 0,3 O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4 0,11 0,22 3x x x x Bảo toàn e: 0,3 = 0,22+3x+x =0,22+4x =>x= 0,02 => nkhí = 2x=0,04 mol => Vkhí = 0,04.22,4=0,896 lít=896 ml Đáp án D Câu hỏi 7 : Nung m gam sắt trong không khí , sau một thời gian người ta thu được 104,8 gam hỗn hợp rắn A gồm Fe, FeO, Fe2O3, Fe3O4. Hòa tan hoàn toàn A trong HNO3 dư thu được dung dịch B và 12,096 lít khí hỗn hợp khí NO và NO2 (đktc) có tỉ khối so với He là 10,167. Giá trị của m là:
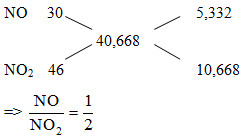
Đáp án: D Phương pháp giải: nkhí = V/22,4=0,54 mol MX= 10,167.4=40,668
=> nNO= 0,54/3=0,18 mol nNO2 = 0,54-0,18=0,36 mol Fe0 →Fe3+ + 3e x 3x O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4 y 2y 0,54 0,18 0,36 0,36 Bảo toàn e => 3x= 2y+0,54+0,36 => 3x-2y= 0,9 (1) mA =mFe + mO = 56x+16y= 104,8 (2) (1)(2) => x,y Lời giải chi tiết: nkhí = V/22,4=0,54 mol MX= 10,167.4=40,668
=> nNO= 0,54/3=0,18 mol nNO2 = 0,54-0,18=0,36 mol Fe0 →Fe3+ + 3e x 3x O0 +2e →O2- N+5 + 3e → N+2 N+5 +1e → N+4 y 2y 0,54 0,18 0,36 0,36 Bảo toàn e => 3x= 2y+0,54+0,36 => 3x-2y= 0,9 (1) mA =mFe + mO = 56x+16y= 104,8 (2) (1)(2) => x=1,4. y= 1,65 => mFe = 1,4.56= 78,4 gam Đáp án D Câu hỏi 8 : ): (a) Cho dòng khí oxi đi qua ống đựng 18,2 gam bột kim loại R đốt nóng, thu được 23,4 gam hỗn hợp A gồm R, RO và R2O3. Hòa tan hoàn toàn hỗn hợp A bằng một lượng vừa đủ dung dịch H2SO4 đặc, đun nóng thu được dung dịch B và 4,48 lít khí SO2(đktc). Cô đặc dung dịch B, rồi làm lạnh, thu được 112,77 gam muối D kết tinh với hiệu suất 90%. Xác định kim loại R và công thức muối D. (b) Đốt cháy hoàn toàn 1,48 gam hợp chất hữu cơ A1 có khối lượng mol là 74 gam/mol, cần vừa đủ 448 ml khí O2 (đktc), sản phẩm chỉ gồm CO2 và H2O. Xác định công thức phân tử của A1. Dùng công thức cấu tạo hai chất ứng với công thức phân tử của A1 để viết phương trình phản ứng với dung dịch NaOH. Phương pháp giải: (a) Quy đổi hỗn hợp A thành R, O (đều số mức oxi hóa là 0) sau đó sử dụng bảo toàn nguyên tố, bảo toàn e (b) Giả sử A1 có công thức là CxHyOz => MA1 = 12x + y + 16z = 74 (1) BTKL cho phản ứng đốt A1: mCO2 + mH2O = mA1 + mO2 => mối quan hệ x, y (2) Biện luận z,x,y để tìm ra được CTPT A1, từ đó viết được CTCT Lời giải chi tiết: (a) O2+ R \(\buildrel {{t^o}} \over\longrightarrow \) A {R, RO, R2O3} BTKL: mO2 = mA - mR = 23,4 - 18,2 = 5,2 gam => nO2 = 5,2 : 32 = 0,1625 mol Quy đổi hỗn hợp A thành R, O (đều số mức oxi hóa là 0) BTNT "O": nO(A) = 2nO2 = 0,325 mol Ta có: nR = 18.2/R (mol) Xét các quá trình cho và nhận electron: QT cho electron QT nhận electron R0 → R+3 + 3e O0 + 2e → O-2 S+6 + 2e → S+4 (SO2) 3nR = 2nO + 2nSO2 hay \(3.{{18,2} \over R} = 2.0,325 + 2.0,2\) => R = 52Áp dụng định luật bảo toàn electron ta có: Vậy R là Cr - Khi cô đặc dung dịch B và làm lạnh thì ta thu được muối D kết tinh. Giả sử công thức của muối D là: Cr2(SO4)3.nH2O BTNT "Cr": nCr2(SO4)3.nH2O = 0,5nCr = 0,5.18,2/52 = 0,175 mol Do hiệu suất quá trình cô đặc và kết tinh chỉ đạt 90% nên số mol Cr2(SO4)3.nH2O bị kết tinh thực thế là: nCr2(SO4)3.nH2O = 0,175.90% = 0,1575 mol => MCr2(SO4)3.nH2O = 112,77/0,1575 = 716 gam => 392 + 18n = 716 => n = 18 Vậy công thức muối D là Cr2(SO4)3.18H2O (b) *Tìm CTPT của A1: nA1 = 1,48/74 = 0,02 mol; nO2 = 0,448/2,4 = 0,02 mol Giả sử A1 có công thức là CxHyOz => MA1 = 12x + y + 16z = 74 (1) BTNT "C": nCO2 = 0,02x (mol) BTNT "H": nH2O = 0,01y (mol) BTKL cho phản ứng đốt A1: mCO2 + mH2O = mA1 + mO2 => 44.0,02x + 18.0,01y = 1,48 + 0,03.32 hay 0,88x + 0,18y = 2,12 (2) Ta thấy từ (1) suy ra 16z < 74 => z < 4,625 + Nếu z = 0 ta có hệ phương trình:\(\left\{ \matrix{12x + y = 74 \hfill \cr 0,88x + 0,18y = 2,12 \hfill \cr} \right. \to \left\{ \matrix{x = {{35} \over 4} \hfill \cr y = - 31 \hfill \cr} \right.\)(loại) + Nếu z = 1 ta có hệ phương trình: \(\left\{ \matrix{12x + y = 58 \hfill \cr 0,88x + 0,18y = 2,12 \hfill \cr} \right. \to \left\{ \matrix{x = {{13} \over 2} \hfill \cr y = - 20 \hfill \cr} \right.\) (loại) + Nếu z = 2 ta có hệ phương trình \(\left\{ \matrix{12x + y = 42 \hfill \cr 0,88x + 0,18y = 2,12 \hfill \cr} \right. \to \left\{ \matrix{x = {{17} \over 4} \hfill \cr y = - 9 \hfill \cr} \right.\) (loại) + Nếu z = 3 ta có hệ phương trình \(\left\{ \matrix{12x + y = 26 \hfill \cr 0,88x + 0,18y = 2,12 \hfill \cr} \right. \to \left\{ \matrix{x = 2 \hfill \cr y = 2 \hfill \cr} \right.\) (loại) + Nếu z = 4 ta có hệ phương trình \(\left\{ \matrix{12x + y = 10 \hfill \cr 0,88x + 0,18y = 2,12 \hfill \cr} \right. \to \left\{ \matrix{x = - {1 \over 4} \hfill \cr y = 13 \hfill \cr} \right.\) (loại) Vậy CTPT của A1 là C2H2O3 *2 chất có cấu tạo ứng với CTPT C2H2O3 là: OHC-COOH và (HCO)2O (anhidrit của axit HCOOH) PTHH: OHC-COOH + NaOH → OHC-COONa + H2O (HCO)2O + 2NaOH →2HCOONa + H2O Câu hỏi 9 : Hỗn hợp X gồm các oxit: BaO, CuO, Fe2O3, Al2O3 có cùng số mol. Dẫn một luồng khí CO dư đi qua hỗn hợp X nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí A và hỗn hợp rắn B. Cho B vào nước dư thu được dung dịch C và hỗn hợp rắn D. Cho D tác dụ ng với H2SO4 đặc nóng dư, thu được dung dịch E và khí SO2 duy nhất. Sục khí A vào dung dịch C được dung dịch G và kết tủa H. Xác định thành phần của A, B, C, D, E, G, H và viết các phương trình hóa học xảy ra. Phương pháp giải: Lời giải chi tiết: \(\left\{ \matrix{ BaO:1 \hfill \cr CuO:1 \hfill \cr F{e_2}{O_3}:1 \hfill \cr A{l_2}{O_3}:1 \hfill \cr} \right.\buildrel { + CO\,du} \over \longrightarrow \left\{ \matrix{ \uparrow A\left\{ \matrix{ CO\,du \hfill \cr C{O_2}:4 \hfill \cr} \right.\buildrel { + Ba(AlO2)2} \over \longrightarrow \left\{ \matrix{ \downarrow H:\,Al{(OH)_{3\,}}:2 \hfill \cr {\rm{dd}}\,G:\,Ba{(HC{O_3})_2}:1 \hfill \cr} \right. \hfill \cr ran\,B\left\{ \matrix{ BaO:1 \hfill \cr Cu:1 \hfill \cr Fe:2 \hfill \cr A{l_2}{O_3}:1 \hfill \cr} \right.\buildrel { + H2O\,du} \over \longrightarrow \left\{ \matrix{ {\rm{dd}}\,C:\,Ba{(Al{O_2})_2}:\,1 \hfill \cr ran\,D\left\{ \matrix{ Cu:1 \hfill \cr Fe:2 \hfill \cr} \right.\buildrel {{H_2}S{O_4},\,dac,\,{t^o}\,,du} \over \longrightarrow \uparrow S{O_2} \hfill \cr} \right. \hfill \cr} \right.\) \(\eqalign{ & CuO{\rm{ }} + {\rm{ }}CO\buildrel {{t^o}} \over \longrightarrow Cu{\rm{ }} + {\rm{ }}H2O \uparrow \cr & F{e_2}{O_3} + {\rm{ }}3CO\buildrel {{t^o}} \over \longrightarrow 2Fe{\rm{ }} + {\rm{ }}3C{O_2} \uparrow \cr & 2C{O_2} + {\rm{ }}Ba{(Al{O_2})_2} + {\rm{ }}4{H_2}O{\rm{ }} \to {\rm{ }}Ba{(HC{O_3})_2} + {\rm{ }}2Al{\left( {OH} \right)_3} \downarrow \cr & BaO{\rm{ }} + {\rm{ }}{H_2}O{\rm{ }} \to {\rm{ }}Ba{\left( {OH} \right)_2} \cr & Ba{\left( {OH} \right)_2} + {\rm{ }}A{l_2}{O_3} \to {\rm{ }}Ba{(Al{O_2})_2} + {\rm{ }}{H_2}O \cr & Cu{\rm{ }} + {\rm{ }}2{H_2}S{O_4} \to {\rm{ }}CuS{O_4} + {\rm{ }}S{O_2} \uparrow {\rm{ }} + {\rm{ }}2{H_2}O \cr & 2Fe{\rm{ }} + {\rm{ }}6{H_2}S{O_4} \to {\rm{ }}F{e_2}{(S{O_4})_3} + {\rm{ }}3S{O_2} \uparrow {\rm{ }} + {\rm{ }}6{H_2}O \cr} \) Câu hỏi 10 : (2 điểm) 1. Khi điều chế axit sunfuric người ta hấp thụ khí SO3 bằng dung dịch H2SO4 được oleum có công thức tổng quát là H2SO4.nSO3. Tính lượng khí SO3 hấp thụ vào 200 gam dung dịch H2SO4 96,4% thu được một loại oleum có phần trăm theo khối lượng của SO3 là 40,82%. 2. X là quặng hematit chứa 64,0% Fe2O3 và Y là quặng mahetit chứa 92,8% Fe3O4 theo khối lượng ( còn lại là tạp chất không chứa nguyên tố Fe). Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ Z luyện gang, rồi luyện thép thì thu được 420,42 kg thép chứa 0,1% gồm cacbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình là 75%. Tính m1 và m2. Phương pháp giải: Lời giải chi tiết:
|