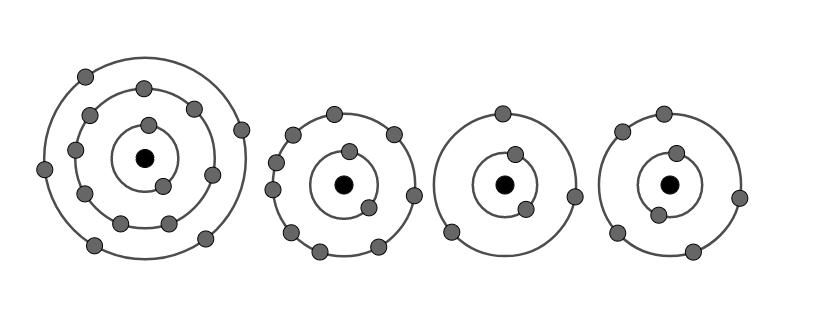
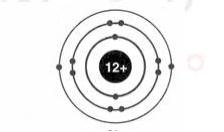
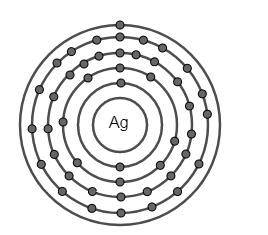
Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Đề số 1 - Hóa học 10Đáp án và lời giải chi tiết Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Đề số 1 - Hóa học 10 Đề bài Câu 1. Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là A.2, 8, 18, 32. B.2, 6, 10, 14. C.2, 6, 8, 18. D.2, 4, 6, 8. Câu 2. Cấu hình electron nào sau đây là của kim loại? A.1s22s22p63s23p3. B. 1s22s22p63s23p1. C. 1s22s22p63s23p5. D. 1s22s22p63s23p4. Câu 3. Nguyên tố hoá học là A.những nguyên tử có cùng điện tích hạt nhân. B.những nguyên tử có cùng số khối. C.những nguyên tử có cùng số nơtron. D.những phân tử có cùng phân tử khối. Câu 4. Oxi có 3 đồng vị \({}_8^{16}O,{}_8^{17}O,{}_8^{18}O\) và cacbon có 2 đồng vị \({}_6^{12}C,{}_6^{13}C\). Số công thức phân tử cacbon đioxit ( CO2) được tạo nên từ các đồng vị trên là A.12. B.13. C.14. D.15. Câu 5. Cho biết các electron trong nguyên tử của một số nguyên tố được xếp như hình vẽ dưới đây, hãy chỉ ra đâu là nguyên tố phi kim? A.3 và 4. B.2 và 3. C.2. D.1 và 4. Câu 6. Cacbon trong thiên nhiên gồm chủ yếu một hỗn hợp của hai đồng vị bền: 12C với tỉ lệ 98,89% vả 13C với tỉ lệ 1,11%. Ngoài ra trong cacbon còn có những vết của đồng vị phóng xạ 14C . Đồng vị 14C có trong khí quyển ở dạng khí CO2 với nồng độ không đổi. Nhờ có chu kì bán hủy khá lớn, 5570 năm nên 14C ở trong khí CO2 của khí quyển được phát hiện trong mọi chất có chứa cacbon nằm cân bằng với khí CO2 của khí quyển. Khi sinh vật chết, nó không đồng hoá những lượng mới 14C và lượng 14C giảm xuống do sự phá hủy phóng xạ. Như vậy biết nồng độ của 14C và biết hằng số nồng độ 14C ở trong khí quyển, người ta có thể xác định được thời điểm mà sinh vật đã chết. Đây là phương pháp cho phép xác định tuổi của sinh vật với sai số 5%. Nhận xét nào dưới đây là đúng khi nói về đồng vị? A.Các đồng vị có cùng số proton. B.Các đồng vị xuất phát từ các nguyên tố khác nhau. C.Tất cả các đồng đều được tìm thấy trong tự nhiên. D.Các đồng vị được xếp vào một ô trong bảng tuần hoàn. Câu 7. Nguyên tử R có tổng số hạt là 48. Trong đó số hạt mang điện gấp số hạt không mang điện. Kí hiệu nguyên tử R là A.\({}_8^{40}R\) B.\({}_{16}^{32}R\) C.\({}_{16}^{32}R\) D.\({}_{16}^{16}R\) Câu 8. Cấu hình electron chưa đúng là A. Na+ (Z=11): 1s22s22p63s2. B. Na(Z=11): 1s22s22p63s1. C. F (Z=9): 1s22s22p5. D. F- (Z=9): 1s22s22p6. Câu 9. Cho các phát biểu sau: 1.Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân. 2.Đồng vị là các nguyên tử có cùng số proton và số nơtron. 3.Trong một nguyên tử, số proton luôn bằng số electron và bằng số đơn vị điện tích hạt nhân. 4. Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết nguyên tử khối của nguyên tử. 5. Đồng vị \({}_4^1H\) là trường hợp duy nhất mà nguyên tử không chứa nơtron. 6. Nguyên tố s là những nguyên tố mà nguyên tử của chúng có 1 hoặc 2 electron ở lớp ngoài cùng. Số phát biểu đúng là A.6. B.5. C.4. D.3. Câu 10. Đồng có hai đồng vị 63Cu và 65Cu. Khối lượng nguyên tử trung bình của đồng là 63,54. Thành phần phần trăm của đồng vị 65Cu là A.20% B.70% C.73% D.27%. Câu 11. Dựa vào thứ tự mức năng lượng sự sắp xếp các phân lớp nào dưới đây là không đúng? A.1s < 2s. B.4s > 3s. C.3d < 4s. D.3p < 3d. Câu 12. Phát biểu nào sau đây là sai? A.Nguyên tử được cấu tạo bởi 2 loại hạt là proton và nơtron. B.Trong nguyên tử, số proton và số electron bằng nhau. C.Đồng vị là tập hợp các nguyên tố có cùng số proton nhưng khác nhau số nơtron. D.Trong nguyên tử, số proton luôn bằng số hiệu nguyên tử Z. Câu 13. Cấu hình electron của nguyên tố S (Z=16) là A.1s22s22p63s23p2. B. 1s22s22p63s23p4. C. 1s22s22p63s23p6. D. 1s22s22p63s23p5. Câu 14. Nguyên tố magie có 3 đồng vị khác nhau ứng với số và thành phần % tương ứng như sau: 24Mg (78,99%), 25Mg (10%) và 26Mg (11,01%). Nguyên tử khối trung bình của Mg là A.24,9. B.25. C.25,5. D.24,3202. Câu 15. Clo là chất khí màu lục nhạt, mùi hắc và rất độc. Clo phá hủy niêm mạc đường hô hấp. Trong thời kỳ chiến tranh thế giới lần thứ nhất quân đội phát xít Đức đã dùng clo để làm chất độc. Sự kiện này xảy ra hồi 5 giờ chiều ngày 22 tháng 4 năm 1915 tại thành phố Yprơ, nơi quân Anh, Pháp đóng. Số người bị nạn lên đến quá 15000 người. Đêm 17 và 18 tháng 3 năm 1916 quân Đức đã dùng clo để tàn sát quân đội Nga đóng ở thành phố Bolomốp và giết hại gần 3000 người thuộc trung đoàn Xibêri đóng tại đó, trong số đó có nửa bị chết trong đêm đầu. Trong tự nhiên, clo có hai đồng vị bền \({}_{17}^{37}Cl\) và \({}_{17}^{35}Cl\), trong đó có đồng vị \({}_{17}^{37}Cl\) chiếm 24,23% số nguyên tử. Cho \({\overline M _{Cl}} = 35,5\). Thành phần phần trăm về khối lượng \({}_{17}^{37}Cl\) có trong HClO4 là A.6,78%. B.1,92%. C.8,92%. D.2,98%. Câu 16. Số phân lớp e của lớp M (n=3) là A.1. B.2. C.3. D.4 Câu 17. Cấu hình electron của nguyên tử 39X là 1s22s22p63s23p64s1. Nguyên tử X có đặc điểm (a)nguyên tố thuộc chu kì 4, nhóm IA. (b)số đơn vị điện tích hạt nhân trong hạt nhân nguyên tử X là 20. (c)X là nguyên tố kim loại mạnh. (d)X có thể tạo thành ion X+ có cấu hình là 1s22s22p63s23p6. Số phát biểu đúng là A.1. B.4. C.3. D.2. Câu 18. Trong nguyên tử có các hạt mang điện là A.proton C.nơtron C.electron D.proton và electron. Câu 19. Số electron tối đa trong lớp thứ 3 là A.18e B.9e C.32e D.8e. Câu 20. Cho sơ đồ biểu diễn electron của nguyên tử Mg. Lớp electron ngoài cùng của nguyên tử Mg là A.lớp K B.lớp L C.lớp M D.lớp N. Câu 21. Cho biết một mol nguyên tử sắt có khối lượng bằng 55,85 g, một nguyên tử sắt có 26 electron. Vậy trong 1 kg sắt có bao nhiêu gam electron A.0,255 kg B.0,2 g C.0,5 g D.0,255 g. Câu 22. Trong hạt nhân nguyên tử, hạt mang điện là A.electron B.proton C.proton nơtron D.electron, nơtron. Câu 23. Số khối của nguyên tử bằng tổng A.số n và e. B.số p và e. C.tổng số n, p, e. D.số p và n. Câu 24. Số nơtron trong nguyên tử \({}_{19}^{39}K\) là A.20 B.39 C.19 D.58. Câu 25. Cho sơ đồ biểu diễn electron của tử Ag. Cấu hình electron của nguyên tử Ag là A.1s22s22p63s23p64p1. B. 1s22s22p63s23p63d104s24p55s1. C.1s22s22p63s23p63d104s24p64d105s1. D. 1s22s22p63s23p63d104s24p64d1. Câu 26. Nguyên tử P (Z=15) có số e lớp ngoài cùng là A.7. B.4. C.8. D.5. Câu 27. Tổng số p, n, e trong nguyên tử của nguyên tố X là 10. Số khối của nguyên tử nguyên tố X bằng A.5. B.6. C.7. D.8. Câu 28. Chọn phát biểu đúng trong các câu sau A. Hạt nhân nguyên tử chứa các hạt proton mang điện tích dương và các hạt nơtron không mang điện. B. Trong nguyên tử trung hòa, số hạt nơtron luôn bằng số hạt electron. C. Số khối của hạt nhân được kí hiệu là A và được tính bằng số hạt electron và số hạt proton. D. Khối lượng của nguyên tử tập trung chủ yếu ở lớp vỏ. Câu 29. Cho Mg (Z=12). Cấu hình electron của Mg2+ là A. 1s22s22p63s2. B. 1s22s22p63s23p2. C. 1s22s22p63s23p6. D. 1s22s22p6. Câu 30. Nguyên tử của nguyên tố A có phân lớp ngoài cùng là 3p. Tổng electron ở các phân lớp p là 9. Nguyên tố A là A.S B.Si C.P D.Cl. Lời giải chi tiết
Câu 1: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là 2, 6, 10, 14. Đáp án B Câu 2: Kim loại là các nguyên tử có 1,2,3 e lớp ngoài cùng Đáp án B Câu 3: Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân. Đáp án A Câu 4: Số công thức CO2 được tạo nên từ 2 đồng vị C và 3 đồng vị O trên là: 2 * 2 * 3 = 12 (phân tử) Đáp án A Câu 5: Phi kim là nguyên tố có 5,6,7 e lớp ngoài cùng (1), (4) là phi kim (2) là khí hiếm (có 8 e lớp ngoài cùng) (3) là kim loại Đáp án D Câu 6: A.Các đồng vị có cùng số proton. (sai vì Các đồng vị là các nguyên tử có cùng số proton.) B.Các đồng vị xuất phát từ các nguyên tố khác nhau. (sai vì các các nguyên tử là đồng vị thì thuộc cùng 1 nguyên tố hóa học) C.Tất cả các đồng đều được tìm thấy trong tự nhiên. (sai đồng vị có thể được tạo ra do con người) D.Các đồng vị được xếp vào một ô trong bảng tuần hoàn. (đúng vì các đồng vị thuộc cùng một nguyên tố hóa học thì được xếp vào một ô trong bảng hệ thống tuần hoàn) Đáp án D Câu 7: Từ giữ kiện của bài toán ta có hệ phương trình \(\left\{ \matrix{ 2Z + N = 48 \hfill \cr 2Z = 2N \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ Z = 16 \hfill \cr N = 16 \hfill \cr} \right.\) Số khối \(A = Z + N = 32\) Vậy kí hiệu nguyên tử là \({}_{16}^{32}R\). Đáp án C. Câu 8 A sai vì Na có cấu hình e: 1s22s22p63s1 => Na+ : 1s22s22p6 Đáp án A Câu 9: 1.Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân: Đúng. 2.Đồng vị là các nguyên tử có cùng số proton và số nơtron: Sai. Vì các đồng vị chỉ có số proton giống nhau còn số nơtron thì phải khác nhau. 3.Trong một nguyên tử, số proton luôn bằng số electron và bằng số đơn vị điện tích hạt nhân: Đúng. 4. Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết nguyên tử khối của nguyên tử: Sai. Vì kí hiệu nguyên tử cho biết số hiệu nguyên tử và số khối. 5. Đồng vị \({}_4^1H\) là trường hợp duy nhất mà nguyên tử không chứa nơtron: Đúng. 6. Nguyên tố s là những nguyên tố mà nguyên tử của chúng có 1 hoặc 2 electron ở lớp ngoài cùng: Sai. Số phát biểu đúng là 3. Đáp án D. Câu 10: Gọi % của đồng vị 63Cu là x thì % của đồng vị 65Cu là 100 – x Ta có: \(\dfrac{63 + 65.\left( {100 - X} \right)} {100} = 63,65\) \( \Rightarrow {}^{65}Cu\) là 27%. Đáp án D. Câu 11: A.1s < 2s. (đúng) B.4s > 3s. (đúng) C.3d < 4s. (sai) D.3p < 3d. (đúng) Đáp án C Câu 12: A.Nguyên tử được cấu tạo bởi 2 loại hạt là proton và nơtron. (sai vì nguyên tử gồm các hạt proton, notron, electron) B.Trong nguyên tử, số proton và số electron bằng nhau. (đúng) C.Đồng vị là tập hợp các nguyên tử có cùng số proton nhưng khác nhau số nơtron. (đúng) D.Trong nguyên tử, số proton luôn bằng số hiệu nguyên tử Z. (đúng) Đáp án A Câu 13: Cấu hình electron của nguyên tố S (Z=16) là: 1s22s22p63s23p4 Đáp án B Câu 14: Áp dụng công thức: \(\eqalign{ & \overline A = {{{A_1}{x_1} + {A_2}{x_2} + {A_3}{x_3}} \over {{x_1} + {x_2} + {x_3}}} \cr & \overline {{A_{Mg}}} = {{24.78,99 + 25.10 + 26.11,01} \over {100}}\cr&\;\;\;\;\;\;\;\; = 24,3202 \cr} \) Đáp án D. Câu 15: Xét 1 mol phân tử HClO4 có khối lượng bằng 100,5 g. \(\overline {{M_{Cl}}} = 35,5 \to \) đồng vị thứ hai là 35Cl. Trong 1 mol nguyên tử clo có 0,7577 mol và 0,2423 mol 37Cl. Phần trăm khối lượng \({}_{17}^{37}Cl\) trong HClO4 là: \(\dfrac{0,2423.37} {100,5}.100 = 8,92\% \) Đáp án C Câu 16: Số phân lớp e của lớp M (n =3) là 3 phân lớp : s, p, d Đáp án C Câu 17: Cấu hình electron của nguyên tử 39X là 1s22s22p63s23p64s1. Nguyên tử X có đặc điểm: (a)nguyên tố thuộc chu kì 4, nhóm IA: Đúng. (b)số đơn vị điện tích hạt nhân trong hạt nhân nguyên tử X là 20: Sai. Vì số đơn vị điện tích hạt nhân bằng số hiệu nguyên tử = 19. (c)X là nguyên tố kim loại mạnh: Đúng. (d)X có thể tạo thành ion X+ có cấu hình là 1s22s22p63s23p6: Đúng. Số phát biểu đúng là 3. Đáp án C. Câu 18: Trong nguyên tử có các hạt mang điện là proton và electron. Đáp án D Câu 19: Số electron tối đa trong lớp thứ 3 là 2 * n2 = 18 e Đáp án A Câu 20: Lớp e ngoài cùng của nguyên tử Mg là lớp số 3 => Lớp e ngoài cùng của nguyên tử Mg là lớp N Đáp án D Câu 21: Trong 1 kg sắt có: \(\dfrac{1kg.1000g/kg} {55,85g/mol} = 17,905\left( {mol} \right)\) \( \to \) Số nguyên tử sắt = 17,905.6,02.1023 nguyên tử. Mà 1 nguyên tử sắt có 26 electron \( \to \) Trong 1 kg sắt có lượng electron bằng: 17,905.26=465,53 mol electron Vậy khối lượng các electron bằng: 465,53mol.9,1.10-31kg/e.6,02.1023e/mol = 2,55.10-4 hay 0,255g Đáp án D. Câu 22: Trong hạt nhân nguyên tử, hạt mang điện là proton Đáp án B Câu 23 Số khối của nguyên tử bằng tổng số p và n. Đáp án D Câu 24 Số nơtron trong nguyên tử K là: 39 -19 = 20 Đáp án A Câu 25 Cấu hình e của nguyên tử Ag là: 1s22s22p63s23p63d104s24p64d105s1. Đáp án C Câu 26 Cấu hình e của P là: 1s22s22p63s23p3 Số e lớp ngoài cùng của P là 5 Đáp án D Câu 27: Trong nguyên tử: Số p = số e \( \to 2p + n = 10\) Lại có: \(1 \leqslant \dfrac{n}{p} \leqslant 1,5 \Rightarrow 1 \leqslant \dfrac{{10 - 2p}}{p} \leqslant 1,5 \) \(\Rightarrow 2,86 \leqslant p \leqslant 3,3\) Mà p là số nguyên nên \(p = e = 3 \to n = 4\) Vậy \(A= p + n = 7\) Đáp án C. Câu 28 A. Hạt nhân nguyên tử chứa các hạt proton mang điện tích dương và các hạt nơtron không mang điện. (đúng) B. Trong nguyên tử trung hòa, số hạt nơtron luôn bằng số hạt electron. (sai phải là số p = số e ) C. Số khối của hạt nhân được kí hiệu là A và được tính bằng số hạt electron và số hạt proton. (sai vì số khối A = số p + số n) D. Khối lượng của nguyên tử tập trung chủ yếu ở lớp vỏ. (sai vì khối lượng nguyên tử tập trung chủ yếu ở hạt nhân) Đáp án A Câu 29 Mg (Z=12): 1s22s22p63s2 Mg2+: 1s22s22p6. Đáp án D Câu 30: Tổng electron ở các phân lớp p là 9. Lớp 2 có phân lớp p là 2p6 \( \to \) Lớp 3 có phân lớp p là 3p3 Vậy A có cấu hình là: 1s22s22p63s23p3 (Z = 15) Vậy nguyên tố cần tìm là P Đáp án C. HocTot.Nam.Name.Vn
|