Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 1Đề bài
Câu 1 :
Trong các hợp chất sau, hợp chất nào có hàm lượng nitơ cao nhất?
Câu 2 :
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
Câu 3 :
Số Avogadro có giá trị bằng:
Câu 4 :
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
Câu 5 :
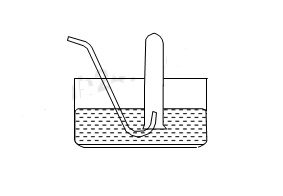
Cho hình vẽ về cách thu khí dời nước như sau: Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?
Câu 6 :
Trong 1 mol CO2 có bao nhiêu phân tử?
Câu 7 :
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là:
Câu 8 :
1 mol nước (H2O) chứa số phân tử là:
Câu 9 :
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
Câu 10 :
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
Câu 11 :
Khí N2 nhẹ hơn khí nào sau đây?
Câu 12 :
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Lời giải và đáp án
Câu 1 :
Trong các hợp chất sau, hợp chất nào có hàm lượng nitơ cao nhất?
Đáp án : C Lời giải chi tiết :
Tư duy nhanh: hợp chất của N với O có càng nhiều nguyên tử N thì hàm lượng nito càng cao \(\mathop N\limits^1 \mathop O\limits^1 \) \(\mathop N\limits^1 {\mathop O\limits^2 _2}\) \(\mathop {{N_2}}\limits^2 \mathop O\limits^1 \) \(\mathop {{N_2}}\limits^2 \mathop {{H_4}}\limits^{} \mathop {{O_3}}\limits^3 \) Ta thấy tỉ lệ 2:1 trong hợp chất N2O là lớn nhất. Do vậy hàm lượng nitơ trong N2O là cao nhất.
Câu 2 :
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
Đáp án : D Phương pháp giải :
Lấy phân tử khối của N2 chia cho phân tử khối của H2 Lời giải chi tiết :
Phân tử khối của N2 = 14×2 = 28 (gam/mol) Phân tử khối của H2 = 2×1 = 2 (gam/mol) Suy ra \({d_{{N_2}/{H_2}}} =\dfrac{{28}}{2}= 14\) Vậy N2 nặng hơn H2 14 lần
Câu 3 :
Số Avogadro có giá trị bằng:
Đáp án : C Lời giải chi tiết :
Số Avogadro có giá trị bằng: 6.1023
Câu 4 :
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
Đáp án : B Phương pháp giải :
Tính số mol Fe : nFe = mFe : MFe = ? (mol) Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết. Lời giải chi tiết :
nFe = 5,6 : 56 = 0,1 (mol) Fe + 2HCl \( \to\) FeCl2 + H2 Theo phương trình 1 2 (mol) Theo đề bài: 0,1 0,15 (mol) Ta thấy : \(\dfrac{{0,1}}{1} > \dfrac{{0,15}}{2}\). Do vậy HCl là chất phản ứng hết, Fe là chất còn dư.
Câu 5 :
Cho hình vẽ về cách thu khí dời nước như sau: Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?
Đáp án : B Lời giải chi tiết :
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước → chọn B có CO2 ít tan trong nước và H2 không tan trong nước
Câu 6 :
Trong 1 mol CO2 có bao nhiêu phân tử?
Đáp án : A Lời giải chi tiết :
1 mol chứa số nguyên tử là: 6,02.1023 => trong 1 mol CO2 có 6,02.1023 phân tử
Câu 7 :
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là:
Đáp án : C Lời giải chi tiết :
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là: n = V/ 22,4
Câu 8 :
1 mol nước (H2O) chứa số phân tử là:
Đáp án : A Phương pháp giải :
Dựa vào khái niệm mol để tính 1 mol nước chứa bao nhiêu phân tử: Mol là lượng chất chứa 6,02 . 1023 nguyên tử (phân tử) Lời giải chi tiết :
Vì 1 mol chứa 6,02 . 1023 nguyên tử (phân tử) => 1 mol H2O chứa: 1 x 6,02 . 1023= 6,02 . 1023 phân tử
Câu 9 :
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
Đáp án : D Lời giải chi tiết :
Vì cùng lấy 1 mol chất => chất có khối lượng lớn nhất cũng là chất có khối lượng mol lớn nhất Khối lượng mol của H2O là: M = 2.1 + 16 = 18 g/mol Khối lượng mol của HCl là: M = 1 + 35,5 = 36,5 g/mol Khối lượng mol của Fe2O3 là M = 56.2 + 16.3 = 160 g/mol Khối lượng mol của C6H12O6 là: M = 12.6 + 12 + 16.6 = 180 g/mol => chất có khối lượng lớn nhất là C6H12O6
Câu 10 :
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
Đáp án : B Phương pháp giải :
+) Tính số mol của CH4 và C2H4 theo CT: $n = \frac{m}{M}$ +) Tính khối lượng trung bình của hỗn hợp khí: $\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}}$ +) tỉ khối của hỗn hợp so với không khí là: ${d_{X/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$ Lời giải chi tiết :
Số mol của CH4 là: ${n_{C{H_4}}} = \frac{4}{{16}} = 0,25\,mol$ Số mol của C2H4 là: ${n_{{C_2}{H_4}}} = \frac{7}{{28}} = 0,25\,mol$ => khối lượng trung bình của hỗn hợp khí là: $\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{{m_{C{H_4}}} + {m_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{4 + 7}}{{0,25 + 0,25}} = 22$ => tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{22}}{{29}}$
Câu 11 :
Khí N2 nhẹ hơn khí nào sau đây?
Đáp án : D Phương pháp giải :
Xem lại công thức tính tỉ khối Lời giải chi tiết :
Ta có: ${d_{{N_2}/{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{H_2}}}}} = \frac{{28}}{2} = 14 > 1$ => khí N2 nặng hơn khí H2 ${d_{{N_2}/N{H_3}}} = \frac{{{M_{{N_2}}}}}{{{M_{N{H_3}}}}} = \frac{{28}}{{17}} = 1,647 > 1$ => khí N2 nặng hơn NH3 ${d_{{N_2}/{C_2}{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{C_2}{H_2}}}}} = \frac{{28}}{{26}} = 1,07 > 1$ => khí N2 nặng hơn khí C2H2 ${d_{{N_2}/{O_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{O_2}}}}} = \frac{{28}}{{32}} = 0,875 < 1$ => khí N2 nhẹ hơn khí O2
Câu 12 :
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Đáp án : B Phương pháp giải :
+) Tính số mol Fe và số mol CuSO4 +) Viết PTHH +) So sánh tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{CuS{O_4}}}}}{1}$ => chất hết, chất dư => tính khối lượng Cu theo chất hết Lời giải chi tiết :
Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$ Số mol CuSO4 là: ${n_{CuS{O_4}}} = \dfrac{m}{M} = \dfrac{{40}}{{64 + 32 + 16.4}} = 0,25\,mol$ PTHH: Fe + CuSO4 → FeSO4 + Cu Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,2}}{1} = 0,2$ và $\dfrac{{{n_{CuS{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$ Vì 0,2 < 0,25 => Fe phản ứng hết, CuSO4 dư => tính khối lượng Cu theo Fe PTHH: Fe + CuSO4 → FeSO4 + Cu 1mol 1mol 0,2 mol → 0,2 mol => khối lượng Cu thu được sau phản ứng là: mCu = 0,2.64 = 12,8 gam |