Đề kiểm tra 1 tiết Hóa 12 chương 6: Kim loại kiềm - Kim loại kiềm thổ - Nhôm - Đề số 3Đề bài
Câu 1 :
Để sản xuất nhôm từ quặng boxit người ta sử dụng phương pháp:
Câu 2 :
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
Câu 3 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Câu 4 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Câu 5 :
Trong nhóm IA đi từ đầu đến cuối các nguyên tố được sắp xếp theo chiều… của điện tích hạt nhân. Trong dấu “…” là?
Câu 6 :
Công thức của phèn chua là :
Câu 7 :
Phản ứng hoá học nào dưới đây không thuộc loại phản ứng nhiệt nhôm ?
Câu 8 :
Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Câu 9 :
Từ hỗn hợp Al2O3 và Fe2O3, muốn tách Al2O3 người ta thực hiện phản ứng :
Câu 10 :
Để bảo quản các kim loại kiềm, ta cần phải
Câu 11 :
Nước cứng là nước chứa nhiều:
Câu 12 :
Cho các dung dịch sau: Ba(OH)2, NaHSO4, K2CO3, Ba(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
Câu 13 :
Công thức hóa học của thạch cao khan là?
Câu 14 :
Cho chuỗi biến hóa sau : 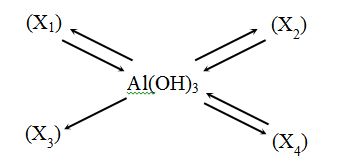 Vậy X1, X2, X3, X4 lần lượt là :
Câu 15 :
Cho biết số thứ tự của Al trong bảng tuần hoàn là 13. Phát biểu nào sau đây đúng ?
Câu 16 :
NaCl có lẫn tạp chất Na2CO3. Cách nào sau đây có thể dùng để thu được NaCl tinh khiết ?
Câu 17 :
Cho 10 gam một kim loại kiềm thổ M tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
Câu 18 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
Câu 19 :
Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Câu 20 :
Dung dịch X chứa 0,6 mol NaHCO3 và 0,3 mol Na2CO3. Thêm rất từ từ dung dịch chứa 0,8 mol HCl vào dung dịch X được dung dịch Y và V lít khí CO2 (đktc). Thêm vào dung dịch Y nước vôi trong dư thấy tạo thành m gam kết tủa. Tính thể tích V và khối lượng m.
Câu 21 :
Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được m gam kết tủa. Mặt khác, cho 1,5V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được 0,75m gam kết tủa. Giá trị của V là
Câu 22 :
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
Câu 23 :
Nung nóng m gam hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau Phần 1: tác dụng với dung dịch H2SO4 loãng dư sinh ra 3,08 lít khí H2 (ở đktc). Phần 2: tác dụng với dung dịch NaOH dư sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
Câu 24 :
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
Câu 25 :
Cho hỗn hợp gồm Na và Ba vào dung dịch chứa HCl 1M và H2SO4 0,6M. Sau khi kết thúc phản ứng thấy thoát ra 3,36 lít khí H2 (đktc) đồng thời thu được 13,98 gam kết tủa và dung dịch X có khối lượng giảm 0,1 gam so với dung dịch ban đầu. Cô cạn dung dịch X thu được m gam chất rắn. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Để sản xuất nhôm từ quặng boxit người ta sử dụng phương pháp:
Đáp án : D Lời giải chi tiết :
Để sản xuất nhôm từ quặng boxit người ta sử dụng phương pháp điện phân nóng chảy
Câu 2 :
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
Đáp án : C Phương pháp giải :
Ta có: Na[Al(OH)4]= NaAlO2 + 2 H2O NaAlO2 + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + H2O => Thu được kết tủa thì quan hệ giữa H+ và NaAlO2 Lời giải chi tiết :
Na[Al(OH)4]= NaAlO2 + 2 H2O NaAlO2 + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + H2O => Để thu được kết tủa thì nH+ (Hay nHCl)< 4.nNa[Al(OH)4] => q< 4p => p/q > 1/4
Câu 3 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Đáp án : A Lời giải chi tiết :
Dãy gồm các chất đều là kim loại kiềm thổ là Be, Ca, Sr, Ba
Câu 4 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Đáp án : D Phương pháp giải :
xem lại lí thuyết nhôm và hợp chất tác dụng với dung dịch kiềm Lời giải chi tiết :
Nếu b ≥ 4a thì kết tủa bị hoà tan hoàn toàn => để thu được kết tủa thì b < 4a
Câu 5 :
Trong nhóm IA đi từ đầu đến cuối các nguyên tố được sắp xếp theo chiều… của điện tích hạt nhân. Trong dấu “…” là?
Đáp án : B Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của điện tích hạt nhân nguyên tử.
Câu 6 :
Công thức của phèn chua là :
Đáp án : A Lời giải chi tiết :
Công thức của phèn chua là : K2SO4.Al2(SO4)3.24H2O
Câu 7 :
Phản ứng hoá học nào dưới đây không thuộc loại phản ứng nhiệt nhôm ?
Đáp án : D Lời giải chi tiết :
Phản ứng nhiệt nhôm là cho nhôm khử các oxit của kim loại => Phản ứng hoá học không thuộc loại phản ứng nhiệt nhôm là Al tác dụng với axit H2SO4 đặc, nóng.
Câu 8 :
Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Đáp án : B Phương pháp giải :
xem lại lí thuyết nhôm Lời giải chi tiết :
nFe3O4 = 1 mol => nAl = 3 mol PTHH: 3Fe3O4 + 8Al → 9Fe + 4Al2O3 1 → 8/3 → 3 → 4/3 => sau phản ứng Al còn dư, hỗn hợp thu được gồm Al, Fe, Al2O3
Câu 9 :
Từ hỗn hợp Al2O3 và Fe2O3, muốn tách Al2O3 người ta thực hiện phản ứng :
Đáp án : D Phương pháp giải :
Xem lại lí thuyết hợp chất nhôm Lời giải chi tiết :
Để tách Al2O3 người ta dùng dung dịch NaOH dư dể hòa tan Al2O3, sau đó sục CO2 vào dung dịch thu được kết tủa Al(OH)3. Nung nóng Al(OH)3 thu được Al2O3
Câu 10 :
Để bảo quản các kim loại kiềm, ta cần phải
Đáp án : B Lời giải chi tiết :
Để bảo quản các kim loại kiềm, ta cần phải ngâm chúng trong dầu hỏa
Câu 11 :
Nước cứng là nước chứa nhiều:
Đáp án : D Lời giải chi tiết :
Nước cứng là nước chứa nhiều ion Ca2+ , Mg2+
Câu 12 :
Cho các dung dịch sau: Ba(OH)2, NaHSO4, K2CO3, Ba(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
+) Ba(OH)2 phản ứng với NaHSO4, K2CO3, Ba(HCO3)2 +) NaHSO4 phản ứng với K2CO3, Ba(HCO3)2 +) K2CO3 phản ứng với Ba(HCO3)2 => có tất cả 6 phản ứng
Câu 13 :
Công thức hóa học của thạch cao khan là?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Thạch cao khan có công thức hóa học là CaSO4.
Câu 14 :
Cho chuỗi biến hóa sau :  Vậy X1, X2, X3, X4 lần lượt là :
Đáp án : A Phương pháp giải :
xem lại lí thuyết hợp chất nhôm Lời giải chi tiết :
Vì Al(OH)3 tạo ra X3 mà X3 không tạo được ra Al(OH)3 => X3 là Al2O3
Câu 15 :
Cho biết số thứ tự của Al trong bảng tuần hoàn là 13. Phát biểu nào sau đây đúng ?
Đáp án : D Lời giải chi tiết :
Cấu hình electron của Al: 1s22s22p63s23p1 => Số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3
Câu 16 :
NaCl có lẫn tạp chất Na2CO3. Cách nào sau đây có thể dùng để thu được NaCl tinh khiết ?
Đáp án : A Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Để thu được NaCl tinh khiết, ta cho hỗn hợp đó vào dung dịch HCl dư, sau đó cô cạn dung dịch. PTHH: NaHCO3 + HCl → NaCl + CO2 + H2O B sai vì nung hỗn hợp thì Na2CO3 không bị phân hủy. C sai vì BaCl2 + Na2CO3 → BaCO3 + 2NaCl Nếu BaCl2 dư thì NaCl vẫn không tinh khiết
Câu 17 :
Cho 10 gam một kim loại kiềm thổ M tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
Đáp án : C Phương pháp giải :
Bảo toàn e: 2nM = 2nH2 Lời giải chi tiết :
nH2 = 0,25 mol Bảo toàn e: 2nM = 2nH2 => nM = 0,25 mol => M = 10 / 0,25 = 40 => M là Ca
Câu 18 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
Đáp án : D Phương pháp giải :
+) mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 (1) +) Bảo toàn điện tích : ${n_{N{a^ + }}} + {\text{ }}{n_{{K^ + }}} = {\text{ }}{n_{HCO_3^ - }} + 2.{n_{CO_3^{2 - }}}$ (2) +) Bảo toàn C : nCO2 + nK2CO3 = x + y (3) Từ (1), (2) và (3) ta có : v = 0,2 lít = 200 ml Lời giải chi tiết :
Vì phản ứng tạo 4 muối => có tạo x mol CO32- và y mol HCO3- => mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 = 23.2,75V + 39.2V + 60x + 61y (1) Bảo toàn điện tích : ${n_{N{a^ + }}} + {\text{ }}{n_{{K^ + }}} = {\text{ }}{n_{HCO_3^ - }} + 2.{n_{CO_3^{2 - }}}$ => 2,75V + 2V = 2x + y (2) Bảo toàn C : nCO2 + nK2CO3 = x + y = 0,4 + V (3) Từ (1), (2) và (3) ta có : V = 0,2 lít = 200 ml
Câu 19 :
Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Đáp án : C Phương pháp giải :
+) nOH > 2nCO2=> OH‑ dư => nCO3 = nCO2 = 0,015 mol Và nOH- dư = nOH- ban đầu – nOH- phản ứng = nOH- ban đầu -$2{n_{CO_3^{2 - }}}$ +) mrắn = mNa + mK + mCO3 + mOH dư Lời giải chi tiết :
nCO2 = 0,015 mol; nOH = nNaOH + nKOH = 0,04 mol > 2nCO2 => OH‑ dư => nCO3 = nCO2 = 0,015 mol Và nOH- dư = nOH- ban đầu – nOH- phản ứng = nOH- ban đầu -$2{n_{CO_3^{2 - }}}$= 0,01 mol => mrắn = mNa + mK + mCO3 + mOH dư = 2,31 gam
Câu 20 :
Dung dịch X chứa 0,6 mol NaHCO3 và 0,3 mol Na2CO3. Thêm rất từ từ dung dịch chứa 0,8 mol HCl vào dung dịch X được dung dịch Y và V lít khí CO2 (đktc). Thêm vào dung dịch Y nước vôi trong dư thấy tạo thành m gam kết tủa. Tính thể tích V và khối lượng m.
Đáp án : A Phương pháp giải :
Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O Lời giải chi tiết :
Thêm từ từ HCl vào X thì sẽ xảy ra phản ứng theo thứ tự sau : CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O => nCO2 = nH+ - nCO3 = 0,8 – 0,3 = 0,5 mol Và nHCO3(Y) = nCO3 + nHCO3(X) – nCO2 = 0,3 + 0,6 – 0,5 = 0,4 mol => VCO2 = 11,2 lít Và nCaCO3 = nHCO3 = 0,4 mol => m = 40 gam
Câu 21 :
Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được m gam kết tủa. Mặt khác, cho 1,5V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được 0,75m gam kết tủa. Giá trị của V là
Đáp án : A Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Giả sử thí nghiệm 1 Al3+ dư => nNaOH = 3nkết tủa (1) Thí ngiệm 2 : có sự hòa tan kết tủa vì NaOH tăng mà lượng kết tủa giảm => nkết tủa = 4.nAlCl3 – nOH- (2) Từ (1),(2) : $\left\{ \begin{gathered}V = 3.\dfrac{m}{{78}} \hfill \\\dfrac{{0,75m}}{{78}} = 4.0,14 - 1,5V \hfill \\ \end{gathered} \right.$ => V = 0,32 lit
Câu 22 :
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
Đáp án : A Phương pháp giải :
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a $\geqslant $ 4 thì không có kết tủa Lời giải chi tiết :
Ta có: a = 0,05 mol; b = 0,01 mol => b < a Đề bài yêu cầu tính VHCl nhỏ nhất có nghĩa là phải tính nH+ min thì nH+ = b = 0,01 => V = 0,01 lít = 10 ml
Câu 23 :
Nung nóng m gam hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau Phần 1: tác dụng với dung dịch H2SO4 loãng dư sinh ra 3,08 lít khí H2 (ở đktc). Phần 2: tác dụng với dung dịch NaOH dư sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
Đáp án : A Phương pháp giải :
+) phần 2 : Bảo toàn e :$3{n_{Al}} = 2{n_{{H_2}}}$ +) phần 1 : Bảo toàn e :$3{n_{Al}} + 2{n_{Fe}} = 2{n_{{H_2}\,(1)}}$ +) Bảo toàn nguyên tố Fe : ${n_{F{e_2}{O_3}}} = \frac{{{n_{Fe}}}}{2}$ +) Bảo toàn nguyên tố O :${n_{A{l_2}{O_3}}}\; = {\text{ }}{n_{F{e_2}{O_3}}}\;$ +) Bảo toàn khối lượng : mtrước phản ứng = msau phản ứng = ${m_{A{l_2}{O_3}}} + {m_{Fe}} + {m_{Al}}$ Lời giải chi tiết :
Y tác dụng với NaOH giải phóng H2 → hỗn hợp rắn Y gồm Al2O3, Fe và Al dư Xét phần 2 : Bảo toàn e : $3{n_{Al}} = 2{n_{{H_2}}}\,\, \to \,\,{n_{Al}} = \frac{2}{3}{n_{{H_2}\,(2)}} = \,\,0,025\,\,mol$ Xét phần 1 : Bảo toàn e : $3{n_{Al}} + 2{n_{Fe}} = 2{n_{{H_2}\,(1)}}\,\, \to \,\,{n_{Fe}} = \frac{{2{n_{{H_2}(1)}} - 3{n_{Al}}}}{2} = \frac{{2.0,1375 - 3.0,025}}{2} = 0,1\,\,mol$ Bảo toàn nguyên tố Fe :${n_{F{e_2}{O_3}}} = \frac{{{n_{Fe}}}}{2} = 0,05\,\,mol$ Bảo toàn nguyên tố O :${n_{A{l_2}{O_3}}}\; = {\text{ }}{n_{F{e_2}{O_3}}}\; = {\text{ }}0,05{\text{ }}mol\;$ Bảo toàn khối lượng : mtrước phản ứng = msau phản ứng = ${m_{A{l_2}{O_3}}} + {m_{Fe}} + {m_{Al}}$ → m = (0,05.102 + 0,1.56 + 0,025.27).2 = 22,75 gam
Câu 24 :
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
Đáp án : A Phương pháp giải :
+) Chất rắn Y có thể gồm Al2O3, Fe, Fe2O3 và Al Y tác dụng với NaOH : nAl (trong Y) = $\frac{2}{3}{n_{{H_2}}}$ Y tác dụng với HCl :$2{n_{{H_2}}}$ = 3nAl + 2nFe +) ${n_{A{l_2}{O_3}}} = \frac{1}{2}{n_{Fe}}$ +) Bảo toàn nguyên tử Al : nAl ban đầu = 2nAl2O3+ nAl dư Lời giải chi tiết :
2Al + Fe2O3 $\xrightarrow{{{t^o}}}$ Al2O3 + 2Fe Chất rắn Y có thể gồm Al2O3, Fe, Fe2O3 và Al Y tác dụng với NaOH : nAl (trong Y) = $\frac{2}{3}{n_{{H_2}}}$ = 0,2 mol Y tác dụng với HCl :$2{n_{{H_2}}}$ = 3nAl + 2nFe → 2.0,4 = 3.0,2 + 2nFe → nFe = 0,1 mol ${n_{A{l_2}{O_3}}} = \frac{1}{2}{n_{Fe}}$= 0,05 mol Bảo toàn nguyên tử Al : nAl ban đầu = 2nAl2O3+ nAl dư = 2.0,05 + 0,2 = 0,3 mol
Câu 25 :
Cho hỗn hợp gồm Na và Ba vào dung dịch chứa HCl 1M và H2SO4 0,6M. Sau khi kết thúc phản ứng thấy thoát ra 3,36 lít khí H2 (đktc) đồng thời thu được 13,98 gam kết tủa và dung dịch X có khối lượng giảm 0,1 gam so với dung dịch ban đầu. Cô cạn dung dịch X thu được m gam chất rắn. Giá trị của m là
Đáp án : A Phương pháp giải :
+) Đặt a và b là số mol của Na, Ba => a + 2b = 0,15.2 (1) mdung dịch giảm = 23a + 137b – 13,98 – 0,15.2 = - 0,1 (2) +) nBaSO4 = 0,06 mol => Ba2+ còn dư => nH2SO4 = 0,06 mol => nHCl = 0,06.1/0,6 +) Dung dịch X chứa Ba2+ (0,02), Na+ (0,14 mol); Cl- (0,1 mol) và OH- Bảo toàn điện tích => nOH- = 0,08 mol Lời giải chi tiết :
Đặt a và b là số mol của Na, Ba => a + 2b = 0,15.2 (1) mdung dịch giảm = 23a + 137b – 13,98 – 0,15.2 = - 0,1 (2) Từ (1) và (2) => a = 0,14; b = 0,08 nBaSO4 = 0,06 mol => Ba2+ còn dư 0,08 – 0,06 = 0,02 mol => nH2SO4 = 0,06 mol => nHCl = 0,06.1/0,6 = 0,1 Dung dịch X chứa Ba2+ (0,02), Na+ (0,14 mol); Cl- (0,1 mol) và OH- Bảo toàn điện tích => nOH- = 0,08 mol => mrắn = 10,87 gam |












