Đề kiểm tra 1 tiết Hóa 12 chương 6: Kim loại kiềm - Kim loại kiềm thổ - Nhôm - Đề số 1Đề bài
Câu 1 :
CaCO3.MgCO3 là thành phần chính của quặng?
Câu 2 :
Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Câu 3 :
Cation M+ có cấu hình electron ở lớp ngoài cùng là 3s23p6. M+ là cation nào sau đây?
Câu 4 :
Công thức của phèn chua là :
Câu 5 :
Cấu hình electron của nguyên tố X là 1s22s22p63s1. Vậy X thuộc nhóm
Câu 6 :
Quặng boxit có công thức là
Câu 7 :
Nước cứng vĩnh cửu là
Câu 8 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Câu 9 :
Vì sao những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng ?
Câu 10 :
Tính chất nào sau đây của nhôm là đúng ?
Câu 11 :
Có các hỗn hợp chất rắn (1) FeO, BaO, Al2O3 (tỉ lệ mol 1: 1 : 1) (2) Al, K, Al2O3 (tỉ lệ mol 1: 2: 1) (3) Na2O, Al (tỉ lệ mol 1: 1) (4) K2O, Zn (tỉ lệ mol 1: 1) Số hỗn hợp tan hết trong nước (dư) là :
Câu 12 :
Trong nhóm IA đi từ đầu đến cuối các nguyên tố được sắp xếp theo chiều… của điện tích hạt nhân. Trong dấu “…” là?
Câu 13 :
Công thức hóa học của thạch cao khan là?
Câu 14 :
Cho các chất sau: CaCO3, BaSO4, Mg(OH)2, Ba(HCO3)2 . Số chất bị nhiệt phân?
Câu 15 :
Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Câu 16 :
Hỗn hợp X gồm 2 kim loại kiềm và 1 kim loại kiềm thổ tan hết trong nước tạo dung dịch Y và thoát ra V lít (đktc) khí H2. Để trung hòa dung dịch Y cần dùng vừa đủ 600 ml dung dịch H2SO4 1M. Giá trị của V là
Câu 17 :
Hòa tan hết một lượng Na vào dung dịch HCl 10% thu được 46,88 gam dung dịch gồm NaCl và NaOH và 1,568 lít H2 (đktc). Nồng độ % NaCl trong dung dịch thu được là
Câu 18 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
Câu 19 :
Hấp thụ hết 0,2 mol CO2 vào dung dịch chứa 0,025 mol NaOH và 0,1 mol Ba(OH)2, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
Câu 20 :
Hoà tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dung dịch HCl dư, thu được 3,36 lít khí CO2 (đktc) và dung dịch chứa m gam muối KCl. Giá trị của m là
Câu 21 :
Tiến hành 2 thí nghiệm: Thí nghiệm 1: cho 100 ml dung dịch AlCl3 x (mol/l) tác dụng với 600 ml dung dịch NaOH 1M thu được 2y mol kết tủa. Thí nghiệm 2: Cho 100 ml dd AlCl3 x (mol/l) tác dụng với 660 ml dd NaOH 1M thu được y mol kết tủa. Giá trị của x là:
Câu 22 :
X là dung dịch Al2(SO4)3, Y là dung dịch Ba(OH)2. Trộn 200 ml dd X với 300 ml dung dịch Y thu được 8,55 gam kết tủa. Trộn 200 ml dd X với 500 ml dd Y thu được 12,045 gam kết tủa. Nồng độ mol/l của dd X là
Câu 23 :
Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng 2 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Câu 24 :
Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
Câu 25 :
Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x là?
Lời giải và đáp án
Câu 1 :
CaCO3.MgCO3 là thành phần chính của quặng?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Thành phần chính của quặng đôlomit là: CaCO3.MgCO3.
Câu 2 :
Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Đáp án : B Phương pháp giải :
xem lại lí thuyết nhôm Lời giải chi tiết :
nFe3O4 = 1 mol => nAl = 3 mol PTHH: 3Fe3O4 + 8Al → 9Fe + 4Al2O3 1 → 8/3 → 3 → 4/3 => sau phản ứng Al còn dư, hỗn hợp thu được gồm Al, Fe, Al2O3
Câu 3 :
Cation M+ có cấu hình electron ở lớp ngoài cùng là 3s23p6. M+ là cation nào sau đây?
Đáp án : D Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Cation M+ có cấu hình electron ở lớp ngoài cùng là 3s23p6 => cấu hình e của M là: 1s22s22p63s23p64s1 => M là K
Câu 4 :
Công thức của phèn chua là :
Đáp án : A Lời giải chi tiết :
Công thức của phèn chua là : K2SO4.Al2(SO4)3.24H2O
Câu 5 :
Cấu hình electron của nguyên tố X là 1s22s22p63s1. Vậy X thuộc nhóm
Đáp án : A Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Cấu hình electron của X là 1s22s22p63s1=> X là nguyên tố thuộc chu kì 3, nhóm IA
Câu 6 :
Quặng boxit có công thức là
Đáp án : A Lời giải chi tiết :
Quặng boxit có công thức là Al2O3.2H2O
Câu 7 :
Nước cứng vĩnh cửu là
Đáp án : C Lời giải chi tiết :
Nước cứng vĩnh cửu là nước có chứa Ca2+, Mg2+, Cl-, SO42-
Câu 8 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Đáp án : D Phương pháp giải :
xem lại lí thuyết nhôm và hợp chất tác dụng với dung dịch kiềm Lời giải chi tiết :
Nếu b ≥ 4a thì kết tủa bị hoà tan hoàn toàn => để thu được kết tủa thì b < 4a
Câu 9 :
Vì sao những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng ?
Đáp án : B Lời giải chi tiết :
Những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng vì trên bề mặt vật được phủ một lớp nhôm oxit mỏng, bền, ngăn cách vật với nước.
Câu 10 :
Tính chất nào sau đây của nhôm là đúng ?
Đáp án : C Phương pháp giải :
xem lại lí thuyết nhôm Lời giải chi tiết :
Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội.
Câu 11 :
Có các hỗn hợp chất rắn (1) FeO, BaO, Al2O3 (tỉ lệ mol 1: 1 : 1) (2) Al, K, Al2O3 (tỉ lệ mol 1: 2: 1) (3) Na2O, Al (tỉ lệ mol 1: 1) (4) K2O, Zn (tỉ lệ mol 1: 1) Số hỗn hợp tan hết trong nước (dư) là :
Đáp án : D Phương pháp giải :
xem lại lí thuyết hợp chất nhôm Lời giải chi tiết :
(1) không tan hết vì có FeO (2) \[{\rm{2K + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{2KOH + }}{{\rm{H}}_{\rm{2}}}\] => nKOH = nK = 2 mol = > Tổng số mol KOH phản ứng với Al và Al2O3 là 1+ 2 = 3 mol > nKOH ban đầu => hỗn hợp không tan hết (3) nNaOH = 2nNa2O = 2 mol Vì nNaOH > nAl => hỗn hợp tan hết (4) nKOH = 2nK2O = 2 mol 2KOH + Zn → K2ZnO2 + H2 2 mol 1 mol => hỗn hợp tan hết Nhận xét: nếu nK $ \geqslant $ nAl hoặc nK $ \geqslant $ 2nZn thì hỗn hợp tan hết
Câu 12 :
Trong nhóm IA đi từ đầu đến cuối các nguyên tố được sắp xếp theo chiều… của điện tích hạt nhân. Trong dấu “…” là?
Đáp án : B Phương pháp giải :
xem lại lí thuyết kim loại kiềm Lời giải chi tiết :
Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của điện tích hạt nhân nguyên tử.
Câu 13 :
Công thức hóa học của thạch cao khan là?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Thạch cao khan có công thức hóa học là CaSO4.
Câu 14 :
Cho các chất sau: CaCO3, BaSO4, Mg(OH)2, Ba(HCO3)2 . Số chất bị nhiệt phân?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Mg(OH)2 \(\buildrel {{t^0}} \over CaCO3 \(\buildrel {{t^0}} \over Ba(HCO3)2 \(\buildrel {{t^0}} \over => Số chất bị nhiệt phân là 3
Câu 15 :
Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Các chất tạo kết tủa với dung dịch BaCl2 là: SO3, NaHSO4, Na2SO3, K2SO4 SO3 + H2O → H2SO4 BaCl2 + H2SO4 → BaSO4↓ + 2HCl BaCl2 + 2NaHSO4 → BaSO4↓ + 2HCl + Na2SO4 BaCl2 + Na2SO3 → 2NaCl + BaSO3↓ BaCl2 + K2SO4 → 2KCl + BaSO4↓
Câu 16 :
Hỗn hợp X gồm 2 kim loại kiềm và 1 kim loại kiềm thổ tan hết trong nước tạo dung dịch Y và thoát ra V lít (đktc) khí H2. Để trung hòa dung dịch Y cần dùng vừa đủ 600 ml dung dịch H2SO4 1M. Giá trị của V là
Đáp án : A Phương pháp giải :
Ta có: nH+ = nOH- = 2nH2 mà nH+ = 2nH2SO4 => nH2 = nH2SO4 Lời giải chi tiết :
Ta có: nH+ = nOH- = 2nH2 mà nH+ = 2nH2SO4 => nH2 = nH2SO4 = 0,6 mol => V = 0,06.22,4 = 13,44 lít
Câu 17 :
Hòa tan hết một lượng Na vào dung dịch HCl 10% thu được 46,88 gam dung dịch gồm NaCl và NaOH và 1,568 lít H2 (đktc). Nồng độ % NaCl trong dung dịch thu được là
Đáp án : A Phương pháp giải :
+) Bảo toàn nguyên tử Na: nNa ban đầu = x + y mol +) Bảo toàn e: nNa = 2nH2 => x + y = 2.0,07 (1) +) nHCl phản ứng = nNaCl = x mol => mdd sau phản ứng = mNa + mdd HCl – mH2 = 23.(x + y) + 365x – 2.0,07 = 46,88 (2) Lời giải chi tiết :
nH2 = 0,07 mol Gọi nNaCl = x mol; nNaOH = y mol Bảo toàn nguyên tử Na: nNa ban đầu = x + y mol Bảo toàn e: nNa = 2nH2 => x + y = 2.0,07 (1) nHCl phản ứng = nNaCl = x mol => mdung dịch HCl = 36,5x.100 / 10 = 365x gam => mdd sau phản ứng = mNa + mdd HCl – mH2 = 23.(x + y) + 365x – 2.0,07 = 46,88 (2) Từ (1) và (2) => x = 0,12; y = 0,02 mol $ = > \,\,C{\% _{NaCl}} = \dfrac{{0,12.58,5}}{{46,88}}.100\% = 14,97\% $
Câu 18 :
Hấp thụ hoàn toàn 8,96 lít CO2 (đktc) vào V ml dung dịch chứa NaOH 2,75M và K2CO3 1M. Cô cạn dung dịch sau phản ứng ở nhiệt độ thường thu được 64,5 gam chất rắn khan gồm 4 muối. Giá trị của V là
Đáp án : D Phương pháp giải :
+) mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 (1) +) Bảo toàn điện tích : ${n_{N{a^ + }}} + {\text{ }}{n_{{K^ + }}} = {\text{ }}{n_{HCO_3^ - }} + 2.{n_{CO_3^{2 - }}}$ (2) +) Bảo toàn C : nCO2 + nK2CO3 = x + y (3) Từ (1), (2) và (3) ta có : v = 0,2 lít = 200 ml Lời giải chi tiết :
Vì phản ứng tạo 4 muối => có tạo x mol CO32- và y mol HCO3- => mrắn = mNa + mK + mCO3 + mHCO3 => 64,5 = 23.2,75V + 39.2V + 60x + 61y (1) Bảo toàn điện tích : ${n_{N{a^ + }}} + {\text{ }}{n_{{K^ + }}} = {\text{ }}{n_{HCO_3^ - }} + 2.{n_{CO_3^{2 - }}}$ => 2,75V + 2V = 2x + y (2) Bảo toàn C : nCO2 + nK2CO3 = x + y = 0,4 + V (3) Từ (1), (2) và (3) ta có : V = 0,2 lít = 200 ml
Câu 19 :
Hấp thụ hết 0,2 mol CO2 vào dung dịch chứa 0,025 mol NaOH và 0,1 mol Ba(OH)2, kết thúc các phản ứng thu được m gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
Xét nCO2 < nOH- < 2.nCO2 +) nCO3 = nOH – nCO2 = 0,025 mol Vì nCO3 < nBa2+ => nBaCO3 = nCO3 Lời giải chi tiết :
nOH- = 0,225 mol ; nCO2 = 0,2 mol => nCO2 < nOH- < 2.nCO2 => nCO3 = nOH – nCO2 = 0,025 mol Vì nCO3 < nBa2+ => nBaCO3 = nCO3 = 0,025 mol => mkết tủa = 4,925 gam
Câu 20 :
Hoà tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dung dịch HCl dư, thu được 3,36 lít khí CO2 (đktc) và dung dịch chứa m gam muối KCl. Giá trị của m là
Đáp án : D Phương pháp giải :
+) Coi hỗn hợp gồm KHCO3 và MgCO3 có số mol lần lượt là x và y (vì MNaHCO3 = MMgCO3) +) x + y = 0,15 +) 100x + 84y = 14,52 Lời giải chi tiết :
Coi hỗn hợp gồm KHCO3 và MgCO3 có số mol lần lượt là x và y (vì MNaHCO3 = MMgCO3) nCO2 = 0,15 mol => x + y = 0,15 100x + 84y = 14,52 => x = 0,12 và y = 0,03 => m = 0,12 . (39 + 35,5) = 8,94g
Câu 21 :
Tiến hành 2 thí nghiệm: Thí nghiệm 1: cho 100 ml dung dịch AlCl3 x (mol/l) tác dụng với 600 ml dung dịch NaOH 1M thu được 2y mol kết tủa. Thí nghiệm 2: Cho 100 ml dd AlCl3 x (mol/l) tác dụng với 660 ml dd NaOH 1M thu được y mol kết tủa. Giá trị của x là:
Đáp án : C Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Al3+ như nhau; lượng NaOH tăng mà kết tủa lại giảm → có 2 TH xảy ra là : TH1: ở TN1 kết tủa chưa cực đại, TN2 kết tủa bị tan 1 phần TH2: cả 2 TN kết tủa bị tan 1 phần $(1)\left\{ \begin{gathered}{n_{A{l^{3 + }}}} = 0,1x\,mol \hfill \\{n_{O{H^ - }}} = 0,6\,mol \hfill \\ \end{gathered} \right. \to 2y = \dfrac{{0,6}}{3} = 0,2 \to y = 0,1\,mol$ $(2):0,66 = 3.0,1x + (0,1x - 2y) \to x = 1,9$ (vô lý vì thu được 0,2 gam kết tủa) $TH2:\left\{\begin{gathered}(1)0,6 = 0,3x + (0,1x - 2y) \hfill \\(2)0,66 = 0,1x.3 + (0,1x - y) \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}x = 1,8 \hfill \\y = 0,06 \hfill \\ \end{gathered} \right.$
Câu 22 :
X là dung dịch Al2(SO4)3, Y là dung dịch Ba(OH)2. Trộn 200 ml dd X với 300 ml dung dịch Y thu được 8,55 gam kết tủa. Trộn 200 ml dd X với 500 ml dd Y thu được 12,045 gam kết tủa. Nồng độ mol/l của dd X là
Đáp án : B Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Khi trộn 200ml X với 500ml Y thu được lượng kết tủa lớn hơn trộn 200ml X với 300ml Y => khi trộn với 300ml Y, Al2(SO4)3 vẫn còn dư, Ba(OH)2 phản ứng hết, kết tủa Al(OH)3 không bị hòa tan Gọi x, y là nồng độ của 2 dung dịch X và Y Trộn 200 ml X với 300 ml Y: nBa(OH)2 = 0,3y 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3 0,3y 0,1y 0,3y 0,2y mkết tủa = mBaSO4 + mAl(OH)3 = 233.0,3y + 78.0,2y = 8,55g => y = 0,1M Trộn 200 ml X với 500 ml Y: nAl2(SO4)3 = 0,2x Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3 0,2x 0,3x 0,3x 0,2x Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O z 2z mkết tủa = mBaSO4 + mAl(OH)3 = 233.0,3x + 78.(0,2x - 2z) = 12,045 gam => 85,5x - 156z = 12,045 Số mol Ba(OH)2 tham gia pư: nBa(OH)2 = 0,3x + z = 0,5.y = 0,5.0,1 = 0,05 mol => x = 0,15M và z = 0,005 mol Vậy nồng độ của dung dịch X và Y lần lượt là 0,15M và 0,1M
Câu 23 :
Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng 2 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Đáp án : B Phương pháp giải :
xét tỉ lệ phản ứng, xác định chất dư, hết Lời giải chi tiết :
Gọi ${n_{F{e_2}{O_3}}} = 2\,\,mol\,\, \to \,\,\,{n_{Al}} = 3\,\,mol$ Fe2O3 + 2Al $\xrightarrow{{{t^o}}}$ 2Fe + Al2O3 $\dfrac{{{n_{F{e_2}{O_3}}}}}{1} = \dfrac{2}{1} > \dfrac{{{n_{Al}}}}{2} = \dfrac{3}{2}$ => Al hết, Fe2O3 dư → hỗn hợp sau phản ứng gồm Al2O3, Fe và Fe2O3
Câu 24 :
Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tử O :${n_{{H_2}O}} = 4{n_{F{e_3}{O_4}}}$ Bảo toàn nguyên tử H :${n_{HCl}} = 2{n_{{H_2}O}} + 2{n_{{H_2}}}$ +) mmuối = mkim loại + mCl Lời giải chi tiết :
Bảo toàn nguyên tử O : ${n_{{H_2}O}} = 4{n_{F{e_3}{O_4}}}$= 4.0,04 = 0,16 mol Bảo toàn nguyên tử H : ${n_{HCl}} = 2{n_{{H_2}O}} + 2{n_{{H_2}}}$= 2.0,16 + 2.0,15 = 0,62 mol => nCl = nHCl = 0,62 mol => mmuối = mkim loại + mCl = 0,12.27 + 0,04.3.56 + 0,62.35,5 = 31,97 gam
Câu 25 :
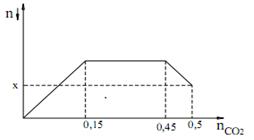
Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x là?
Đáp án : A Phương pháp giải :
Dựa vào đồ thị kết hợp với phương trình ion rút gọn CO2 + 2OH− → CO32− + H2O CO32− + Ca2+ → CaCO3↓ CO2 + H2O + CaCO3↓→ Ca(HCO3)2 CO2 + OH− → HCO3− Sục CO2 vào, CO2 biến thiên chưa biết. Do vậy kết tủa cực đại khi tất cả [Ca2+] → CaCO3 Công thức giải nhanh: n kết tủa = nOH- – n CO2 Lời giải chi tiết :
Quan sát đồ thị ta thấy nCO2 = 0,15 thì kết tủa đạt max. => nCa(OH)2 = nCaCO3 max = 0,15 Khi nCO2 = 0,45 thì bắt đầu hòa tan kết tủa. Khi nCO2 = 0,5 thì lượng kết tủa bị hòa tan là: nCaCO3 bị hòa tan = 0,5 - 0,45 = 0,05 => nCaCO3 còn lại = x = 0,15 - 0,05 = 0,1 |