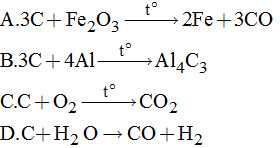Đề kiểm tra 1 tiết (45 phút) - Đề số 4 - Chương III - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 4 - Chương III - Hóa học 11 Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Chất nào sau đây là nguyên nhân chính gây nên hiệu ứng nhà kính? A.N2 B.O2 C.H2 D.CO2 Câu 2. Đốt 10 gam mẫu thép X trong oxi dư rồi dẫn toàn bộ sản phẩm qua nước vôi trong dư thu được 0,5 gam kết tủa. Hàm lượng cacbon trong mẫu thép X là: A.0,80% B.0,70% C.0,60% D.0,65% Câu 3. Hãy cho biết khẳng định nào sau đây đúng? Các nguyên tố nhóm cacbon có đặc điểm giống nhau là: A. Cấu hình electron lớp ngoài cùng là ns2np2(n = 2, 3,...). B. Trong các hợp chất với hiđro, chúng đều có số oxi hóa là -4. C. Trong các oxit, số oxi hóa của nguyên tố chỉ là +4. D. Có khả năng liên kết với nguyên tử cùng loại để tạo thành mạch đồng nguyên tử. Câu 4. Nung hỗn hợp chứa 5,6 gam CaO và 5,4 gam C bằng hồ quang điện thu được chất rắn X và khí Y. Khí Y chấy được trong không khí. Thành phần phần trăm theo khối lượng trong X là: A.78,05% CaC2 và 21,95% Cdư B.77,00% CaC2 và 23,00% Cdư C.75,00% CaC2 và 25,00% Cdư. D.60,00% CaC2 và 40,00% Cdư. Câu 5. Cacbon có mấy dạng hình thù? A.1 B.2 C.3 D.4 Câu 6. Tính oxi hóa của cacbon đơn chất thể hiện trong phản ứng nào sau đây?
Câu 7. Nung nóng hỗn hợp 38,3 gam hỗn hợp PbO và CuO với một lượng cacbon mono oxit vừa đủ, lượng khí sinh ra được dẫn qua dung dịch nước vôi trong dư thu được 30 gam kết tủa trắng. Khối lượng củ oxit kim loại trong hỗn hợp ban đầu tương ứng là: A. 24 gam và 14,3 gam B. 22,3 gam và 16 gam C. 26 gam và 12,3 gam D. 15,3 gam và 23 gam Câu 8. Khi thực hiện phản ứng giữa cacbon mono oxit với oxi, điều khẳng định nào sau đây là sai? A. Phản ứng tỏa nhiệt. B. Áp suất sau phản ứng giảm. C. Phản ứng thu nhiệt. D. Phản ứng không xảy ra ở nhiệt độ thường. II. PHẦN TỰ LUẬN Câu 9. Cho ba chất bột màu trắng đựng trong ba ống nghiệm: K2CO3; KNO3 và CaCO3. Chỉ sử dụng tối đa hai hóa chất để nhận biết các mẫu chất rắn trên. Câu 10. Có 4 gói bột sau: SiO2; Fe2O3; CuO và Al2O3. Bằng phương pháp hóa học có thể nhận biết các chất trên mà chỉ dùng một thuốc thử duy nhất không? Câu 11. Trộn đều hỗn hợp gồm CuO và một oxit sắt với một lượng cacbon dư. Khi phản ứng kết thúc, thu được 2,8 lít CO2 (đktc) và 12 gam hỗn hợp 2 kim loại. Xác định công thức oxit sắt, biết nCuO : noxit sắt = 2 : 1. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: CO2 là chất khí gây nên hiệu ứng nhà kính Đáp án D Câu 2: n CaCO3 = 0,5 : 100 = 0,005 mol Áp dụng định luật bảo toàn nguyên tố C => n CO2 = n CaCO3 = 0,005 mol => m C = 0,005 . 12 = 0,06 gam => %m C = 0,06 : 10 . 100% = 0,6% Đáp án C Câu 4: Ta có phương trình hóa học: CaO + 3C → CaC2 + CO (1) n CaO = 5,6 : 56 = 0,1 mol n C = 5,4 : 12 = 0,45 mol Ta thấy 0,1 : 1 < 0,45 : 3 => Sau phản ứng, C còn dư, CaO phản ứng hết (1) n CaC2 = n CaO = 0,1 mol (1) n C phản ứng = 3. n CaO = 0,3 mol => n C dư = 0,45 – 0,3 = 0,15 mol => % m CaC2 = (0,1 . 64): (0,1 . 64 + 0,15 . 12) . 100% = 78,05% % m C = 21,95% Đáp án A Câu 5: Cacbon có 4 dạng thù hình: Kim cương, than chì, cacbon vô định hình, fuleren. Đáp án D Câu 6: Oxi hóa là chất nhận e, sau phản ứng có số oxi hóa giảm Đáp án B Câu 7: \(\left\{ \begin{array}{l}PbO\\CuO\end{array} \right. + CO \to \left\{ \begin{array}{l}Pb\\Cu\end{array} \right. + C{O_2}\)(1) n CaCO3 = n CO2 = 30 : 100 = 0,3 mol (1) n CO = n CO2 = 0,3 mol Áp dụng định luật bảo toàn khối lượng ta có: m Oxit kim loại + m CO = m Kim loại + m CO2 => 38,3 + 0,3 . 28 = m Kim loại + 0,3 .44 => m Kim loại = 33,5 gam Gọi số mol của PbO, CuO lần lượt là x, y => Ta có hệ phương trình: \(\left\{ \begin{array}{l}x + y = 0,3\\207x + 64y = 33,5\end{array} \right.\) => x = 0,1 mol; y = 0,2 mol => m PbO = 22,3 gam; m CuO = 16 gam Đáp án B Câu 8: Đáp án C II. PHẦN TỰ LUẬN Câu 9. Trích mỗi chất một ít làm mẫu thử. + Hòa tan các mẫu trên vào nước. Mẫu thử không tan là CaCO3, hai mẫu còn lại tạo dung dịch trong suốt. + Cho quỳ tím lần lượt vào hai dung dịch trên, mẫu làm quỳ tím hóa xanh là K2CO3, mẫu không làm quỳ tím đôir màu là KNO3. Các quá trình: \(\begin{array}{l}{K_2}C{O_3} \to 2{K^ + } + CO_3^{2 - }\\CO_3^{2 - } + HOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - + O{H^ - }\end{array}\) Câu 10. Trích mỗi chất một ít làm mẫu thử. Cho dung dịch HCl lần luợt vào các mẫu thử trên + Mẫu thử tạo dung dịch màu vàng chanh là Fe2O3: \(F{e_2}{O_3} + 6HCl \to 2FeC{l_3} + 3{H_2}O\) + Mẫu thử tạo dung dịch màu xanh là CuO: \(CuO + 2HCl \to CuC{l_2} + {H_2}O\) + Mãu thử tạo dung dịch trong suốt là Al2O3: \(A{l_2}{O_3} + 6HCl \to AlC{l_3} + 3{H_2}O.\) + Còn lại là SiO2. Câu 11. Ta có: \({n_{C{O_2}}} = \dfrac{{2,8}}{{22,4}} = 0,125\left( {mol} \right)\) Gọi công thức của oxit sắt có dạng: FexOy và \({n_{F{e_x}{O_y}}} = a\left( {mol} \right)\) \( \Rightarrow {n_{CuO}} = 2a\left( {mol} \right)\) Phản ứng: \[\begin{array}{l}2F{e_x}{O_y} + yC \to 2xFe + yC{O_2} \uparrow {\rm{ }}\left( 1 \right)\\{\rm{ a}} \to {\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\; ax }}\,\,\,\,\,\,\,\,\,\,\,\,\frac{{ay}}{2}{\rm{ }}\left( {mol} \right)\\2CuO + C \to 2Cu + C{O_2} \uparrow {\rm{ }}\left( 2 \right)\\{\rm{ 2a }} \to {\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, 2a \;\;\;\;\;\; a }}\left( {mol} \right)\end{array}\] Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = \dfrac{{ay}}{2} + a = 0,125\\{m_{KL}} = 56.ax + 64.2a = 12\end{array} \right.{\rm{ }}\left( I \right)\) Từ hệ (I) \( \Rightarrow y = \dfrac{{4 + 7x}}{6}\) (x, y là số nguyên dương). Vậy nghiệm hợp lí: \(\left\{ \begin{array}{l}x = 2\\y = 3\end{array} \right.\) Suy ra công thức oxit sắt: Fe2O3. HocTot.Nam.Name.Vn
|