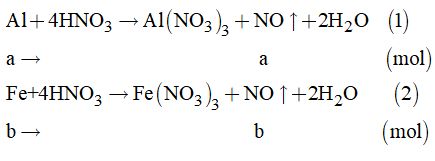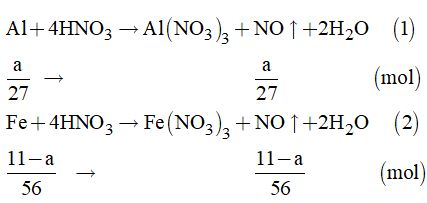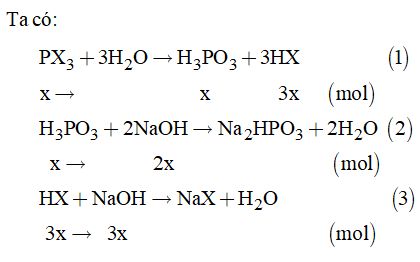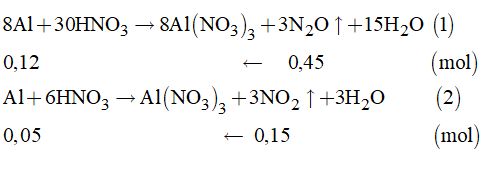Đề kiểm tra 1 tiết (45 phút) - Đề số 4 - Chương II - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 4 - Chương II - Hóa học 11. Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Nén hỗn hợp gồm 4 lít khí nitơ và 14 lít khí hiđro (ở cùng điều kiện nhiệt độ và áp suất) trong bình phản ứng ở nhiệt độ và xúc tac thích hợp. Sau phản ứng, đưa bình về nhiệt độ ban đầu thu đưọc 16,4 lít hỗn hợp khí. Thể tích khí amoniac thu được là: A.2,00 lít B.1,75 lít C.1,60 lít D.2,25 lít Câu 2. Dẫn 4 lít khí NO và 4 lít O2, sau phản ứng xảy ra hoàn toàn, thể tích khí thu được là bao nhiêu? Biết các khí đo ở cùng điều kiện nhiệt độ và áp suất. A.3 lít B.4 lít C.5 lít D. 6 lít Câu 3. Amoniac phản ứng được với nhóm các chất nào sau đây? \(\begin{array}{l}A.C{l_2},CuO,Ca{\left( {OH} \right)_2},HN{O_3},{\rm{dd FeC}}{{\rm{l}}_2}\\B.C{l_2},HN{O_3},CuO,{O_2},{\rm{dd FeC}}{{\rm{l}}_3}\\C.C{l_2},HN{O_3},KOH,{O_2},CuO\\D.CuO,Fe{\left( {OH} \right)_3},{O_2},C{l_2}\end{array}\) Câu 4. Khi dẫn khí NH3 vào bình chứa Cl2 thì phản ứng tạo ra “khói” trắng. Hợp chất tạo thành có công thức hóa học là: A. N2 B. NH3 C. NH4Cl D.HCl Câu 5. Dung dịch amoniac có thể hòa tan được Zn(OH)2 là do nguyên nhân nào sau đây? A. Do Zn(OH)2 là một bazơ ít tan B. Do Zn(OH)2 có khả năng tạo thành phức chất tan C. Do Zn(OH)2 là một bazơ lưỡng tính D. Do NH3 là một hợp chất có cực và là một bazơ yếu Câu 6. Có thể phân biệt muối amoni với các muối khác bằng cách nào cho nó tác dụng với kiềm mạnh, vì lí do nào sau đây? A. Muối amoni sẽ chuyển hóa thành màu đỏ B. Có giải phóng một chất khí không màu có mùi khai C. Có giải phóng một chất khí màu nâu đỏ D. Giải phóng một chất không màu, không mùi Câu 7. Hòa tan hoàn toàn 11,2 gam bột sắt vào dung dịch HNO3 đặc, nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là: A. 4,48 lít B. 14,40 lít C. 13,44 lít D. 6,72 lít Câu 8. Khi cân bằng: \({N_2} + 3{H_2} \to 2N{H_3}\) được thiết lập, nồng độ cácchất như sau: \(\left[ {{N_2}} \right] = 3M;\left[ {{H_2}} \right] = 9M;\left[ {N{H_3}} \right] = 1M.\) Nồng độ ban đầu của N2 là: A.3,9M B.3,7M C.3,6M D.3,5M II. PHẦN TỰ LUẬN Câu 9. Cho 11 gam hỗn hợp Al và Fe vào dung dịch HNO3 loãng dư, thu được 6,72 lít (đktc) NO bay ra. Tính phần trăm theo khôi lượng mỗi kim loại trong hỗn hợp ban đầu? Câu 10. Để trung hòa hoàn toàn dung dịch thu được khi thủy phân 4,54 gam một photpho trihalogenua cần 55 ml dung dịch NaOH 3M. Xác định công thức photpho trihalogenua đem dùng ở trên? Câu 11. Hòa tan hết x gam bột nhôm vào dung dịch HNO3 đặc, nóng thu được hỗn hợp khí gồm 1,008 lít N2O và 3,36 lít NO2 (các khí đo ở đktc ). Xác định giá trị của x. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: Ta có phương trình: N2 + 3H2 ó 2NH3 Ban đầu 4 14 Phản ứng x 3x 2x Sau pu 4-x 14-3x 2x => 4 –x + 14 – 3x + 2x = 16,4 => 18 – 2x = 16,4 => 2x = 1,6 lít => Thể tích NH3 thu được là 1,6 lít Đáp án C Câu 2: Ta có phương trình: NO + ½ O2 → NO2 Ban đầu 4 4 P ứ 4 2 4 Sau p ứ 0 2 4 => Khi sau phản ứng thu được có thể tích là: 4+ 2 = 6 lít Đáp án D Câu 3: Đáp án B Câu 4: NH3 + Cl2 → N2 + HCl NH3 + HCl → NH4Cl Đáp án C Câu 5: NH3 + Zn(OH)2 → [Zn(NH3)4](OH)2 Đáp án B Câu 6: Đáp án B Câu 7: n Fe = 11, 2 : 56 = 0,2 mol Áp dụng định luật bảo toàn electron Tổng e nhường bằng tổng e nhận => 3 . n Fe = n NO2 => 3 . 0,2 = n NO2 => n NO2 = 0,6 mol V NO2 = 0,6 . 22,4 = 13,44 lít Đáp án C Câu 8: Gọi nồng độ ban đầu của N2 là x Ta có phương trình hóa học: N2 + 3H2 ó 2NH3 Ban đầu x y Phản ứng 0,5 1,5 1 Sau pu x-0,5 y – 1,5 1 => x – 0,5 = 3 => x = 3,5M Đáp án D II. PHẦN TỰ LUẬN Câu 9. Ta có: \({n_{NO}} = \dfrac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\) Cách 1. Gọi a là số mol của Al và b là số mol của Fe
Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}27a + 56b = 11\\a + b = \dfrac{{6,72}}{{22,4}}\end{array} \right. = 0,3\) Giải hệ phương trình ta có: \(\left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\) Vậy: \(\begin{array}{l}\% {m_{Al}} = \dfrac{{0,2 \times 27}}{{11}} \times 100\% = 49,1\% \\\% {m_{Fe}} = 100\% - 49,1\% = 50,9\% \end{array}\) Cách 2. Gọi a là khối lượng của Al \( \Rightarrow {n_{Al}} = \dfrac{a}{{27}}\left( {mol} \right)\) Và khối lượng của Fe là: \(\left( {11 - a} \right)gam \Rightarrow {n_{Fe}} = \dfrac{{11 - a}}{{56}}\left( {mol} \right)\)
Theo đề bài, ta có phương trình: \(\begin{array}{l}\sum {{n_{NO}}} = \dfrac{a}{{27}} + \dfrac{{11 - a}}{{56}} = 0,3\\ \Leftrightarrow 56a + 297 - 27a = 453,6\\ \Leftrightarrow 29a = 156,6 \Rightarrow a = 5,4\end{array}\) Vậy: \(\begin{array}{l}\% {m_{Al}} = \dfrac{{5,4}}{{11}} \times 100\% = 49,1\% \\\% {m_{Fe}} = 100\% - 49,1\% = 50,9\% \end{array}\) Câu 10. Ta có: \({n_{NaOH}} = 0,055 \times 3 = 0,165\left( {mol} \right)\) Gọi X là halogen trong hợp chất.
Từ (2) và (3) \( \Rightarrow 5x = 0,165 \Rightarrow x = 0,033\left( {mol} \right)\) Mà \({n_{P{X_3}}} = \dfrac{{4,54}}{{31 + 3X}} = 0,033 \) \(\Rightarrow X = 35,5:clo\left( {Cl} \right)\) Câu 11. Ta có: \({n_{{N_2}O}} = \dfrac{{1,008}}{{22,4}} = 0,045\left( {mol} \right);\) \({n_{N{O_2}}} = \dfrac{{3,36}}{{22,4}} = 0,15\left( {mol} \right)\)
Từ (1) và (2) \( \Rightarrow \sum {{n_{Al}}} = 0,12 + 0,05 = 0,17\left( {mol} \right)\) Vậy: \({m_{Al}} = 0,17 \times 27 = 4,59\left( {gam} \right)\). HocTot.Nam.Name.Vn
|