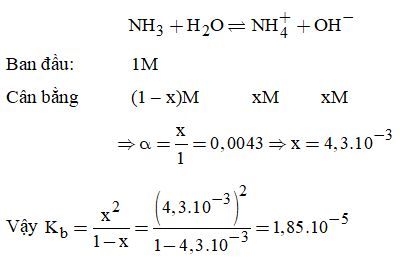Đề kiểm tra 1 tiết (45 phút) - Đề số 2 – Chương I - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 2 – Chương I - Hóa học 11. Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Cho các ion: \(NO_3^ - \left( 1 \right);SO_4^{2 - }\left( 2 \right);CO_3^{2 - }\left( 3 \right);B{r^ - }\left( 4 \right);NH_4^ + \left( 5 \right).\) Hai ion nào có số electron bằng nhau? A.(1) và (3). B.(2) và (4) C.(3) và (5) D.(2) và (5) Câu 2. Dãy chất nào sau đây chỉ gồm các chất điện li mạnh? \(\begin{array}{l}A.KN{O_3};CuS{O_4};BaC{O_3};HCl\\B.NaOH;{H_2}S{O_4};Ba{\left( {N{O_3}} \right)_2};FeC{l_3}\\C.ZnS{O_4};{K_2}C{O_3};AgCl;Ca{\left( {OH} \right)_2}\\D.{C_2}{H_5}OH;C{H_3}{\rm{COONa;}}{{\rm{H}}_2}Si{O_3};BaC{l_2}\end{array}\) Câu 3. Cho cân bằng trong dung dịch axit axetic: \(C{H_3}{\rm{COOH}} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {{\rm{H}}^ + } + C{H_3}{\rm{CO}}{{\rm{O}}^ - }\) Độ điện li của CH3COOH tăng khi: A. nhỏ vài giọt dung dịch axit như HCl, H2SO4. B. pha loãng dung dịch hoặc nhỏ vài giọt kiểm loãng. C. làm lạnh dung dịch D. thêm một lượng dung dịch axit axetic có cùng nồng độ. Câu 4. Cho các chất: \(KOH;{C_2}{H_5}OH;HCl;{C_6}{H_{10}}{O_6};FeS{O_4};{C_6}{H_6}.\) Số chất điện li và không điện li lần lượt là: A. 1 và 5 B. 2 và 4 C. 3 và 3 D. 5 và 1 Câu 5. Phát biểu nào sau đây đúng theo quan điểm của Areniut? A. Bazơ là hợp chất khi tan trong nước phân li ra ion OH-. B. Bazơ là chất có khả năng nhận proton. C. Axit là chất có khả năng cho proton. D. Bazơ là hợp chất mà trong thành phần phân tử có một hay nhiều nhóm OH. Câu 6. Trong 150ml dung dịch Ba(NO3)2 0,2M có chứa: A. 0,30 mol Ba(NO3)2 B. 0,02 mol Ba(NO3)2 C. 0,03 mol ion Ba2+ và 0,06 mol \(NO_3^ - \) D. 0,03 mol ion Ba2+ và 0,03 mol \(NO_3^ - \) Câu 7. Trong 1ml dung dịch HNO2 có 6.1019 phân tử HNO2; 3,6.1018 ion \(NO_2^ - .\) Độ điện li \(\alpha \) của dung dịch này là: A.6,00% B.4,50% C. 5,10% D.4,25% Câu 8. Biểu thức nào sau đây là sai khi nói về độ pH của dung dịch? \(\begin{array}{l}A.pH = - \lg \left[ {{H^ + }} \right]\\B.pH{\rm{ + pOH = 14}}\\{\rm{C}}{\rm{.}}\left[ {{H^ + }} \right] = {10^x} \Rightarrow pH = x\\D.\left[ {{H^ + }} \right] = {10^{ - a}} \Rightarrow pH = a.\end{array}\) II.PHẦN TỰ LUẬN Câu 9. Cho 100ml dung dịch Ba(OH)2 0,009M với 400ml dung dịch H2SO4 0,002M. Tính pH của dung dịch thu được sau khi trộn. Câu 10. Có hai dung dịch axit HNO3 40% (D = 1,25 g/ml) và HNO3 10% (D = 1,06 g/ml). Cần lấy bao nhiêu lít mỗi dung dịch để pha thành 2 lít dung dịch HNO3 15% (D = 1,08 g/ml)? Câu 11. Cho dung dịch NH3 1M có độ điện li \(\alpha = 0,43\% .\) Tính hằng số bazơ Kb của NH3. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: Xét từng ion ta có: NO3-: 7 + 8 . 3 + 1 = 32 SO42- : 16 + 8 . 4 + 2 = 50 CO32- = 6 + 8 . 3 + 2 = 32 Br- = 35 + 1 = 36 NH4+ = 7 + 4 – 1 = 10 Đáp án A Câu 2: A loại BaCO3 C loại AgCl D loại C2H5OH, H2SiO3 Đáp án B Câu 3: Theo nguyên lý chuyển dịch cân bằng để độ điện li tăng => cân bằng chuyển dịch theo chiều thuận A khi nhỏ axit vào làm tăng nồng độ H+ => Cân bằng chuyển dịch theo chiều nghịch => A sai B pha loãng, hoặc nhỏ kiềm loãng => H+ sẽ tương tác với OH- => Làm giảm nồng độ H+ => Cân bằng chuyển dịch theo chiều thuận => B đúng C làm lạnh dung dịch => Làm giảm độ điện li => C sai D thêm một lượng dung dịch CH3COOH có cùng nồng độ => Không làm thay đổi độ điện li Đáp án B Câu 4: Các chất điện li là: KOH, HCl, FeSO4 Các chất không điện li là: C2H5OH, C6H10O6, C6H6 Đáp án C Câu 5: Theo quan điểm Areniut, bazo là chất khi tan trong nước phân li ra ion OH- Đáp án A Câu 6: Ta có phương trình điện li: Ba(NO3)2 → Ba2+ + 2 NO3- n Ba(NO3)2 = 0,2 . 0,15 = 0,03 mol Từ phương trình ta có: n Ba2+ = n Ba(NO3)2 = 0,03 mol n NO3- = 0,03 . 2 = 0,06 mol Đáp án C Câu 7: Độ điện ly = n chất điện li/ n chất hòa tan => α = 3,6 . 1018 : (6 . 1019) . 100% = 6% Đáp án A Câu 8: Đáp án C II. PHẦN TỰ LUẬN Câu 9. Ta có: \(\begin{array}{l}{n_{Ba{{\left( {OH} \right)}_2}}} = \dfrac{{0,009 \times 100}}{{1000}} = 0,0009\left( {mol} \right)\\{n_{{H_2}S{O_4}}} = \dfrac{{400 \times 0,002}}{{1000}} = 0,0008\left( {mol} \right)\end{array}\) Phản ứng: \(\begin{array}{l}Ba{\left( {OH} \right)_2} + {H_2}S{O_4} \to BaS{O_4} \downarrow + 2{H_2}O\\0,0008 \leftarrow {\rm{ 0,0008 }}\left( {mol} \right)\end{array}\) Từ (1) \( \Rightarrow {n_{Ba{{\left( {OH} \right)}_2}}}\)dư = 0,0009 – 0,0008 = 0,0001 (mol) \(\begin{array}{l} \Rightarrow \left[ {O{H^ - }} \right] = \dfrac{{2 \times 0,0001}}{{0,5}} = {4.10^{ - 4}}\\ \Rightarrow \left[ {{H^ + }} \right] = \dfrac{{{{10}^{ - 14}}}}{{{{4.10}^{ - 4}}}} = 2,{5.10^{ - 10}} \\ \Rightarrow pH = 10,6\end{array}\) Câu 10. Cách 1. Sử dụng quy tắc đường chéo: \( \Rightarrow \dfrac{{KL{\rm{ dd 40\% }}}}{{KL{\rm{ dd 10\% }}}} = \dfrac{{5\% }}{{25\% }} = \dfrac{1}{5}\) Khối lượng dung dịch sau khi trộn: \({m_{{\rm{dd}}}} = V \times D = 2000 \times 1,08 = 2160\) \(\left( {gam} \right)\) Vậy khối lượng dung dịch HNO3 40% là: \(\dfrac{{2160 \times 1}}{{\left( {5 + 1} \right)}} = 360\left( {gam} \right)\) \(\begin{array}{l}{V_{HN{O_3}\,40\% }} = \dfrac{{360}}{{1,25}} = 288\left( {ml} \right)\\{V_{HN{O\,{30\% }}}} = \dfrac{{1800}}{{1,06}} = 1698\left( {ml} \right)\end{array}\) Cách 2: Phương pháp đại số: Gọi x và y là khối lượng dung dịch HNO3 40% và HNO3 10% Khối lượng dung dịch HNO3 thu được sau phản ứng là: \(\begin{array}{l}{m_{{\rm{dd}}}} = x + y = V \times D \\ \;\;\;\;\;\;\;= 2000 \times 1,08 = 2160\left( {gam} \right)(1)\\ \Rightarrow {m_{HN{O_3}}} = \dfrac{{15 \times 2160}}{{100}} = 324(gam)\end{array}\) Trong x gam dung dịch có: \(\dfrac{{40x}}{{100}} = 0,4x(gam){\rm{ HN}}{{\rm{O}}_3}(gam)\) Trong y gam dung dịch có: \(\dfrac{{10x}}{{100}} = 0,1x(gam){\rm{ HN}}{{\rm{O}}_3}{\rm{ 10\% }}\) \( \Rightarrow 0,4x + 0,1y = 324{\rm{ }}\left( 2 \right)\) Giải (1) và (2) \( \Rightarrow x = 360;y = 1800\) \(\begin{array}{l}{V_{HN{O_3}40\% }} = \dfrac{{360}}{{1,25}} = 288(ml)\\{V_{HN{O_3}10\% }} = \dfrac{{1800}}{{1,06}} = 1698(ml)\end{array}\) Câu 11.
HocTot.Nam.Name.Vn
|