Đề khảo sát chất lượng đầu năm Hóa 12 - Đề số 3Đề bài
Câu 1 :
Hợp chất thơm X có CTPT C7H8O. X có thể tác dụng với Na và NaOH. Số đồng phân X thỏa mãn là:
Câu 2 :
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O X,Y có thể là
Câu 3 :
Chất nào sau đây ở thể khí ở nhiệt độ thường ?
Câu 4 :
Khi cho axetilen vào dung dịch AgNO3 trong NH3 dư, hiện tượng quan sát được là
Câu 5 :
Cho etin phản ứng với dung dịch brom dư thu được sản phẩm là
Câu 6 :
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
Câu 7 :
Chất nào trong các chất sau đây không phải là chất lưỡng tính
Câu 8 :
Cho N (Z = 7). Cấu hình electron của Nitơ là?
Câu 9 :
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Câu 10 :
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
Câu 11 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Câu 12 :
Hợp chất hữu cơ X có công thức phân tử dạng CnH2n+2. X thuộc dãy đồng đẳng của
Câu 13 :
Để nhận biết các mẫu chất rắn khan NH4NO3, Na3PO4, KCl người ta dùng dung dịch :
Câu 14 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Câu 15 :
Cách nào sau đây dùng để điều chế etyl axetat ?
Câu 16 :
Ancol no, mạch hở, đơn chức có công thức tổng quát là
Câu 17 :
Theo A-rê-ni-ut, chất nào sau đây là axit ?
Câu 18 :
Chất X có CTCT như hình bên. X có tên gọi 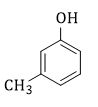
Câu 19 :
Đánh giá độ dinh dưỡng của phân lân bằng hàm lượng %
Câu 20 :
Đime hóa axetilen trong điều kiện thích hợp thu được chất nào sau đây ?
Câu 21 :
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Câu 22 :
Khi tách nước từ một chất X có công thức phân tử C4H10O tạo thành 3 anken là đồng phân của nhau (tính cả đồng phân hình học). Công thức cấu tạo thu gọn của X là :
Câu 23 :
Có bao nhiêu đồng phân C4H10O khi tác dụng với CuO nung nóng sinh ra anđehit?
Câu 24 :
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
Câu 25 :
Từ 1 lít hỗn hợp CO và CO2 có thể điều chế tối đa bao nhiêu lít CO2? (H = 100%)
Câu 26 :
Thành phần chính của khí than ướt là
Câu 27 :
Axit panmitic là axit nào sau đây ?
Câu 28 :
Đốt cháy hoàn toàn một lượng ancol A thu được số mol nước gấp đôi số mol CO2. Tên gọi của A là
Câu 29 :
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M (α = 4,25%) lần lượt là
Câu 30 :
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
Câu 31 :
Dung dịch Y chứa 0,02 mol Mg2+; 0,03 mol Na+; 0,03 mol Cl- và y mol SO42-. Giá trị của y là
Câu 32 :
Cho 0,001 mol NH4Cl vào 100 ml dung dịch NaOH có pH = 12 và đun sôi, sau đó làm nguội, thêm vào một ít phenolphtalein, dung dịch thu được có màu
Câu 33 :
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
Câu 34 :
Phân bón nào dưới đây có hàm lượng N cao nhất?
Câu 35 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau: 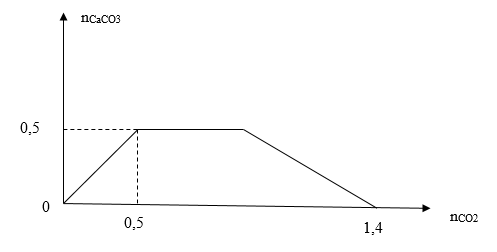 Tỉ lệ a: b là
Câu 36 :
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
Câu 37 :
Đề hiđro hoá etylbenzen ta được stiren; trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
Câu 38 :
Chất hữu cơ A trong phân tử chứa 1 nguyên tử Oxi, có M = 46. Đốt cháy A chỉ thu được CO2 và H2O. Có bao nhiêu CTCT phù hợp với A
Câu 39 :
Gọi m là số nhóm chức của ancol A. Cho 1 mol ancol A tác dụng với Na dư thì thể tích khí H2 sinh ra (ở đktc) là
Câu 40 :
Oxi hoá 0,1 mol ancol etylic thu được m gam hỗn hợp Y gồm axetanđehit, nước và ancol etylic dư. Cho Na dư vào m gam hỗn hợp Y sinh ra V lít hiđro (đktc). Phát biểu đúng là
Câu 41 :
Cho 15,8 gam hỗn hợp gồm CH3OH, C6H5OH tác dụng với dung dịch brom dư, thì làm mất màu vừa hết 48 gam Br2. Nếu đốt cháy hoàn toàn hỗn hợp trên thì thể tích CO2 thu được ở điều kiện tiêu chuẩn là
Câu 42 :
Fomalin hay fomon (dùng để bảo quản xác động vật chống thối rữa) là
Câu 43 :
Cho 0,2 mol một anđehit đơn chức, mạch hở X phản ứng vừa đủ với 300 ml dung dịch chứa AgNO3 2M trong NH3. Sau khi phản ứng xảy ra hoàn toàn thu được 87,2 gam kết tủa. Công thức phân tử của anđehit là:
Câu 44 :
Cho 0,04 mol một hỗn hợp X gồm CH2=CH-COOH, CH3COOH và CH2=CH-CHO phản ứng vừa đủ với dung dịch chứa 6,4 gam brom. Mặt khác, để trung hoà 0,04 mol X cần dùng vừa đủ 40 ml dung dịch NaOH 0,75 M. Khối lượng của CH2=CH-COOH trong X là
Câu 45 :
Trong phân tử axit cacboxylic X có số nguyên tử cacbon bằng số nhóm chức. Đốt cháy hoàn toàn một lượng X thu được số mol CO2 bằng số mol H2O. Tên gọi của X là
Câu 46 :
Đốt cháy hết a mol axit X được 2a mol CO2. Để trung hoà vừa hết a mol X cần 2a mol NaOH. Tìm X
Câu 47 :
Hấp thụ hoàn toàn V lít CO2 vào dung dịch Ca(OH)2, thu được 25 gam kết tủa và dung dịch X. Thêm tối thiểu 200 ml dung dịch NaOH 1M vào X, thì được lượng kết tủa lớn nhất. Tính V
Câu 48 :
X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHC-C≡C-COOH; Y là axit cacboxylic no, đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3 trong NH3, thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2, thu được 0,785 mol CO2. Giá trị của m là
Câu 49 :
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
Câu 50 :
Nhiệt phân hoàn toàn hỗn hợp BaCO3, MgCO3, Al2O3 được rắn X và khí Y. Hoà tan rắn X vào nước thu được kết tủa E và dung dịch Z. Sục khí Y dư vào dung dịch Z thấy xuất hiện kết tủa F, hoà tan E vào dung dịch NaOH dư thấy tan một phần được dung dịch G. Các chất trong dung dịch G và kết tủa F là
Lời giải và đáp án
Câu 1 :
Hợp chất thơm X có CTPT C7H8O. X có thể tác dụng với Na và NaOH. Số đồng phân X thỏa mãn là:
Đáp án : A Lời giải chi tiết :
X có thể tác dụng với Na và NaOH nên X là phenol. Vậy X có 3 đồng phân là: 2-metylphenol; 3-metylphenol; 4-metylphenol
Câu 2 :
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O X,Y có thể là
Đáp án : B Lời giải chi tiết :
A. không có phản ứng B. Ba(OH)2 + Ca(HCO3)2 → CaCO3 + BaCO3 +2 H2O C. \(Ba{(OH)_2} + C{O_2} \to BaC{{\text{O}}_3} + {H_2}O\) Hoặc \(Ba{(OH)_2} + C{O_2} \to Ba{(HC{O_3})_2}\) D. không có phản ứng
Câu 3 :
Chất nào sau đây ở thể khí ở nhiệt độ thường ?
Đáp án : B Lời giải chi tiết :
- Ở điều kiện thường, các axit cacboxylic đều là những chất lỏng hoặc rắn. - HCHO là những chất khí tan tốt trong nước - CH3OH và C2H5HO là những chất lỏng
Câu 4 :
Khi cho axetilen vào dung dịch AgNO3 trong NH3 dư, hiện tượng quan sát được là
Đáp án : D Lời giải chi tiết :
Cho axetilen vào dung dịch AgNO3 : CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg ↓vàng nhạt + 2NH4NO3 => phản ứng tạo kết tủa vàng nhạt
Câu 5 :
Cho etin phản ứng với dung dịch brom dư thu được sản phẩm là
Đáp án : B Lời giải chi tiết :
CH≡CH + 2Br2 → CHBr2 – CHBr2
Câu 6 :
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
Đáp án : C Lời giải chi tiết :
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là: N2 < O2 < F2.
Câu 7 :
Chất nào trong các chất sau đây không phải là chất lưỡng tính
Đáp án : D Lời giải chi tiết :
Chất không phải là chất có tính lưỡng tính là Al vì Al tác dụng với NaOH và HCl thay đổi số oxi hóa nên không coi là phản ứng axit – bazơ.
Câu 8 :
Cho N (Z = 7). Cấu hình electron của Nitơ là?
Đáp án : C Lời giải chi tiết :
Nito có cấu hình e là: 1s22s22p3
Câu 9 :
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Đáp án : C Phương pháp giải :
Do Fe dư nên tạo thành muối Fe2+ Sử dụng định luật bảo toàn e: 2nFe = 3nNO => nNO = ? Lời giải chi tiết :
Do Fe dư nên tạo thành muối Fe2+ nFe = (20 – 3,2)/56 = 0,3 mol BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol => V = 4,48 lít
Câu 10 :
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
Đáp án : B Phương pháp giải :
Từ số mol của Ba(OH)2 và NaOH \( \to {n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}}\) \( \to {\text{[}}O{H^ - }{\text{] = }}\dfrac{{{n_{O{H^ - }}}}}{{0,3}}\) Mà [OH-].[H+] = 10-14 \( \to [{H^ + }] \to pH\) Lời giải chi tiết :
\({n_{Ba{{(OH)}_2}}} = 0,1.0,1 = 0,01\,\,mol;{n_{NaOH}} = 0,2.0,05 = 0,01\,\,mol\) \( \to {n_{OH - }} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}} = 2.0,01 + 0,01 = 0,03\,\,mol\) \( \to [O{H^ - }] = \dfrac{{0,03}}{{0,3}} = 0,1\,\,M\) Mà [OH-].[H+] = 10-14 \( \to [{H^ + }] = \dfrac{{{{10}^{ - 14}}}}{{0,1}} = {10^{ - 13}}\) \( \to pH = - \log {10^{ - 13}} = 13\)
Câu 11 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Đáp án : D Phương pháp giải :
Tính theo PTHH: NaOH + HCl → NaCl + H2O Lời giải chi tiết :
nHCl = 3.0,01 = 0,03 mol PTHH: NaOH + HCl → NaCl + H2O nNaOH = nHCl = 0,03 mol => V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Câu 12 :
Hợp chất hữu cơ X có công thức phân tử dạng CnH2n+2. X thuộc dãy đồng đẳng của
Đáp án : B Lời giải chi tiết :
X thuộc dãy đồng đẳng của ankan.
Câu 13 :
Để nhận biết các mẫu chất rắn khan NH4NO3, Na3PO4, KCl người ta dùng dung dịch :
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phân bón hóa học Lời giải chi tiết :
ta dùng dung dịch Ba(OH)2
Câu 14 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Đáp án : B Lời giải chi tiết :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Câu 15 :
Cách nào sau đây dùng để điều chế etyl axetat ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết phản ứng este hóa Lời giải chi tiết :
Cách dùng để điều chế etyl axetat là đun hồi lưu hỗn hợp etanol, axit axetic và axit sunfuric đặc. Không dùng giấm và rượu trắng vì độ tinh khiết không cao => hiệu suất thấp
Câu 16 :
Ancol no, mạch hở, đơn chức có công thức tổng quát là
Đáp án : C Lời giải chi tiết :
Ancol no, mạch hở, đơn chức có công thức tổng quát là CnH2n+2O (n ≥ 1)
Câu 17 :
Theo A-rê-ni-ut, chất nào sau đây là axit ?
Đáp án : B Lời giải chi tiết :
Theo A-rê-ni-ut, axit là chất phân li ra H+ => HCl là axit
Câu 18 :
Chất X có CTCT như hình bên. X có tên gọi 
Đáp án : D Lời giải chi tiết :
Đánh số từ nhóm OH => tên gọi: 3-metylphenol
Câu 19 :
Đánh giá độ dinh dưỡng của phân lân bằng hàm lượng %
Đáp án : A Phương pháp giải :
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5. Ngoài ra, HS ghi nhớ thêm: Độ dinh dưỡng của phân đạm được đánh giá bằng hàm lượng % của N. Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % của K2O. Lời giải chi tiết :
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5.
Câu 20 :
Đime hóa axetilen trong điều kiện thích hợp thu được chất nào sau đây ?
Đáp án : C Lời giải chi tiết :
Phản ứng đime hóa: 2CH≡CH $\xrightarrow{xt,{{t}^{o}}}$ CH2=CH–C≡CH => thu được vinylaxetilen
Câu 21 :
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Đáp án : A Phương pháp giải :
HNO3 thể hiện tính oxi hóa khi phản ứng với các chất khử (chất có khả năng tăng số oxi hóa) Lời giải chi tiết :
A đúng B loại CuO, CaCO3 C loại CaO D loại Fe2O3
Câu 22 :
Khi tách nước từ một chất X có công thức phân tử C4H10O tạo thành 3 anken là đồng phân của nhau (tính cả đồng phân hình học). Công thức cấu tạo thu gọn của X là :
Đáp án : A Lời giải chi tiết :
Loại dần đáp án không phù hợp; Loại B và C vì B, C không bị tách nước Loại D do D chỉ có một hướng tách nên không thể tạo ra 3 anken A đúng vì CH3CH(OH)CH2CH3 có 2 hướng tách và tạo đồng phân hình học
Câu 23 :
Có bao nhiêu đồng phân C4H10O khi tác dụng với CuO nung nóng sinh ra anđehit?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết phản ứng oxi hóa không hoàn toàn Lời giải chi tiết :
Ancol bậc 1 tác dụng với CuO nung nóng sinh ra anđehit CH3-CH2-CH2-CH2OH CH3-CH(CH3)-CH2OH Có 2 đồng phân
Câu 24 :
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
Đáp án : D Phương pháp giải :
Khí X không màu là NO, khí mùi khai là NH3. Từ sản phẩm thu được suy ngược lại thành phần của X Lời giải chi tiết :
Cu và H2SO4 tác dụng với chất X có khí không màu, hóa nâu trong không khí là NO => Trong X có nhóm NO3- Khi X tác dụng với dd NaOH → khí mùi khai → khí đó là NH3 Vậy công thức của X là NH4NO3: amoni nitrat PTHH: Cu + 4H2SO4 + 8NH4NO3 → 4(NH4)2SO4 + 3Cu(NO3)2 + 4H2O + 2NO↑ NaOH + NH4NO3 → NaNO3 + NH3↑(mùi khai) + H2O
Câu 25 :
Từ 1 lít hỗn hợp CO và CO2 có thể điều chế tối đa bao nhiêu lít CO2? (H = 100%)
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố C. Lời giải chi tiết :
Bảo toàn nguyên tố C ta có: nCO2 thu được = nCO + nCO2 bđ Hay V CO2 thu được = VCO + VCO2 bđ = 1 lít
Câu 26 :
Thành phần chính của khí than ướt là
Đáp án : A Lời giải chi tiết :
Thành phần chính của khí than ướt là CO, CO2, H2, N2
Câu 27 :
Axit panmitic là axit nào sau đây ?
Đáp án : A Lời giải chi tiết :
Axit panmitic có CTPT là C15H31COOH.
Câu 28 :
Đốt cháy hoàn toàn một lượng ancol A thu được số mol nước gấp đôi số mol CO2. Tên gọi của A là
Đáp án : B Phương pháp giải :
Nếu đốt cháy ancol cho nH2O > 1,5.nCO2 thì ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin) Lời giải chi tiết :
nH2O > 1,5.nCO2 => ancol đốt cháy là CH3OH
Câu 29 :
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M (α = 4,25%) lần lượt là
Đáp án : A Phương pháp giải :
áp dụng công thức: pH = -log[H+] và độ điện li α = Cphân li / Cban đầu Lời giải chi tiết :
${H_2}S{O_4}{\text{ }}\xrightarrow{{}}{\text{ }}2{H^ + }{\text{ }} + {\text{ }}S{O_4}^{2 - }$ $0,0005{\text{ }}M{\text{ }}\xrightarrow{{}}{\text{ 0,001 M = > pH = - log[ }}{{\text{H}}^ + }] = 3$ $C{H_3}COOH{\text{ }}\underset {} \leftrightarrows {\text{ }}C{H_3}CO{O^ - }{\text{ }} + {\text{ }}{H^ + }$ Ban đầu (CM) 0,1 0 0 Phân li (CM) x x x $ = > {\text{ độ điện li }} = \dfrac{{{{[C{H_3}COOH]}_{P{\text{hân li}}}}}}{{[C{H_3}COOH]{\text{ban đầu}}}}.100\% = > \dfrac{x}{{0,1}}.100\% = 4,25\% $ $= > x = 4,{25.10^{ - 3}}M = [{H^ + }]$ $= > pH = - \log ([{H^ + }]) = 2,37$
Câu 30 :
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
Đáp án : D Phương pháp giải :
+) Áp dụng định luật bảo toàn điện tích có PT(1) +) Áp dụng định luật bảo toàn khối lượng ta có: mmuối = ${\text{ }}\sum {{m_{ion}}} $ => PT (2) Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích ta có: 0,01.2 + 0,03.1 = x.1 + y.3 (1) Áp dụng định luật bảo toàn khối lượng ta có: mmuối = ${\text{ }}\sum {{m_{ion}}} {\text{ = > 2,59 = 0,01}}{\text{.24 + 0,03}}{\text{.23 + x}}{\text{.35,5 + y}}{\text{.95 (2)}}$ - Giải hệ hai phương trình (1) và (2) ta được: x = 0,02; y = 0,01
Câu 31 :
Dung dịch Y chứa 0,02 mol Mg2+; 0,03 mol Na+; 0,03 mol Cl- và y mol SO42-. Giá trị của y là
Đáp án : B Phương pháp giải :
Áp dụng định luật bảo toàn điện tích cho dung dịch Y. Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích cho dung dịch Y ta có: \(2{n_{M{g^{2 + }}}} + {n_{N{a^ + }}} = {n_{C{l^ - }}} + 2{n_{SO_4^{2 - }}}\) => 2.0,02 + 0,03 = 0,03 + 2.y => y = 0,02
Câu 32 :
Cho 0,001 mol NH4Cl vào 100 ml dung dịch NaOH có pH = 12 và đun sôi, sau đó làm nguội, thêm vào một ít phenolphtalein, dung dịch thu được có màu
Đáp án : D Phương pháp giải :
Tính toán theo PTHH: NH4Cl + NaOH → NaCl + NH3 + H2O + Dung dịch sau phản ứng có môi trường kiềm thì phenolphtalein chuyển màu hồng + Dung dịch sau phản ứng có môi trường axit hoặc trung tính thì phenolphtalein không đổi màu Lời giải chi tiết :
pOH = 14 – pH = 2 => CM NaOH = (OH-) = 0,01M nNaOH = 0,1.0,01 = 0,001 mol PTHH: NH4Cl + NaOH → NaCl + NH3 + H2O Pư: 0,001 0,001 Do phản ứng vừa đủ nên sau khi đun sôi thì NH3 bay hơi hết, dung dịch thu được chỉ còn lại NaCl có môi trường trung tính nên không làm đổi màu dung dịch phenolphtalein
Câu 33 :
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
Đáp án : D Phương pháp giải :
Trong phòng thí nghiệm người ta điều chế N2 bằng phản ứng: NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O - Tính toán theo PTHH. Lời giải chi tiết :
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol => mNaNO2 = 0,3.69 = 20,7 gam
Câu 34 :
Phân bón nào dưới đây có hàm lượng N cao nhất?
Đáp án : D Lời giải chi tiết :
Ure (NH2)2CO là phân bón có thành phần N lớn nhất.
Câu 35 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:  Tỉ lệ a: b là
Đáp án : A Phương pháp giải :
Chia đồ thị ra làm 3 giai đoạn: + giai đoạn 1: đồ thị đi lên xảy ra phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O + giai đoạn 2: đồ thị đi ngang do xảy ra phản ứng CO2 + 2NaOH → Na2CO3 + H2O CO2 + Na2CO3 + H2O → 2NaHCO3 + giai đoạn 3: đồ thị đi xuống do xảy ra phản ứng CO2 + CaCO3 + H2O → Ca(HCO3)2 Lời giải chi tiết :
+ Tại giai đoạn 1: đồ thị đi lên do xảy ra phản ứng: CO2 + Ca(OH)2 → CaCO3↓ + H2O → nCaCO3 max = 0,5 (mol). BTNT "Ca": nCa(OH)2 bđ = 0,5 (mol) = a + Tại giai đoạn 3: đồ thị đi xuống khi hòa tan hoàn toàn kết tủa → Muối thu được gồm: NaHCO3 và Ca(HCO3)2 BTNT "Ca": nCa(HCO3)2 = nCa(OH)2 = 0,5 (mol) BTNT "C": nCO2 = nNaHCO3 + 2nCa(HCO3)2 → 1,4 = b + 2.0,5 → b = 0,4 (mol) Vậy a : b = 0,5 : 0,4 = 5 : 4
Câu 36 :
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + m Lời giải chi tiết :
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + m => 0,06.26 + 0,04.2 = m + 0,02.0,5.32 => m = 1,32 gam
Câu 37 :
Đề hiđro hoá etylbenzen ta được stiren; trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
Đáp án : C Phương pháp giải :
$n{C_6}{H_5}C{H_2}C{H_3}\xrightarrow{{ - {H_2},{t^o},xt}}n{C_6}{H_5}CH = C{H_2}\;\xrightarrow{{{t^o},\,p,\,xt}}{\rlap{-} (CH({C_6}{H_5})-C{H_2}\rlap{-} )_n}$ gam: 106n → 104n tấn: x.80% → 10,4 Lời giải chi tiết :
Sơ đồ phản ứng: $n{C_6}{H_5}C{H_2}C{H_3}\xrightarrow{{-{H_2},\,{t^o},\,xt}}n{C_6}{H_5}CH = C{H_2}\;\xrightarrow{{{t^o},\,p,\,xt}}{\rlap{-} (\,CH({C_6}{H_5})-C{H_2}\rlap{-} )_n}$ gam: 106n → 104n tấn: x.80% → 10,4 Vậy khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polistiren với hiệu suất 80% là : x = $\frac{{10,4.106n}}{{104n.80\% }} = 13,25$ tấn
Câu 38 :
Chất hữu cơ A trong phân tử chứa 1 nguyên tử Oxi, có M = 46. Đốt cháy A chỉ thu được CO2 và H2O. Có bao nhiêu CTCT phù hợp với A
Đáp án : A Lời giải chi tiết :
Đốt cháy A chỉ thu được CO2 và H2O => trong A chứa C, H và có thể có O Gọi CTPT của A là CxHyOz => 12x + y + 16z = 46 Nếu z = 0 không có cặp x và y thỏa mãn Nếu z = 1 => x = 2, y = 6 thoản mãn => CTPT: C2H6O => có 2 CTCT: CH3-CH2OH và CH3-O-CH3
Câu 39 :
Gọi m là số nhóm chức của ancol A. Cho 1 mol ancol A tác dụng với Na dư thì thể tích khí H2 sinh ra (ở đktc) là
Đáp án : A Phương pháp giải :
Gọi ancol A có dạng R(OH)m 2R(OH)m + 2Na → 2R(ONa)m + mH2 Lời giải chi tiết :
Gọi ancol A có dạng R(OH)m 2R(OH)m + 2Na → 2R(ONa)m + mH2 1 mol → 0,5m mol => VH2 = 22,4.0,5m = 11,2m lít
Câu 40 :
Oxi hoá 0,1 mol ancol etylic thu được m gam hỗn hợp Y gồm axetanđehit, nước và ancol etylic dư. Cho Na dư vào m gam hỗn hợp Y sinh ra V lít hiđro (đktc). Phát biểu đúng là
Đáp án : B Phương pháp giải :
+) nancol bđ = 2nH2 Lời giải chi tiết :
Ta có: nancol bđ = 2nH2=> nH= $\frac{{0,1}}{2}$ = 0,05 mol Vậy V = 0,05. 22,4 = 1,12 lít
Câu 41 :
Cho 15,8 gam hỗn hợp gồm CH3OH, C6H5OH tác dụng với dung dịch brom dư, thì làm mất màu vừa hết 48 gam Br2. Nếu đốt cháy hoàn toàn hỗn hợp trên thì thể tích CO2 thu được ở điều kiện tiêu chuẩn là
Đáp án : D Phương pháp giải :
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr Từ số mol Br2 tính số mol C6H5OH => số mol CH3OH +) Bảo toàn nguyên tố C: ${n_{C{O_2}}} = {n_{C{H_3}OH}} + \,6.{n_{{C_6}{H_5}OH}}$ Lời giải chi tiết :
${n_{B{r_2}}} = \,\frac{{48}}{{160}}\, = 0,3\,mol$ C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr 0,1 mol ← 0,3 mol → ${m_{{C_6}{H_5}OH}} = \,0,1.94 = 9,4\,gam$→ ${m_{C{H_3}OH}} = \,15,8 - 9,4 = 6,4\,gam$ → ${n_{C{H_3}OH}} = \frac{{6,4}}{{32}} = 0,2\,mol$ Bảo toàn nguyên tố C: → ${n_{C{O_2}}} = {n_{C{H_3}OH}} + \,6.{n_{{C_6}{H_5}OH}} = 0,2 + 6.0,1 = 0,8\,mol$ → ${V_{C{O_2}(\,ktc)}} = 0,8.22,4 = 17,92\,$ lít
Câu 42 :
Fomalin hay fomon (dùng để bảo quản xác động vật chống thối rữa) là
Đáp án : A Lời giải chi tiết :
Dung dịch nước của anđehit fomic được gọi là fomon. Dung dịch bão hòa của anđehit fomic (có nồng độ 37-40%) được gọi là fomlin.
Câu 43 :
Cho 0,2 mol một anđehit đơn chức, mạch hở X phản ứng vừa đủ với 300 ml dung dịch chứa AgNO3 2M trong NH3. Sau khi phản ứng xảy ra hoàn toàn thu được 87,2 gam kết tủa. Công thức phân tử của anđehit là:
Đáp án : D Phương pháp giải :
+) nAgNO3 = 3nX => X phải chứa liên kết ba C≡C– ở đầu mạch và có 1 nhóm CHO Đặt CT của X là CH≡C–R–CHO +) Lượng kết tủa bao gồm \(\left\{ \begin{array}{l}0,02{\rm{ }}mol{\rm{ }}AgC \equiv C-R-COON{H_4}\\0,04{\rm{ }}mol{\rm{ }}Ag\end{array} \right.\) +) mkết tủa = 0,02.(194 + R) + 0,04.108 Lời giải chi tiết :
Có nAgNO3 = 0,6 mol = 3nX Mà X đơn chức => X phải chứa liên kết ba C≡C– ở đầu mạch và có 1 nhóm CHO Đặt CT của X là CH≡C–R–CHO => Lượng kết tủa bao gồm \(\left\{ \begin{array}{l}0,2{\rm{ }}mol{\rm{ }}AgC \equiv C-R-COON{H_4}\\0,4{\rm{ }}mol{\rm{ }}Ag\end{array} \right.\) => mkết tủa = 0,2.(194 + R) + 0,4.108 = 87,2 gam => R = 26 (C2H2) => X là C4H3CHO
Câu 44 :
Cho 0,04 mol một hỗn hợp X gồm CH2=CH-COOH, CH3COOH và CH2=CH-CHO phản ứng vừa đủ với dung dịch chứa 6,4 gam brom. Mặt khác, để trung hoà 0,04 mol X cần dùng vừa đủ 40 ml dung dịch NaOH 0,75 M. Khối lượng của CH2=CH-COOH trong X là
Đáp án : B Phương pháp giải :
+) X phản ứng vừa đủ với 0,04 mol Br2 => nBr2 = nCH2=CH-COOH + 2.nCH2=CH-CHO +) nNaOH = nCH2=CH-COOH + nCH3COOH Lời giải chi tiết :
Gọi n CH2=CH-COOH = x mol; n CH3COOH = y mol và n CH2=CH-CHO = z mol => x + y + z = 0,04 (1) X phản ứng vừa đủ với 0,04 mol Br2 => nBr2 = nCH2=CH-COOH + 2.nCH2=CH-CHO => x + 2z = 0,04 (2) nNaOH = nCH2=CH-COOH + nCH3COOH => x + y = 0,03 mol (3) Từ (1), (2) và (3) => x = 0,02; y = 0,01; z = 0,01 => m CH2=CH-COOH = 0,02.72 = 1,44 gam
Câu 45 :
Trong phân tử axit cacboxylic X có số nguyên tử cacbon bằng số nhóm chức. Đốt cháy hoàn toàn một lượng X thu được số mol CO2 bằng số mol H2O. Tên gọi của X là
Đáp án : D Phương pháp giải :
+) nCO2 = nH2O => X có dạng CnH2nOz Số nguyên tử C = số nhóm chức => số O trong X gấp đôi số C => X có dạng: CnH2nO2n Lời giải chi tiết :
Vì đốt cháy X thu được nCO2 = nH2O => X có dạng CnH2nOz Số nguyên tử C = số nhóm chức => số O trong X gấp đôi số C => X có dạng: CnH2nO2n Với n = 1 => X là CH2O2 > X là axit fomic: HCOOH Với n =2 => X là C2H4O4 (không thỏa mãn)
Câu 46 :
Đốt cháy hết a mol axit X được 2a mol CO2. Để trung hoà vừa hết a mol X cần 2a mol NaOH. Tìm X
Đáp án : D Phương pháp giải :
+) nCO2 / nX = 2 X tác dụng với NaOH theo tỉ lệ 1 : 2 => X chứa 2 nhóm –COOH Lời giải chi tiết :
nCO2 / nX = 2 => X chứa 2 C X tác dụng với NaOH theo tỉ lệ 1 : 2 => X chứa 2 nhóm –COOH => X là HOOC-COOH
Câu 47 :
Hấp thụ hoàn toàn V lít CO2 vào dung dịch Ca(OH)2, thu được 25 gam kết tủa và dung dịch X. Thêm tối thiểu 200 ml dung dịch NaOH 1M vào X, thì được lượng kết tủa lớn nhất. Tính V
Đáp án : B Phương pháp giải :
+) Chú ý lượng NaOH tối thiểu => sinh ra muối NaHCO3, nếu lượng NaOH tối đa sinh ra muối Na2CO3 +) Bảo toàn C => nCO2 = 2nCa(HCO3)2 + nCaCO3 Lời giải chi tiết :
Chú ý lượng NaOH tối thiểu => sinh ra muối NaHCO3, nếu lượng NaOH tối đa sinh ra muối Na2CO3 Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O 0,2 ← 0,2 nCaCO3 = 0,25mol Bảo toàn C => nCO2 = 2nCa(HCO3)2 + nCaCO3 = 0,2 . 2 + 0,25 = 0,65mol => V = 14,56 lít
Câu 48 :
X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHC-C≡C-COOH; Y là axit cacboxylic no, đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3 trong NH3, thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2, thu được 0,785 mol CO2. Giá trị của m là
Đáp án : A Phương pháp giải :
+) Gọi số mol 4 chất trong X lần lượt là : a, b, c, d +) nCHO = 0,22 = 2b + 4c + 2d => b + 2c + d = 0,11 +) nCO2 = nCOOH = 2a + b + d = 0,07 +) a + b + c + d = 0,09 mol = nX = 2nH Khi đốt cháy do Y no đơn hở => nCO2 = nH2O = y mol Bảo toàn khối lượng cho phản ứng cháy : 2.(12x + 0,18 + 0,25.16) + 0,805.32 = 0,785.44 + 18.(0,09 + y) Lời giải chi tiết :
Gọi số mol C trong X là x và số mol C trong Y là y Ta có : nCO2 = x + y = 0,785 mol Gọi số mol 4 chất trong X lần lượt là : a, b, c, d nAg = 0,22 mol => nCHO = 0,22. = 2b + 4c + 2d => b + 2c + d = 0,11 Lại có : nCO2 = nCOOH = 2a + b + d = 0,07 => a + b + c + d = 0,09 mol = nX = 2nH => Trong X có : x mol C ; 0,18 mol H ; 0,25 mol O Khi đốt cháy do Y no đơn hở => nCO2 = nH2O = y mol Bảo toàn khối lượng cho phản ứng cháy : 2.(12x + 0,18 + 0,25.16) + 0,805.32 = 0,785.44 + 18.( 0,09 + y) => 24x – 18y = 2,04g => x = 0,385 mol ; y = 0,4 mol => m = 8,8 gam
Câu 49 :
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
Đáp án : D Phương pháp giải :
+) Với HCl điện li hoàn toàn => [H+] = a +) Với CH3COOH điện li yếu => [H+] = 0,01a +) Sử dụng công thức: pH = -log[H+] Lời giải chi tiết :
Đặt a là nồng độ mol/l của 2 axit Với HCl điện li hoàn toàn => [H+] = a => pH = x = -log[H+] = -log(a) Với CH3COOH điện li yếu, 100 phân tử CH3COOH mới có 1 phân tử phân li => [H+] = 0,01a => pH = y = -log[H+] = -log(0,01a) = 2 – log(a) = 2 + x Vậy y = x + 2
Câu 50 :
Nhiệt phân hoàn toàn hỗn hợp BaCO3, MgCO3, Al2O3 được rắn X và khí Y. Hoà tan rắn X vào nước thu được kết tủa E và dung dịch Z. Sục khí Y dư vào dung dịch Z thấy xuất hiện kết tủa F, hoà tan E vào dung dịch NaOH dư thấy tan một phần được dung dịch G. Các chất trong dung dịch G và kết tủa F là
Đáp án : B Phương pháp giải :
Dựa vào các phản ứng hóa học => xác định sản phẩm sau phản ứng Lời giải chi tiết :
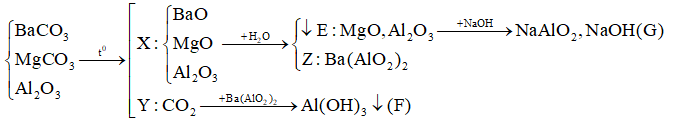 (Vì E tan 1 phần trong kiềm => trong E chứa Al2O3 còn dư => dung dịch Z không còn Ba(OH)2 |












