Nội dung từ Loigiaihay.Com
Trong công nghiệp, kim loại nhôm được sản xuất từ quặng bauxite Al2O3.2H2O bằng phương pháp điện phân nóng chảy với điện cực than chì và có mặt cryolite. Ở cathode thu được kim loại nhôm, ở anode chỉ thu được hỗn hợp khí CO và CO2 theo tỉ lệ thể tích 1:1. Nếu thu được 99,16 m3 (ở đkc) hỗn hợp khí ở anode thì cần bao nhiêu quặng bauxite, biết hiệu suất cả quá trình điện phân là 80%?
Dựa vào phương pháp tách kim loại.
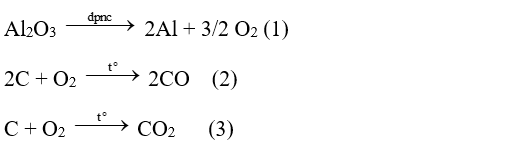
Vì nCO = nCO2 = \(\frac{{99,{{16.10}^3}}}{{24,79}}.\frac{1}{2}\) = 2.103 mol
Theo (2) và (3), ta được: nO2 = \(\frac{1}{2}{n_{CO}} + {n_{C{O_2}}}\)= \(\frac{1}{2} \times {2.10^3} + {2.10^3} = {3.10^3}\) (mol)
Theo (1), nAl2O3 = \(\frac{2}{3}{n_{{O_2}}} = \frac{2}{3}{.3.10^3}\) = 2.103 (mol)
Khối lượng quặng: mAl2O3.2H2O = 2.103.138 = 276.103 (gam) = 276 kg
Vì hiệu suất cả quá trình là 80% nên mquặng = 276.100/80 = 345 (kg).

Các bài tập cùng chuyên đề












