Nội dung từ Loigiaihay.Com
Một khinh khí cầu có khoang chứa và hành khách với tổng khối lượng là 450 kg. Phần khí cầu chứa 3,00 . 103 m3 không khí. Lấy g = 9,81 m/s2.
a) Tính lực tối thiểu để nâng khinh khí cầu lên khỏi mặt đất.
b) Áp suất khí quyển là 1,03 . 105 Pa và khối lượng riêng không khí là 1,29 kg/m3. Tính số mol không khí trong khí cầu. Coi không khí là khí lí tưởng có nhiệt độ 25 °C.
c) Khi không khí được đốt nóng, nó sẽ dãn nở và một phần bị đẩy ra ngoài qua lỗ thông hơi ở phía trên khí cầu. Tính nhiệt độ tối thiểu mà không khí bên trong khí cầu cần đạt tới để khinh khí cầu rời khỏi mặt đất. Coi khí cầu có dạng hình cầu bán kính R khi thực hiện các phép tính.

Vận dụng định luật Archimedes và phương trình trạng thái khí lí tưởng
a) \({F_n} \ge {F_g} \Rightarrow {V_k}.{\rho _k}.g \ge {m_t}.g \Rightarrow {F_n} \ge 580,5N\)
b) \(n = \frac{{{p_a}{V_k}}}{{RT}} = 123,5mol\)
c) \({T_m} = \frac{{{p_a}{m_t}}}{{nR{\rho _k}}} = 324,5K\)

Các bài tập cùng chuyên đề
Các định luật Boyle và Charles chỉ xác định mối liên hệ giữa hai cặp thông số "áp suất - thể tích" và "thể tích - nhiệt độ" của một khối lượng khí xác định. Vậy, làm thế nào để xác định được mối liên hệ của cả ba thông số trạng thái của một khối lượng khí xác định?
Hãy dựa vào các định luật Boyle, Charles và Hình 11.1 về quá trình chuyến trạng thái của một khối lượng khí xác định để lập phương trình dưới đây về mối liên hệ giữa ba thông số trạng thái của một khối lượng khí xác định:
\(\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}} \Rightarrow \frac{{pV}}{T}\)= hằng số
Độ lớn của hăng số trên phụ thuộc vào lượng khí ta xét.
1. Hãy lập phương trình \(\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}}\) bằng một cách biến đổi trạng thái khác cách trong Hình 11.1 để chứng tỏ: Quá trình chuyển trạng thái không phụ thuộc cách chuyển trạng thái mà chỉ phụ thuộc trạng thái đầu và trạng thái cuối.
2. Tại sao không gọi phương trình (11.1) là phương trình trạng thái của chất khí mà lại gọi là phương trình trạng thái của khí lí tưởng?
1. Hãy biểu diễn bằng đồ thị trong hệ toạ độ (p - V) các quá trình chuyển trạng thái vẽ ở
Hình 11.1.
2. Từ phương trình trạng thái của khí lí tưởng suy ra hệ thức liên hệ giữa áp suất và nhiệt độ tuyệt đối trong quá trình đẳng tích.
1. Bóng thám không. Bóng thám không được sử dụng để thu thập thông tin về môi trường không khí và thời tiết. Bóng thường được bơm khí hiếm nhẹ hơn không khí, nhờ đó có thể bay lên các tầng không khí khác nhau để thu thập thông tin về nhiệt độ, độ ẩm, áp suất, tốc độ gió,...
Người ta muốn chế tạo một bóng thám không có thể tăng bán kính lên tới 10 m khi bay ở tầng khí quyển có áp suất 0,3.105 Pa và nhiệt độ 200 K. Hỏi bán kính của bóng khi vừa bơm xong phải bằng bao nhiêu? Biết bóng được bơm ở áp suất 1,02.105 Pa và nhiệt độ 300 K.
2. Túi khí. Trong ô tô, người ta thường đặt ở hệ thống tay lái một thiết bị nhằm bảo vệ người lái xe khi xe gặp tai nạn, gọi là "túi khí". Túi khí được chế tạo bằng vật liệu co giãn, chịu được áp suất lớn. Trong túi khí thường chứa chất NaN3 khi xe va chạm mạnh vào vật cản thì hệ thống cảm biến của xe sẽ kích thích chất rắn này làm nó phân huy tạo thành Na và khí N2. Khí N2 được tao thành có tác dung làm phồng túi lên, giúp người lái xe không bị va chạm trực tiếp vào hệ thống lái (Hình 11.2).
a) Viết phương trình phân hủy NaN3.
b) Tính lượng chất khí N2 được giải phóng khi xảy ra phản ứng phân hủy NaN3, biết trong túi chứa 100 g NaN3 và thể tích mol là 24,0 lít /mol.
c) Biết thể tích túi khí khi phồng lên có độ lớn tới 48 lít. Bỏ qua thể tích khí có trong túi trước khi phồng lên và thể tích của Na được tạo thành trong túi do phản ứng phân huỷ. Tính áp suất của khí N2 trong túi khí khi đã phòng lên, biết nhiệt độ là 30 °C.
Để giải các bài tập về sự chuyển trạng thái của khí lí tưởng thì cần dùng những công thức nào? Nêu rõ ý nghĩa và cách dùng của từng công thức.
1. Hãy giải bài tập ví dụ 2 bằng cách vẽ đường đẳng tích thay cho đường đẳng áp.
2. Hãy dùng phương trình \(\frac{{pV}}{T}\) = hằng số để giải Bài tập ví dụ 3.
Một bình dung tích 40 dm3 chứa 3,96 kg khí oxygen. Hỏi ở nhiệt độ nào thì bình có thế bị vỡ, biết bình chỉ chịu được áp suất không quá 60 atm. Lấy khối lượng riêng của oxygen ở điều kiện tiêu chuẩn là 1,43 kg/m3.
Một bình chứa một chất khí được nén ở nhiệt độ 27 °C và áp suất 40 atm. Nếu nhiệt độ của khí giảm xuống còn 12 °C và một nửa lượng khí thoát ra khỏi bình thì áp suất khí sẽ bằng bao nhiêu?
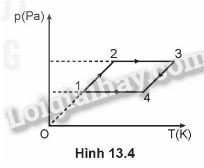
Hình 13.4 vẽ đường biểu diễn bốn quá trình chuyển trạng thái liên tiếp của một lượng khí trong hệ toạ độ (p,T): (1 → 2); (2 → 3); (3 → 4); (4 → 1). Hãy chứng tỏ rằng chỉ có một trong bốn quá trình trên là đăng tích.
Hình 7.1 cho thấy một người đang bơm xe đạp, mỗi động tác đẩy pit-tông xuống ứng với một lượng không khí đang được đưa vào trong săm xe. Trong quá trình bơm, tất cả các thông số trạng thái: thể tích, áp suất, nhiệt độ và cả lượng không khí trong săm xe thay đổi. Sự thay đổi của các thông số này tuân theo quy luật nào?

Quan sát Hình 7.2, thảo luận và thực hiện các nhiệm vụ sau:
a) Khối khí biến đổi trạng thái (1) → (1') theo quá trình nào? Viết biểu thức liên hệ giữa p1, V1 và p2 ,V2
b) Khối khí biến đổi trạng thái (1’) → (2) theo quá trình nào? Viết biểu thức liên hệ giữa V’, T1 và V2, T2
c) Từ hai biểu thức ở câu a và b, thiết lập mối liên hệ giữa p1, V1, T1, và p2, V2, T2
Kết quả câu thảo luận 1 có thay đổi không nếu cho khối khí biến đổi từ trạng thái 1 sang trạng thái 2 thông qua trạng thái trung gian 1" theo trình tự: biến đổi đẳng áp sau đó biến đổi đẳng nhiệt
Áp dụng phương trình trạng thái của khí lí tưởng, thiết lập mối liên hệ giữa áp suất và nhiệt độ tuyệt đối của khí trong quá trình đẳng tích. Vẽ phác đồ thị đường đẳng tích trong hệ toạ độ V- T.
Một chiếc lốp ô tô chứa không khí có áp suất tiêu chuẩn do nhà sản xuất công bố là 2,3 bar ứng với nhiệt độ 25 °C (1 bar = 105 Pa). Khi xe chạy nhanh, lốp xe nóng lên làm cho nhiệt độ không khí trong lốp tăng lên tới 50 °C. Tính áp suất của không khí trong lốp xe lúc này.
(Coi gần đúng thể tích của lốp xe không đổi trong suốt quá trình nóng lên)
Hình 7.4 là hình ảnh một bình xịt côn trùng. Vì sao người ta đưa ra khuyến cáo "Không được ném bình vào lửa ngay cả khi đã dùng hết"?
Người ta nén 10 lít khí ở nhiệt độ 27 °C, áp suất 1 atm để thể tích của khí chỉ còn 4 lít. Vì nén nhanh nên khí bị nóng lên đến 60 °C. Áp suất khối khí sau khi nén là
A. 2,78 atm.
B. 2,25 atm.
C. 5,56 atm.
D. 1,13 atm.
Sử dụng một cái bơm đế bơm không khí vào quả bóng đá có bán kính khi bơm căng là 11 cm.
Mỗi lần bơm đưa được 0,32 lít khí ở điều kiện 1 atm vào bóng. Giả thiết rằng quả bóng trước khi bơm không có không khí và nhiệt độ không đổi trong quá trình bơm. Hỏi sau 35 lần bơm thì áp suất khí trong bóng là bao nhiêu?
Giác hơi là một kĩ thuật chữa bệnh trong đông y để điều trị các bệnh do nguyên nhân hàn (lạnh) gây ra như: đau bụng, lưng, vai, gáy, cổ,... Trong giác hơi khô (Hình 7P.1), không khí bên trong những chiếc cốc thủy tinh được đốt nóng bằng que lửa, sau đó úp nhanh cốc lên vùng đau của người bệnh. Theo quan điểm của đông y, giác hơi giúp thải các độc tố tích tụ dưới lỗ chân lông ra khỏi cơ thể. Giải thích tại sao vùng da bên trong các cốc lại bị lỗi lên, từ đó có thể giải phóng các độc tố khỏi cơ thể, làm người bệnh giảm đau và đỡ mỏi hơn.
Bình chứa oxygen (Hình 2.1) là một thiết bị thường dùng trong điều trị người bệnh có vấn đề về hô hấp. Tuy nhiên, khi sử dụng bình cần đặc biệt chú ý nơi bảo quản nhằm đảm bảo an toàn do nguy cơ cháy nổ cao. Khí oxygen trong bình ở áp suất cao nên không phải là khí lí tưởng. Tuy nhiên, người ta vẫn sử dụng mô hình khí lí tưởng để tìm hiểu mối liên hệ giữa các thông số của một lượng khí như áp suất, nhiệt độ và thể tích, từ đó suy ra nguyên tắc bảo quản và sử dụng an toàn các bình chứa khí. Vậy mối liên hệ đó như thế nào?

Lập phương án thí nghiệm tìm mối liên hệ giữa thể tích khí và áp suất của nó khi giữ nhiệt độ không đổi với các dụng cụ thực hành ở trường của bạn.
Việc dịch chuyển pit-tông từ từ giúp đảm bảo điều kiện gì?
Với quá trình biến đổi được biểu diễn trên Hình 2.9, hãy so sánh nhiệt độ, thể tích, áp suất của trạng thái 1 với trạng thái 2, của trạng thái 2' với trạng thái 2.
Hãy giả sử chất khí biến đổi từ trạng thái 1 sang trạng thái 2 qua trạng thái trung gian 3 (khác với 2") và lập luận để vẫn thu được công thức (2.6)
Một lốp xe chứa 0,020 m3 không khí ở 27 °C và áp suất 3,0 . 105 Pa. Tính khối lượng không khí trong lốp xe. Biết khối lượng mol của không khí là 28,8 g/mol.
Hãy vận dụng đinh luật Boyle để giải thích nguyên lí hoạt động của loại bình xịt như trong Hình 2.10.
Trong lịch sử, phương trình trạng thái của khí lí tưởng được Clapeyron (Cla-pê-rôn) rút ra từ kết quả của ba định luật thực nghiệm về chất khí là: định luật Boyle (mô tả quá trình đẳng nhiệt), định luật Charles (mô tả quá trình đẳng áp) và định luật Gay-Lussac (mô tả quá trình đẳng tích). Phương trình trạng thái của khí lí tưởng cho thấy rằng ba định luật về chất khí không độc lập với nhau. Hãy tìm hiểu để phát biểu và viết công thức mô tả mối liên hệ giữa áp suất và nhiệt độ của một lượng khí lí tưởng trong quá trình đẳng tích.
Từ phương trình trạng thái của khí lí tưởng, có thể suy ra mối liên hệ nào giữa áp suất và nhiệt độ của một lượng khí trong quá trình biến đổi mà thể tích được giữ không đổi?
A. \(p = \frac{V}{T}\)
B. \(\frac{{{p_1}}}{{{T_1}}} = \frac{{{p_2}}}{{{T_2}}}\)
C. \({p_1}{V_1} = {p_2}{V_2}\)
D. \(\frac{{{p_1}}}{{{T_2}}} = \frac{{{p_2}}}{{{T_1}}}\)
Một bình chứa 40,0 dm3 carbon dioxide (CO2) có áp suất 4,8.105 Pa ở nhiệt độ phòng.
Biết khối lượng mol của CO2 là 44 g/mol. Tính:
a) Số mol CO2 trong bình.
b) Khối lượng CO2 trong bình.
Một bình chứa 500,0 g helium (He) ở áp suất 5,0.105 Pa và nhiệt độ 27 °C. Cho rằng khí He trong bình là một khí lí tưởng.
a) Hãy tính số nguyên tử He trong bình. Biết khối lượng mol He là 4g/mol.
b) Tính thể tích binh.
c) Khi van của bình được mở ra trong một thời gian ngắn, một lượng nhỏ He thoát ra làm nhiệt độ của He giảm đáng kể. Giải thích tại sao nhiệt độ của He giảm.












