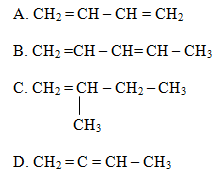
Bài 7 trang 138 SGK Hóa học 11Đốt cháy hoàn toàn 5,40g ankadien liên hợp X thu được 8,96 lít khí CO2 (đktc). Công thức nào sau đây là công thức cấu tạo của X Đề bài Đốt cháy hoàn toàn 5,40g ankadien liên hợp X thu được 8,96 lít khí CO2 (đktc) Công thức nào sau đây là công thức cấu tạo của X ?
Video hướng dẫn giải Phương pháp giải - Xem chi tiết Gọi công thức phân tử của ankadien liên hợp là CnH2n-2 ( n ≥ 4) Tính số mol của CO2 BTKL => mH = mX – mC =? => nH2O= ? Đốt cháy X luôn có: nX = nCO2 – nH2O =? (mol) (Vì X có 2 liên kết pi trong phân tử) \(n = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = ?\) => CTPT và CTCT của X Lời giải chi tiết Gọi công thức phân tử của ankadien liên hợp là CnH2n-2 ( n ≥ 4) Ta có: \({n_{C{O_2}}} = \dfrac{{8,96}}{{22,4}} = 0,4\,\,mol\) \( \to {n_C} = {n_{C{O_2}}} = 0,4\,\,mol \to {m_C} = 0,4.12 = 4,8\,\,gam\) \( \to {m_H} = 5,4 - 4,8 = 0,6\,\,gam\) \( \to {n_H} = \dfrac{{{m_H}}}{1} = \dfrac{{0,6}}{1} = 0,6\,\,mol\) \( \to {n_{{H_2}O}} = \dfrac{1}{2}{n_H} = \dfrac{1}{2}.0,6 = 0,3\,\,mol\) Đốt cháy ankađien ta có: \({n_{ank{\rm{ađ}}ien}} = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,4 - 0,3 = 0,1\,\,mol\) \( \to số\,\,C = n = \dfrac{{{n_{C{O_2}}}}}{{{n_{anka{\rm{đ}}ien}}}} = \dfrac{{0,4}}{{0,1}} = 4\) Vậy CTPT của X là C4H6 Vì X là ankađien liên hợp nên CTCT của X là CH2=CH-CH=CH2 Đáp án A HocTot.Nam.Name.Vn
|